翰宇药业,在6.24日晚公告,其利拉鲁肽注射液获得美国FDA暂定批准。
其中,大部分人对于“暂定批准”有疑问,就此问题,我来阐述一些个人拙见。
首先,暂定批准的原因公司公告已经披露了(指FDA已经完成仿制药的所有审评要求,即药品经审查,质量、安全和有效性已符合在美国上市的标准,出于专利权和/或独占权(exclusivity )未到期的原因,而给予的一种批准形式。直至专利或独占权问题解决后,美国FDA才能给予在美国终端市场销售的资格)
那么问题就在于,利拉鲁肽的专利权和独占权。
1、先说独占权
(1)诺和诺德的利拉鲁肽,于2009年在欧洲上市,2010年在美国上市。
大家查一下FDA关于独占权的说明便可知道,关于罕见药上市,最长的独占期可以给到7年。那么我们姑且认为,利拉鲁肽的独占期是7年,那么到现在也该到期了。
(2)关于Teva授权仿制药利拉鲁肽
首先,我在FDA网站上关于利拉鲁肽,并没有查到Teva,但Hikma的利拉鲁肽制剂却可以查到。
FDA规定对于首仿药,即首个通过专利挑战获批的仿制药,有180天的独占期。
但是Teva是通过授权仿制,不是通过专利挑战获批的,且由于FDA上目前查不到Teva关于利拉鲁肽的批,是否意味着,Teva并非真正意义上的“首仿药”。
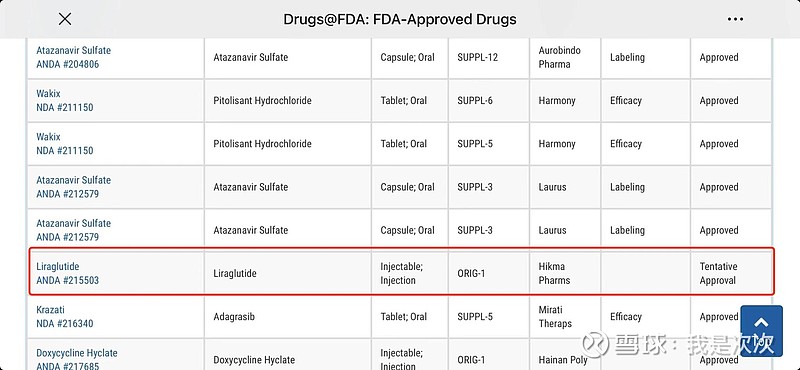
2、关于专利权。翰宇在曾公告“基于该合作方与原研药成了和解以协议,该合作方可于2024年庭外和解书约定的时间在美国销售利拉普肽注射液的仿制药,具备销售资格”
庭外和解约定的时间,我致电了公司,得到答案是,不与披露。
我查了2021年诺和诺德起诉Hikma的卷宗,其中涉及四项专利,我在下方已经贴出来了,判决书结论是,如果涉及侵权,可以通过赔偿+支付利息解决。





3、公司于2024.6.7公告,利拉鲁肽首次出口美国,根据我电话致电,得到的答案是,这批商品,一旦离开中国港口,公司就会确认收入(这部分收入应该是原材料的价格,由Hikma支付)一旦上市销售,到时候利润会按约定比例分,那么其实,销售压力是给到Hikma的。
4、关于6.7号出海的那批利拉鲁肽制剂的保质期,我这边得到的消息是,未开封30个月。公司保证在上市销售前,这批货物不会失效。
综上所述,翰宇药业,真正的困境反转,耐心是黄金,未来可期!