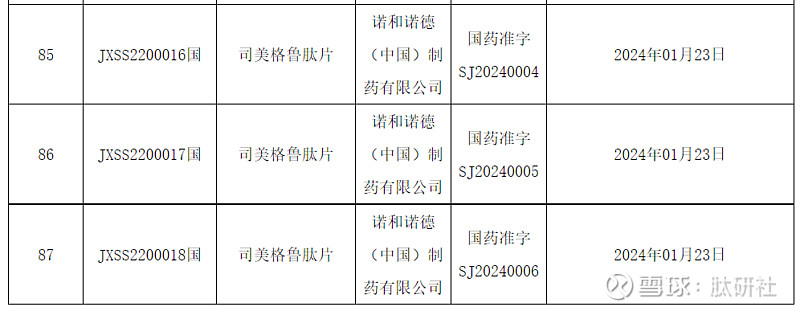
快 讯
2024年1月26日,Novo Nordisk司美格鲁肽片获NMPA批准上市, 用于治疗2型糖尿病。
Semaglutide是Novo Nordisk最强势的“印钞机”,在Semaglutide产品系列的带领下,Novo Nordisk股价一路飙升,公司市值赶超全球奢侈品行业的龙头企业LVMH集团,成为全欧洲市值最高的公司。去年上半年, Novo Nordisk的Semaglutide一骑绝尘荣登多肽药物销售榜榜首,注射降糖版本Ozempic、口服降糖版Rybelsus、注射减肥版Wegovy销售额分别为$6057.6 Mn、$1210.9 Mn、$1753.2 Mn,合计销售额高达$9021.7 Mn,同比增长85%,预计2023年全年销售额超过$20Bn。
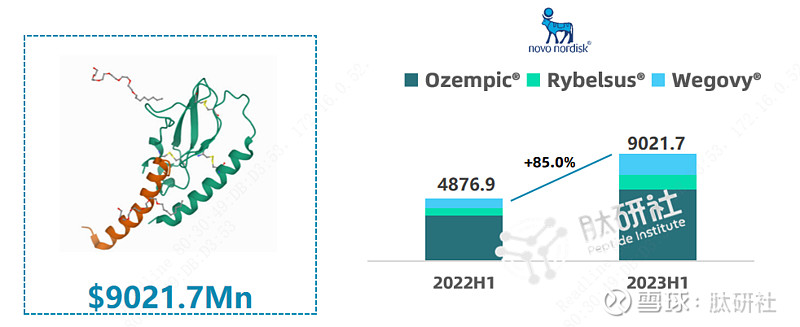
图1. Semaglutide 2023H1销售情况
这是国内首个获批上市的口服GLP-1(胰高血糖素样肽-1)受体激动剂,摆脱了注射带来的不便,提高了用药依从性和便利性。
众所周知,肽分子的缺陷限制了其给药途径,导致其主要局限于注射给药,这降低了患者用药依从性和便利性,使得患者感到不适。因此,肽类药物剂型改良的终极目标为口服制剂,能改善依从性即意味着找到突破口,抓住了竞争筹码。
于是,GLP-1领域迎来了一位重磅合作伙伴——SNAC。
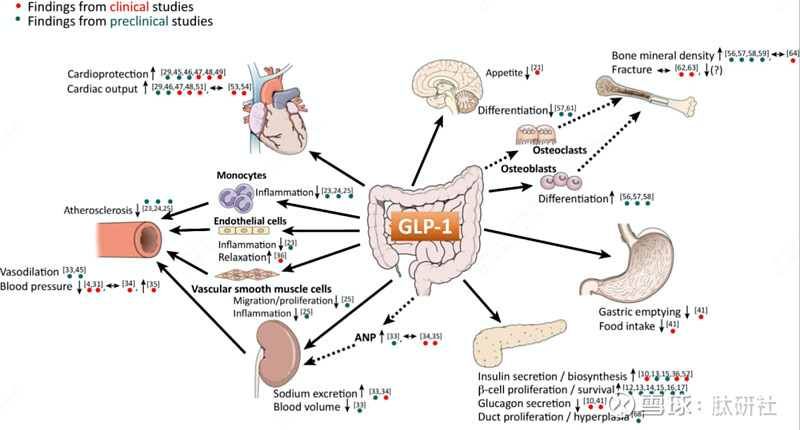
图2. GLP-1作用机理
SNAC递送系统
1.SNAC发展史
SNAC是由Emisphere开发的水杨酸的合成N-酰化氨基酸衍生物的Eligen®技术,诞生于20世纪90年代。作为肠道渗透促进剂(PEs),SNAC可以同多肽一同粘附在胃粘膜上,从而促进渗透吸收。口服司美格鲁肽Rybelsus®是第一款基于PEs策略开发的口服肽药物,它以辛酸钠(SNAC)为PE,分别于2019年9月和2020年3月获得FDA和EMA的批准,使得SNAC进入全球大众的视野。
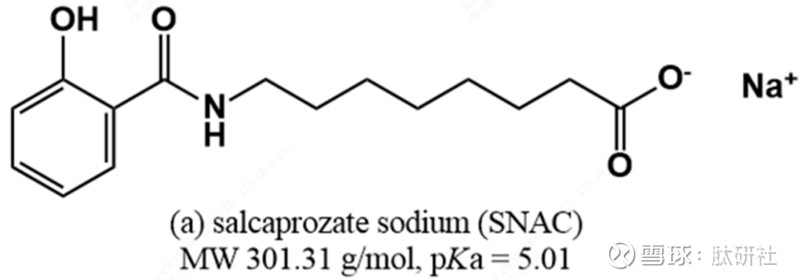
图3. SNAC分子结构
Eligen®是Emisphere的口服制剂技术平台,主要用于多肽以及蛋白质药物的口服递送。Emisphere开发了1000多个能够通过小肠壁的小分子量吸收促进剂——N-乙酰化α-氨基酸库,即Eligen®。SNAC(N-[(2-羟基苯甲酰)胺基)]辛酸钠)是其重要产品。Eligen®分子通过与有效载荷(药物)的非共价相互作用来增加疏水性的载体,旨在增加跨细胞吸收。Eligen B12(维生素B12)于2014年被FDA批准为医疗食品,这是第一个使用SNAC商业化的产品。作为获批的一部分,SNAC同时获得GRAS认证,一定程度地证明了SNAC的安全性。
Novo Nordisk从2007年开始即与Emisphere展开合作,将Eligen™ 技术应用于口服胰岛素、口服GLP-1受体激动剂,这便有了“当红炸子鸡”——Rybelsus®。
2.SNAC工作原理
Rybelsus®不是应用肠溶包衣技术,而是将Semaglutide与SNAC一起构成口服配方。SNAC基于它的亲脂性,能够嵌入到细胞膜上,帮助Semaglutide和SNAC被细胞快速吸收,使Semaglutide达到一定的口服生物利用度。Semaglutide的吸收主要是由于SNAC的间接作用。首先,当片剂在胃内崩解后时,一方面,SNAC通过缓冲作用升高胃内局部pH,胃局部pH值的升高减少了胃蛋白酶对Semaglutide的降解;另一方面,SNAC通过改变溶解片剂的溶液极性来促进Semaglutide的单体化,从而削弱疏水相互作用,否则会促进Semaglutide寡聚化。接着,SNAC被结合到胃细胞的脂质膜中,进而允许Semaglutide跨细胞通过,这种作用是暂时并且可逆的。
单次口服Rybelsus®后显示片剂的崩解及吸收是在胃中,这与大多数口服药物在小肠吸收有所不同。Rybelsus®通过优化配方下沉到胃的下部,局部崩解,侵蚀整个片剂后被吸收,即在胃中发生完全片剂侵蚀(CTE)。与未结扎的狗相比,接受幽门结扎的狗(以防止肠道吸收)的血浆Semaglutide浓度相似,脾静脉中的血浆浓度显著高于门静脉,进一步证明胃是吸收部位。
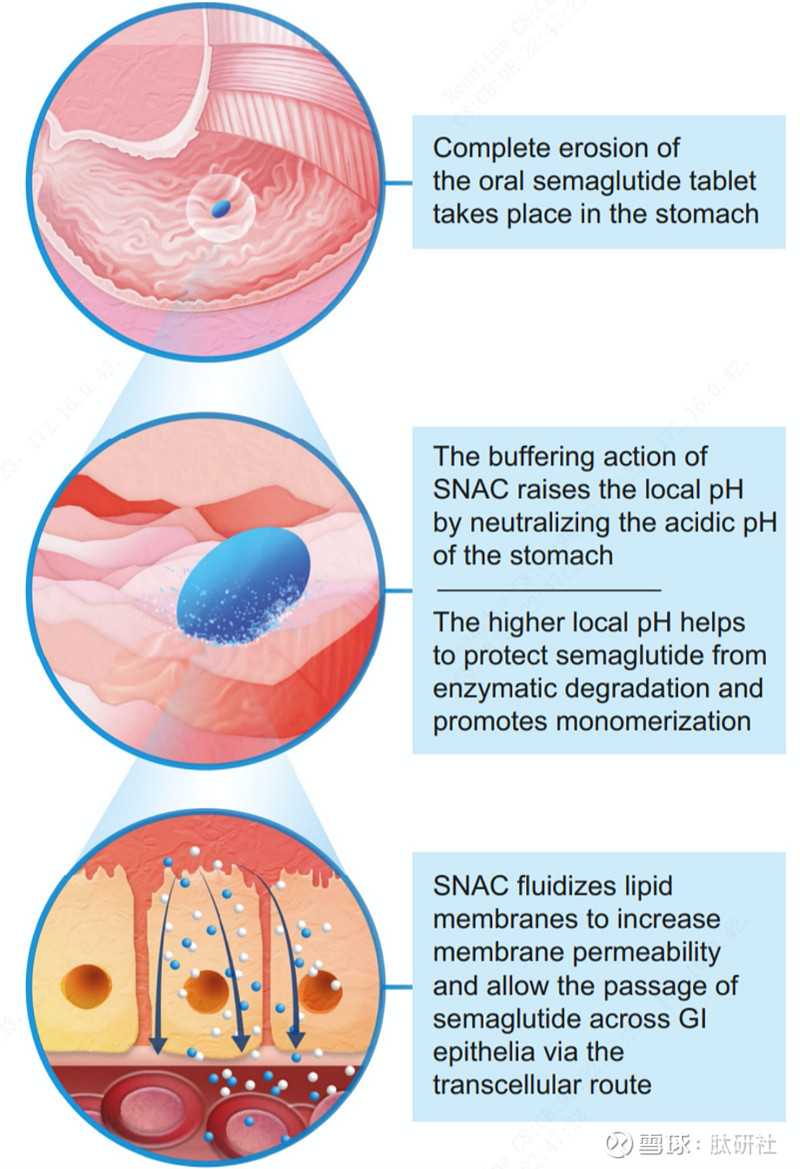
图4. SNAC工作原理
图5.Rybelsus片剂的配方设计和SNAC的司美格鲁肽吸收增强机制示意图
SNAC or Snack?
虽然口服司美格鲁肽通过了广泛的临床试验,也得到了FDA认可,但研究人员发现SNAC对肠道微生物有负面影响,以下是肽研社总结的四大对SNAC的猜想:
1. SNAC的安全性、重复性质疑?
Riley等人在体内水平和Rybelsus临床试验过程中广泛研究了SNAC的安全性。在大鼠模型中对SNAC的亚慢性毒性和围产期和产后发育毒性进行了体内毒性研究。在Sprague Dawley大鼠(雄性(n = 20),雌性(n = 20))中,以2g / kg /天给予SNAC,持续13周,雄性死亡率为20%,雌性死亡率为50%,显示出显着的死亡率,特别是在雌性中。虽然尚未阐明确切的死因,但与对照组相比,SNAC给药后持续数小时的行为模式(活动减少,虚脱,蓬头垢面等)的变化;球蛋白浓度降低,特别是在雄性大鼠中;在SNAC组中观察到肝脏和肾脏重量略有增加。
在Wistar大鼠中进行亚慢性毒性研究,SNAC治疗为0.1,0.5和1g / kg /天,持续13周。在1g / kg /天的最高剂量下没有观察到死亡或临床症状,他们得出结论,Wistar大鼠的无不良反应水平(NOAEL)为1g / kg /天。在围产期和产后发育毒性研究中,从大鼠着床到哺乳期口服1 g/kg/d,以评估SNAC在后代子宫和母乳中的暴露和毒性。尽管观察到妊娠期死产数量增加,但对暴露于SNAC的存活后代的生长发育没有影响。与MCFA不同,鉴于它自然界中不存在,SNAC可能有更多的安全考虑。
因此,除了与假定机制直接相关的安全问题外,还需要进行更广泛的毒理学研究,例如肠道和整个身体的脱靶作用。肠道组织的损伤和相关肠道炎症是由膜扰动引起的跨细胞PE的主要安全问题。而不需要的物质(肠毒素等)的吸收、全身吸收后其他组织 TJ 完整性的变化以及亚信号传导的脱靶作用正在成为基于 TJ 调节的细胞旁 PE 的代表性安全问题。此外,随着代谢性疾病多肽药物的发展趋势增加,需要连续给药。因此,已经指出了长期给予PEs对肠道正常菌群的影响。
简单地将肽类药物和PE联合使用还不能产生足够的疗效。PE的疗效与肽药物(API)的所需量直接相关。以口服Rybelsus®为例,在狗模型中,Rybelsus®的生物利用度为1%。从给药剂量而言,每周给予一次注射Semaglutide(Wegovy)的初始剂量为0.25mg,维持剂量为仅0.5-2mg,而Rybelsus®的初始剂量为3mg,维持剂量为每天7或14mg。也就是说,口服药物中消耗的Semaglutide的量比注射制剂中的剂量高约80倍或更多倍。这意味着,PE在安全性和有效性方面与API一样重要。
除了安全性和有效性之外,可重复性也是一个重要概念。如果PE增强肽吸收的效果容易受到个体之间的差异和个体内的剂量条件的影响,则可能会引起治疗效果或副作用的降低。实际上由于临床试验中受试者之间的差异很大,因此无法根据给药剂量得出PK参数的差异。另一项研究同样提到,在未来的研究中需要降低受试者之间的变异性,SD值为4%,相对口服生物利用度平均值为7%。
2. SNAC对肠粘膜影响
评估暴露于SNAC超过120min后大鼠和人体组织粘膜的组织学研究发现,SNAC会导致肠粘膜形态发生微小变化。暴露于KH缓冲液和20mM SNAC的大鼠胃粘膜结构完整,仅观察到轻微的扰动。在大鼠十二指肠和空肠粘膜中,在对照和SNAC暴露的组织中观察到绒毛尖端的轻微细胞脱落。在暴露于SNAC后,大鼠回肠和结肠粘膜中没有绒毛尖端,明显脱落更多。如图所示,KH缓冲液中的人结肠粘膜在结构上看起来完整,存在健康的绒毛,与对照组织的绒毛相似。暴露于20mM SNAC的人体组织显示绒毛尖端轻微损伤,而40mM SNAC引起尖端侵蚀。
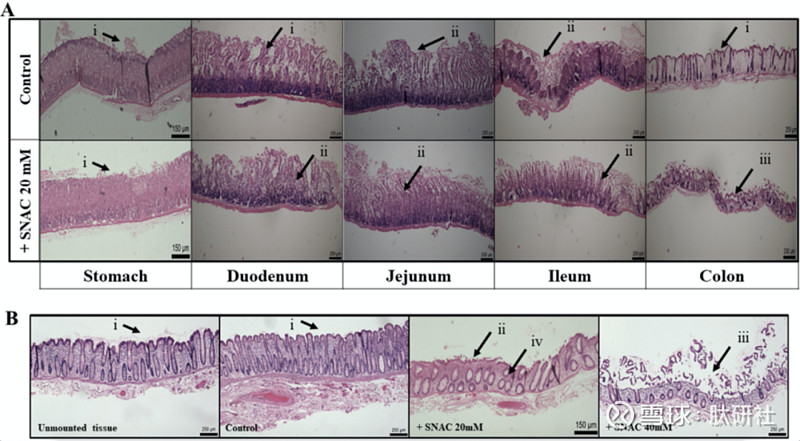
图9.暴露于SNAC时肠粘膜形态的微小变化
3. 常规使用的PE会导致局部炎症、自身免疫性疾病和败血症?
对常规使用 PE 的另一个担忧是基于它们促进微生物组变化和吸收微生物、抗原和毒素的潜在能力,从而导致局部炎症、自身免疫性疾病和败血症。表面活性剂可能会损害保护性粘液层,促进腔内细菌向肠上皮的扩散,并最终扰乱宿主微生物群。在最近的一项研究中,有证据表明,被批准的赋形乳化剂聚山梨酯-80和羧甲基纤维素会干扰微生物群的组成,并诱导小鼠肥胖。目前尚不清楚这些数据对人类是否有影响,但很明显的是,肠道微生物组研究将在口服制剂的毒理学分析中变得越来越重要。
另一个不断被提出的担忧是由PEs引起的组织损伤导致旁观者分子通透性的潜在增加。考虑到渗透增强所需的精确条件(肠上皮同时存在高浓度的有效载荷和 PE),以及候选有效载荷的 MW(<10 kDa)与典型细菌、病毒相比的显着差异,这种担心可能被夸大了。尽管如此,来自酗酒人类受试者的临床药理学数据表明,酒精可以吸收内毒素,并可以促进血浆中1型细胞因子的升高,类似于低度感染;因此,随着相关微生物组变化的研究,我们需要更多的研究来筛选口服PEs慢性暴露后的真正毒理学风险。
4. SNAC的作用机制仍存在争议?
目前对于SNAC的作用机制仍存在争议;包括表面等离子体共振和ITC在内的技术。现在提供的数据表明,肽与SNAC或癸酸钠的非共价相互作用是低亲和力的,并且每种试剂的相互作用非常相似。此外,虽然文献似乎提供了一个共识,即 癸酸钠(低浓度)通过细胞内物质作用于紧密连接,而在高浓度时通过其表面活性物质效应引起的跨细胞干扰作用,但关于SNAC的作用机制却没有相同的共识。20世纪90年代的理论认为,SNAC和有效载荷之间的非共价复合物的亲脂性增加导致了排他的跨细胞作用,这一理论并不令人信服。
关于SNAC的新机制来自于对犬的结扎研究,该机制认为司美格鲁肽周围胃的pH值局部增加,这一机制似乎对这种分子有特异性。最后,针对口服肽递送提出的主要论点是,与注射相比,口服肽递送的便利性更高,从而使患者依从性更好。然而,要求患者在每天早上服用司美格鲁肽/SNAC片剂后等待30min再进食和饮水,也是用药便利性的一大挑战。
解决药物递送的方法
质疑是科学研究不断前进的动力,一项新技术诞生,同行对其可行性进行重复实验,并根据实验效果对技术进行质疑,这是太正常不过的事。这样的质疑在科学研究中屡见不鲜,有的质疑甚至推进了技术的完善、进步。
面对一些针对SNAC递送技术的质疑声,那么全球现在有更好的或者更易于人类吸收的口服肽递送技术吗?
根据谢雨礼博士的研究,目前药物递送的核心是要将适量的药物递送到人体或某个特定部位并保证合理的药物浓度和作用时间。如下表所示,要实现或者提升药物递送效果,理论上有三种方案:
第一是通过改造或者化学修饰优化药物分子本身,提高成药性并使得药物可以方便地通过常见的方式和成熟的制剂技术给药。类似地,多肽偶联药物PDC、小分子偶联药物SMDC,核素偶联药物RDC以及小核酸的GalNac偶联都可以看作一种化学修饰的递送技术。
第二是通过改变人体吸收或者药物作用的微环境提升药物的递送效果。
第三是开发药物递送系统和装置,在药物和体内环境之间添加一道屏障,实现药物的控释。
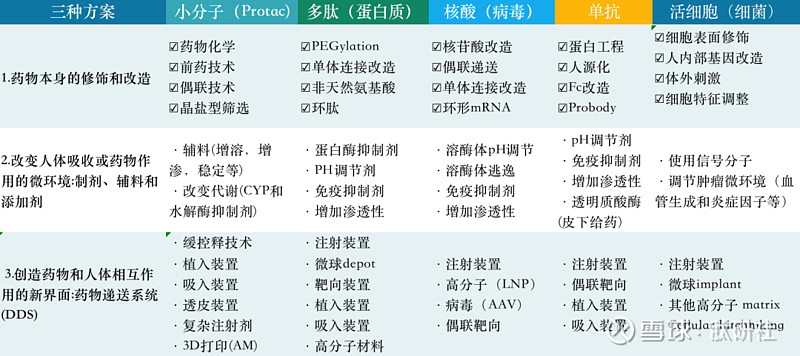
图10. 药物递送的三种方案
药品的制剂创新没有止境,是一个持续的过程。比如,非载体抗炎药物双氯芬酸自1973年第一次上市,几十年间共推出17款不同的制剂产品。新型递送材料,装置以及人工智能和大数据在处方设计中的应用必将推动给药系统和制剂技术的进一步发展。
肽研社盘点了国际先进的口服递送肽技术:
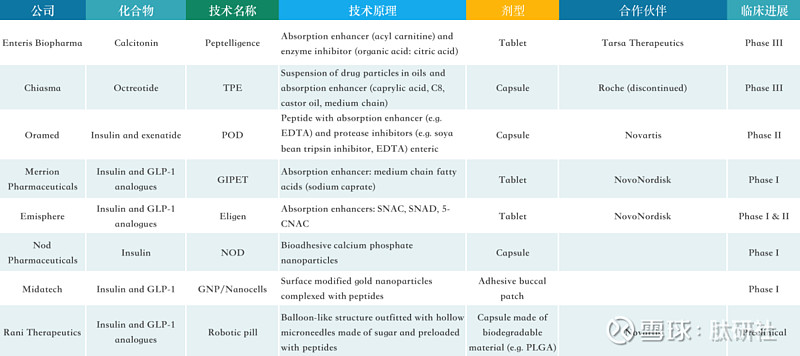
图14. 多肽药物口服递送系统技术汇总
1. POD™技术
Oramed医药公司的POD™(蛋白质口服给药)技术被设计用于:
(1)保护口服蛋白质不受胃肠道中具有破坏力的酶活性的损伤。
(2)增强口服蛋白质通过肠壁的吸收率。
工作原理:活性蛋白,如胰岛素,被封装在具有高度保护性涂层的胶囊中,该涂层可在肠道最酸性的部分保持完整,并由蛋白酶抑制剂提供酶促支持。同时通过肠道屏障的吸收增强剂,进一步确保了药物的生物利用度。最后通过防止蛋白质药物在胃肠道中分解并促进其穿过小肠。
相应管线:ORMD-0801(口服胰岛素)、ORMD-0901(口服GLP-1)。
临床阶段:管线ORMD-0801(口服胰岛素)目前处于临床III期,ORMD-0901(口服GLP-1)目前处于临床I期

图15. Oramed临床管线
2. Peptelligence®技术
Enteris 公司的Peptelligence技术,通过创新的配方和辅料的组合,协同增强渗透和避免肽被消化。与其他技术不同的是,Peptelligence通过将pH值降低、电荷分散、膜润湿和增溶剂巧妙地结合在一个高度可扩展的固体口服剂型中,而无需对原料药进行物理化学修饰,从而提高了口服生物利用度。Peptelligence利用柠檬酸作pH调节剂、酰基肉碱作渗透促进剂,肠溶递送多肽,当前运用该技术开发的产品多达数十种,包括Ovarest,Tobrate,Tbria等。
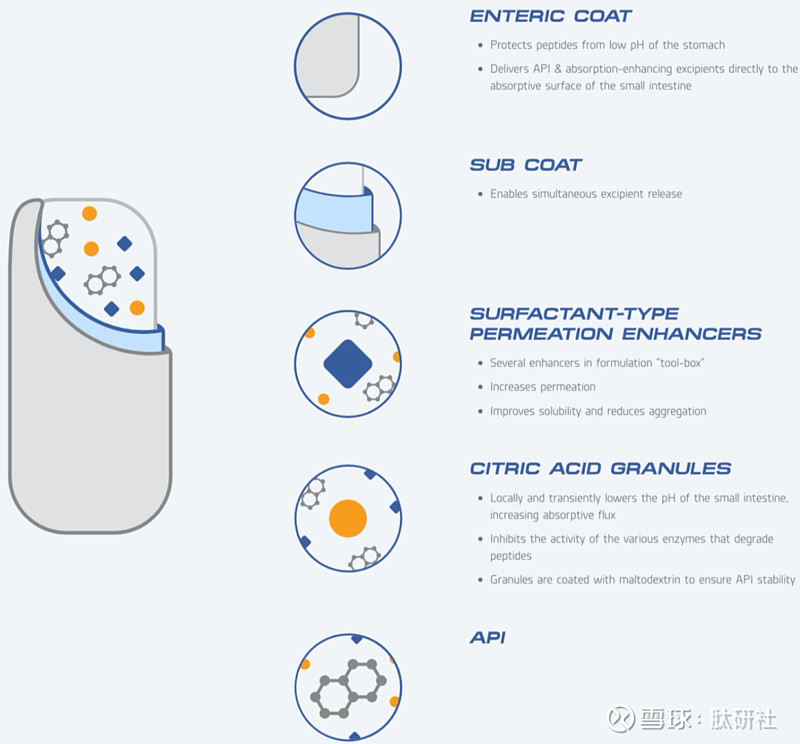
图16. Peptelligence®技术应用
3. GIPET技术
爱尔兰公司Merrion,采用的是GIPET技术平台,在口服药物后变成刺激性低,渗透性强的化合物进入人体血液。该技术采用公认安全(GRAS)等级的成分和口服配方的专利吸收促进剂,激活胶束的形成,从而增强药物吸收。
在一个由30多种低渗透性化合物组成的数据库中,GIPET证明了将化合物吸收提高约200倍的能力。它在所有类型的药物中提供卓越的可重复性和安全性,并导致在最短的上市时间内开发低风险的新口服产品。
基于这项技术的四个内部产品开发方案正在筹备中。这包括Orazol (mer101), Almerol (mer103),Acyline (mer104)和mer102,分别用于肿瘤适应症,骨质疏松症治疗,前列腺癌或预防血液凝固。除了这些药物之外,还将开发口服形式的Novo Nordisk专有GLP-1受体激动剂。
此外,Merrion还将与Ferring Pharmaceuticals合作开展两项口服给药研究项目,涉及一种未公开的Ferring化合物。

图17. GIPET工作原理
4. TPE®技术
Chiasma公司的TPE®系统(专有瞬态渗透性增强剂),它是一种肠溶衣制剂,可保护药物分子免受消化酶的破坏,并促进肠道分子对肠道内生物利用度有限的药物分子的肠道吸收。TPE®可使小肠衬里内由蛋白质组成的密封或紧密连接扩张,让药物制剂进入血液,同时保持毒素、细菌和病毒排除的自然防御机制。一旦进入小肠,包衣胶囊就会溶解并释放TPE®配方。TPE®由辛酸钠(C8)在疏水性微粒中配制而成,并与赋形剂如蓖麻油或中链甘油酯一起搅拌,赋形剂可在疏水性介质中形成固体亲水性颗粒的亲脂性悬浮液。
Chiasma公司的MYCAPSSA®(缓释奥曲肽胶囊)是FDA目前批准的第一个也是唯一的口服生长抑素类似物,也是FDA批准的第一个利用Chiasma瞬时渗透性增强剂(Transient Permeability Enhancer,TPE®)技术的产品。
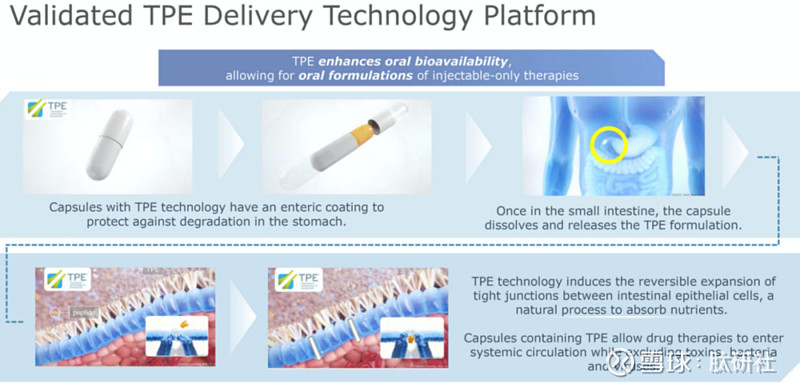
图18. TPE®技术平台
结语
在胃肠道中,多肽的吸收面临一路险阻。为了实现口服递送多肽药物,渗透促进剂逐渐走上了前台,尤其是在Semaglutide的口服制剂Rybelsus获得成功之后。以SNAC为代表的渗透促进剂,为生物大分子的口服递送注入了希望。而即使Rybelsus获得了成功,其生物利用度仍低于1%。
未来随着更多企业参与到口服多肽药物的开发,口服多肽的研究将日趋深入,新的辅料和新的技术也将不断涌入。在进入临床的或者临床前研究的多肽药物中,吸入给药,微针递送,纳米给药系统等方面的研究也日趋成熟,随着新材料和新制剂技术的出现,口服多肽仍然会是生物医药的研究热点之一。
| 引用资料
[1] On drug deliver:Oral heparin administration with a novel drug delivery agent (SNAC) in healthy volunteers and patients undergoing elective total hip arthroplasty
[2]北京生物前沿研究中心:透明质酸合成酶的结构解析
[3]药时代:药物递送——生物医药未来的“卡脖子”技术
[4]MDPI:Intestinal Permeation Enhancers for Oral Delivery of Macromolecules: A Comparison between Salcaprozate Sodium(SNAC) and Sodium Caprate(C10)
[5]ScienceDirect:Salcaprozate sodium (SNAC) enhances permeability of octreotide across isolated rat and human intestinal epithelial mucosae in Ussing chambers
[6]Springer:A new era for oral peptides: SNAC and the development of oral semaglutide for the treatment of type 2 diabetes.
[7]中国药品监督管理局.