文章来源:“凯莱英药闻”微信公众号
5月21日,武田宣布向FDA提交Maribavir上市申请,治疗难治性、有或无耐药性(R/R)的移植后巨细胞病毒(CMV),如获批Maribavir将成为第一个也是唯一一个治疗移植后巨细胞病毒(CMV)感染的药物。

该申请是基于一项III期临床试验AK-620-303(SOLSTICE,NCT02931539),在试验中Maribavir与常规抗病毒药物(研究人员指定的治疗[IAT],以下一种或多种药物的组合:更昔洛韦[ganciclovir]、缬更昔洛韦[valganciclovir]、膦甲酸[foscarnet]、西多福韦[cidofovir])进行了对比。
Maribavir在该III期临床试验中达到了主要终点——治疗第8周(治疗期结束)确认的CMV病毒血症清除率,及关键次要终点——CMV清除率和症状控制维持至第16周,maribavir与常规抗病毒治疗(IAT)相比疗效具有优越性,治疗相关毒性更低。
每年约200000例成人移植(包括接受与造血细胞移植(HCT)或实体器官移植(SOT)等)中,CMV是移植受者最常见的病毒感染之一,SOT患者发病率为16-56%,HCT患者则为30-70%。
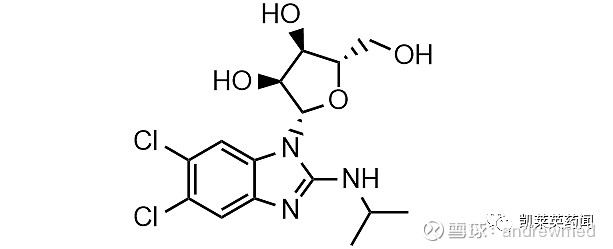
Maribavir是武田近6个月内第4个提交上市申请的新分子实体,也是唯一一款进入抗CMV病毒III期临床的靶向UL97蛋白激酶及其天然底物抑制剂,此前已获FDA授予治疗难治性、有或无耐药性(R/R)的移植后巨细胞病毒(CMV)突破疗法,享有优先审评资格。
版权说明:本文来自凯莱英,感谢关注、转发。欢迎媒体/机构转载,转载请注明来自“凯莱英药闻”。