文章来源:“凯莱英药闻”微信公众号
5月7日,纳斯达克上市创新药开发公司ChemoCentryx公布了FDA咨询委员会对于是否批准avacopan上市的投票结果,对于3个问题,咨询委员会均分歧较大。
第一个问题,有效性数据是否足够支持avacopan治疗成人抗中性粒细胞胞浆抗体(ANCA)相关性血管炎(AAV),包括肉芽肿性多血管炎(GPA) 和显微镜下多血管炎(MPA)。投票结果为9-9。
第二个问题,安全性数据是否足够支持avacopan治疗成人AAV,投票结果为10-8。
第三个问题,风险与获益数据是否足够支持avacopan特定给药剂量(每日给药两次每次30mg)治疗成人AAV,投票结果为10-8。
虽然,三个问题中,两个有利于avacopan,但票数相差不大,结合第一个问题的9比9,说明FDA咨询委员会对于是否支持批准avacopan上市存在较大分歧。
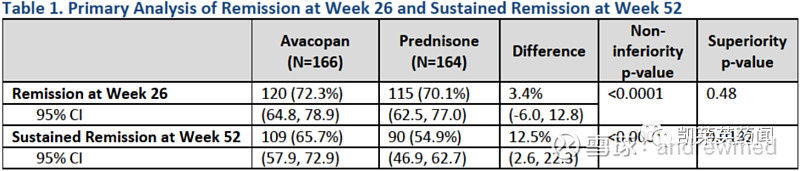
avacopan作为潜在first-in-class(FIC)选择性补体C5a受体抑制剂,如果上市无疑可以增加患者临床用药选择,对比现有激素类药物泼尼松(prednisone),avacopan达到非劣效终点,但优效性方面并不显著。avacopan将产生的高价对比现有药物低廉的价格,无疑会让本就紧张的美国医保更加雪上霜,激素类药物的不良反应问题或许是avacopan最终胜出的关键。
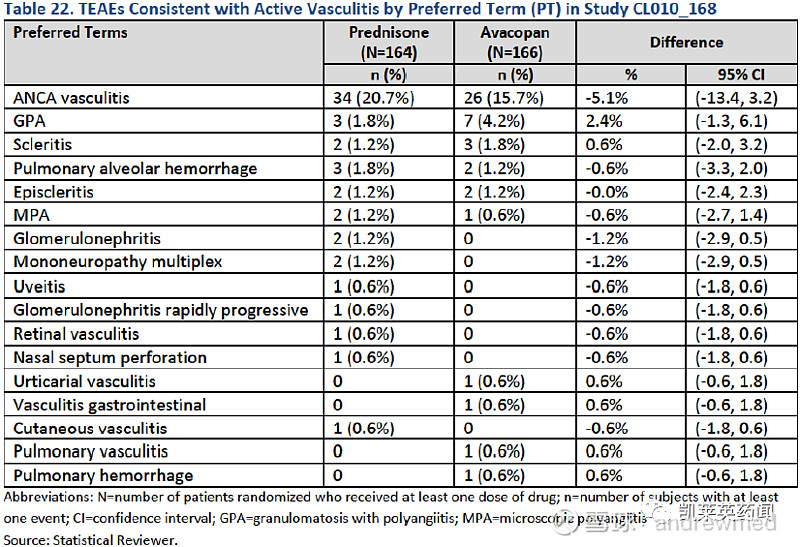
关于AAV
AAV是由补体系统过度激活引起的高度炎症性和进行性自身免疫性疾病,C5a在其中扮演重要角色。该病主要影响肾脏,不过由于反复发作,最终会造成不可逆的器官系统损害(终末期肾病)和死亡。AAV在美国有4.5-10.5万名患者,每年新发病例数约为8000。欧洲患者数量为7-13万人,每年新增患者约5000人。
目前的标准疗法为高剂量类固醇药物(泼尼松)治疗6个月,之后使用环磷酰胺或利妥昔单抗。不过类固醇可能导致感染,而减少类固醇则会带来高复发率,且复发的同时还会出现不可逆转的器官损伤,尤其是肾脏,最终仍有11%-16%的患者在诊断后1年内死亡。
关于avacopan
avacopan是一款选择性补体C5a受体抑制剂,可抑制C5a诱导的免疫细胞活化。
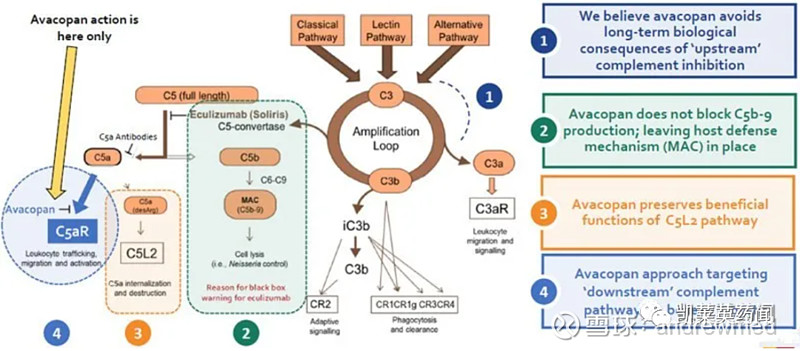
通过阻断破坏性炎症细胞如中性粒细胞表面的促炎性补体系统片段C5aR,avacopan可阻止这些细胞因C5a激活而对机体造成伤害。avacopan的设计有意避开了对补体系统上游的抑制,且没有阻止C5b-9的生成,保留防御机制。此外,由于C5L2(C5aR2)在抗炎等方面的重要作用,avacopan选择仅靶向C5aR(C5aR1/CD88)。
2016年4月,FDA授予avacopan治疗AAV的孤儿药资格;2016年6月,EMA授予avacopan用于AAV的优先药物资格(PRIME)。2020年7月,ChemoCentryx向FDA提交了avacopan用于治疗AAV的NDA,PDUFA日期为2021年7月7日。2020年11月,基于III期临床试验ADVOCATE的结果,EMA受理了avacopan治疗AAV的MAA。
版权说明:本文来自凯莱英,感谢关注、转发。欢迎媒体/机构转载,转载请注明来自“凯莱英药闻”。