文章来源:“凯莱英药闻”微信公众号
3月20日-23日举行的美国内分泌协会(ENDO )年会上,纳斯达克上市公司Strongbridge Biopharma公布了皮质醇合成抑制剂——levoketoconazole(商品名:RECORLEV)治疗库欣综合征的III期临床试验详细数据。
Levoketoconazole的原研公司为Strongbridge Biopharma子公司Cortendo,其临床开发已超过二十年,于2021年3月2日向FDA提交了上市申请。
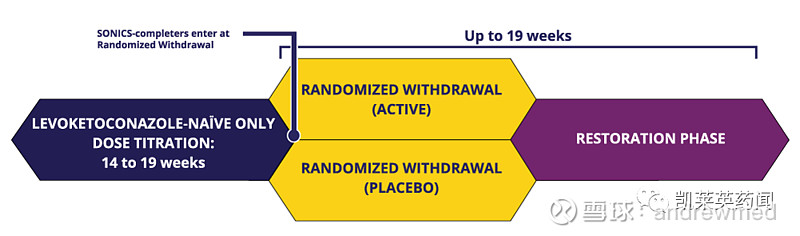
两项III期临床试验(SONICS和LOGICS)的积极结果为Levoketoconazole上市提供了充分的支持,详细试验数据如下:
a.LOGICS主要终点结果显著:随机撤药(RW)期结束时,安慰剂组未达平均尿游离皮质醇(mUFC)患者比例较RECORLEV治疗组高54.5%,p=0.0002。
b.LOGICS次要终点结果同样显著:随机撤药期结束时,RECORLEV治疗组患者维持正常平均尿游离皮质醇(mUFC)的患者比例比安慰剂组高45.5%,p=0.0015。
c.在RW期,服用RECORLEV的中位时间为55.5天(范围:16-62天),服用安慰剂的中位时间为23.0天(范围:16-62天),表明停止服用RECORLEV后皮质醇水平迅速失控。
d.从RW基线到RW期结束,治疗组中总胆固醇和低密度脂蛋白胆固醇平均变化的次要终点显著不同(p<0.01),平均治疗差异分别为37.1和25.1 mg/dL。
e.在初始剂量滴定和维持用药阶段,体重指数(BMI)的平均变化差异为-1.13kg/m2。从RW基线到RW期结束时,RECORLEV治疗组BMI平均变化为-0.65 kg/m2,安慰剂组为+0.59 kg/m2(治疗差异:-1.2 kg/m2;P<0.0001)。
f.两项III期临床试验中共计80名患者接受RECORLEV治疗,最常报告的不良事件(发生率≥15%)是恶心、低钾血症、头痛、高血压和腹泻。与药物有关的严重不良事件发生率为5%,RW期内无患者因不良事件停药,但总体临床试验中有19%的患者因不良事件停药。
2020年3月6日,FDA批准了第一款一线治疗库欣综合征的药物Osilodrostat上市,商品名:Isturisa,Osilodrostat批准上市前,库欣综合征治疗的首选方案为经蝶窦手术切除垂体。levoketoconazole有望成为又一款一线治疗库欣综合征的药物,为患者提供更多选择和可能。
版权说明:本文来自凯莱英,感谢关注、转发。欢迎媒体/机构转载,转载请注明来自“凯莱英药闻”。