文章来源:“凯莱英药闻”微信公众号
2021年3月8日,AnaptysBio宣布imsidolimab用于治疗中度至重度掌跖脓疱病(PPP)的2期临床试验POPLAR的顶线数据未达到主要终点。

Imsidolimab(ANB019)是一款抑制白介素36受体(IL-36R)功能的抗体,AnaptysBio计划将其开发为潜在first-in-class的疗法。
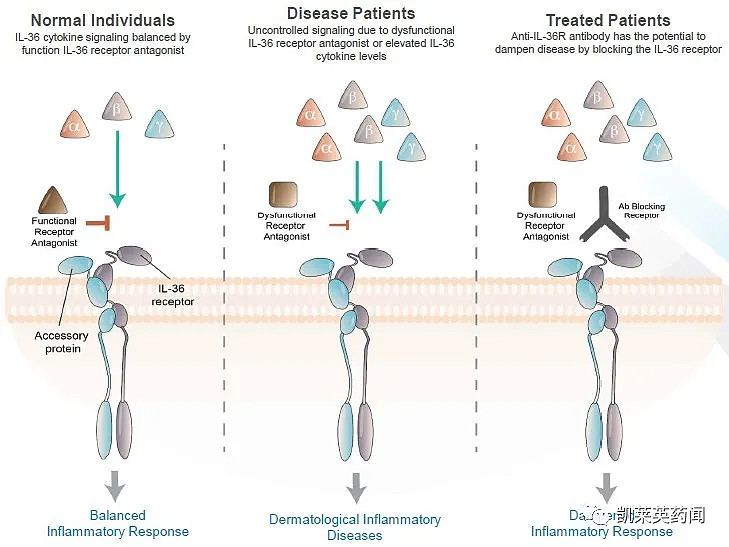
尽管目前尚未有针对PPP的进一步临床开发计划,但AnaptysBio将继续imsidolimab在5种其他免疫皮肤病适应症的开发工作,包括泛发性脓疱型银屑病(GPP)、EGFRi介导皮肤毒性、鱼鳞病、化脓性汗腺炎和痤疮,其中针对GPP的3期临床试验预计将于2021年中期启动。

2期临床试验POPLAR在北美和欧洲的36个机构招募了59名PPP患者。入组的主要标准包括年龄在18至75岁之间,临床确诊的中重度PPP,最低PPPIGA评分至少为3(中度),病史至少为3个月,且入组时手掌和/或足底有脓疱。
患者在第1天接受皮下注射200mg诱导剂量Imsidolimab治疗,然后在第29、57和85天接受每月100mg剂量皮下注射。试验的主要终点是第16周掌跖脓疱型银屑病面积及严重程度指数(PPPASI)相对基线的平均变化。第1天给药前将对每位患者进行基线临床评估。使用重复测量混合模型(MMRM)方法对丢失的数据进行建模。
POPLAR试验主要数据如下:
Imsidolimab组30名患者的平均基线PPPASI评分为16,而安慰剂组29名患者为19,总体平均为18。每组的掌跖脓疱病研究者全球评估(PPPIGA)为3.1。患者平均年龄为50岁,女性占78%。
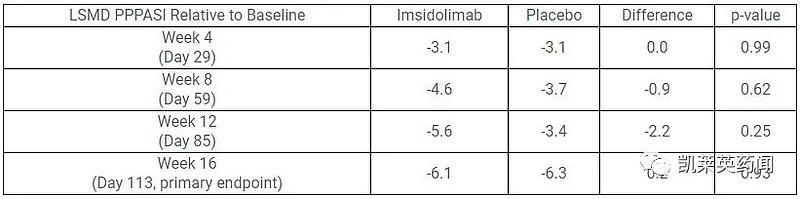
主要终点方面,第16周(第113天),最小二乘均方差(LSMD)PPPASI相对各自基线的改善,接受imsidolimab治疗的患者为6.1,接受安慰剂治疗的患者为6.3,组间差异的p值为0.93。在每个试验组中,有24名患者完成了16周的主要终点分析。
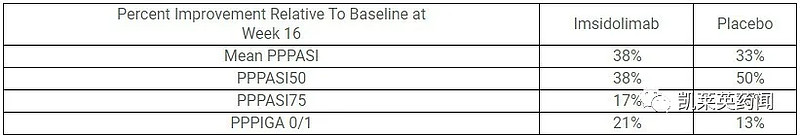
接受Imsidolimab治疗的患者相对基线的平均PPPASI变化为5.78或改善38%,而接受安慰剂的患者相对基线改善了6.78或33%。在每个研究时间点(第3、8、15、22、29、43、57、71、85和113天),接受Imsidolimab治疗的患者相对于接受安慰剂的患者,PPPASI相对于基线的改善比例在数值上更大,幅度约为3%-19%。
第16周,imsidolimab组中有9名(38%)患者实现50%的PPPASI改善(PPPASI50),有4名(17%)患者实现75%的PPPASI改善(PPPASI75),而安慰剂组分别有12名(50%)和3名(13%)患者达到这些应答阈值。
第16周,有5名(21%)接受imsidolimab治疗的患者PPPIGA得分为零(清除)或1(几乎清除),接受安慰剂的患者为3名(13%)。
Isidolimab总体耐受性良好,各治疗组间不良事件发生率相似,在imsidolimab组中未观察到严重不良事件。Imsidolimab和安慰剂组中最常见不良事件分别为3例和4例轻度鼻咽炎,不过均被认为与治疗无关。
版权说明:本文来自凯莱英,感谢关注、转发。欢迎媒体/机构转载,转载请注明来自“凯莱英药闻”