文章来源:“凯莱英药闻”微信公众号
2021年2月24日,艾伯维宣布,FDA已批准HUMIRA®(阿达木单抗)用于治疗5岁以上儿童患者的中度至重度溃疡性结肠炎(UC)。临床试验中,HUMIRA在第8周实现临床缓解,对于在第8周产生应答的患者,第52周仍能维持缓解状态。

该批准基于关键性3期临床试验ENVISION I的结果,研究表明HUMIRA达到共同主要终点,即第8周根据Partial Mayo Score(PMS)的临床缓解,以及第8周有应答的患者,一年(52周)根据Full Mayo Score(FMS)的临床缓解。临床缓解定义为PMS或FMS≤2,且无单个子评分>1。
溃疡性结肠炎以大肠炎症为特征,症状从轻度到重度肠急症和肠失禁以及体重减轻和疲劳。溃疡性结肠炎是终身性疾病,许多患者无法充分控制病情,因此需要更多的治疗选择。与成人相比,中度至重度儿童溃疡性结肠炎仍然存在大量未满足需求,因为儿童患者往往患有更广泛的疾病,导致儿童发病率更高。
ENVISION I是一项随机、双盲、多中心研究,旨在评估HUMIRA在中度至重度溃疡性结肠炎儿童患者(4-17岁)中的有效性、安全性和药代动力学,这些患者FMS为6-12,内镜评分为2-3。
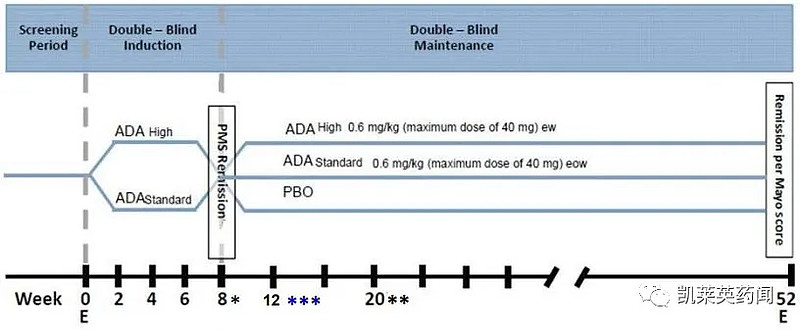
至第8周,两个剂量组的患者在第0周接受2.4 mg/kg(最大160 mg)、第2周接受1.2 mg/kg(最大80 mg)、第4周和第6周接受0.6 mg/kg(最大40 mg)。较高剂量组在第1周还接受了2.4 mg/kg的额外剂量(最大160 mg)。第8周至第52周,患者按照双盲法每隔一周或每周一次接受安慰剂或HUMIRA 0.6 mg/kg(最大40 mg)。
研究结果表明,在8周诱导期结束时,接受较高剂量的患者中有60%[28/47]实现PMS临床缓解,而较低剂量组中有43%[13/30]。第52周,在第8周PMS应答患者中,接受较高剂量的患者中有45%[14/31]实现FMS缓解,接受较低剂量的患者中有29%[9/31],接受安慰剂的患者为33%[4/12]。由于样本量较小,安慰剂数据的可解读性有限。
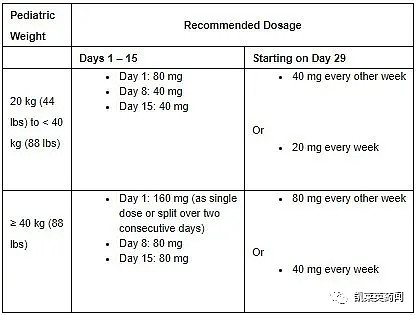
HUMIRA的获批剂量将根据儿童体重确定。对于年龄达到18岁且根据先前给药方案控制良好的患者,建议继续接受推荐的儿童剂量。
在ENVISION I研究中,未观察到HUMIRA新的安全性信号。整个接受治疗的过程中,22.6%的患者出现了严重不良事件。治疗期最常见(≥5%)不良事件是头痛和溃疡性结肠炎恶化。研究中未观察到死亡、恶性肿瘤、活动性结核病或脱髓鞘疾病。
版权说明:本文来自凯莱英,感谢关注、转发。欢迎媒体/机构转载,转载请注明来自“凯莱英药闻”。