文章来源:“凯莱英药闻”微信公众号
BioCryst Pharmaceuticals宣布,FDA已批准每日一次口服ORLADEYO™(berotralstat)用于预防成人和12岁以上儿童患者遗传性血管性水肿(HAE)发作。

HAE是一种较为罕见的常染色体显性遗传病,临床上表现为反复发生的皮肤和黏膜水肿,水肿发生于呼吸道时可导致窒息死亡。HAE发病率仅为五万分之一,美国HAE患者人群约为10000人,被诊断且接受治疗的患者约为7500人;中国诊断率预计不足5%,患者从发病到确诊一般需要13年左右的时间。HAE是由于C1抑制物缺陷或功能障碍所致,这是一种调控经典补体途径活化通路的蛋白。C1抑制物缺乏或功能障碍可引起缓激肽水平升高,因为C1抑制物还抑制活化的激肽释放酶,激肽释放酶是激肽系统通路中缓激肽代谢过程中所必需的酶。
HAE急性发作可用C1酯酶抑制剂、艾卡拉肽或艾替班特治疗。另外也可使用新鲜冷冻血浆或氨甲环酸。对于长期预防,减弱雄激素(例如司坦唑醇或达那唑)可用于刺激肝C1抑制物的合成。
美国遗传性血管性水肿协会(HAEA)总裁兼首席执行官Anthony J. Castaldo表示:“ORLADEYO为HAE患者及医生提供了第一个口服非甾体类药物预防HAE发作,这对于为医生和患者提供更多治疗选择是重要而可喜的一步。”
ORLADEYO可通过降低血浆激肽释放酶的活性来预防HAE发作。在关键性3期临床试验APeX-2中,第24周时ORLADEYO显著减少了发作,且一直持续至48周。完成48周治疗(150mg)的患者HAE发作次数降低,从基线的平均每月2.9次降至48周治疗后的每月1.0次。
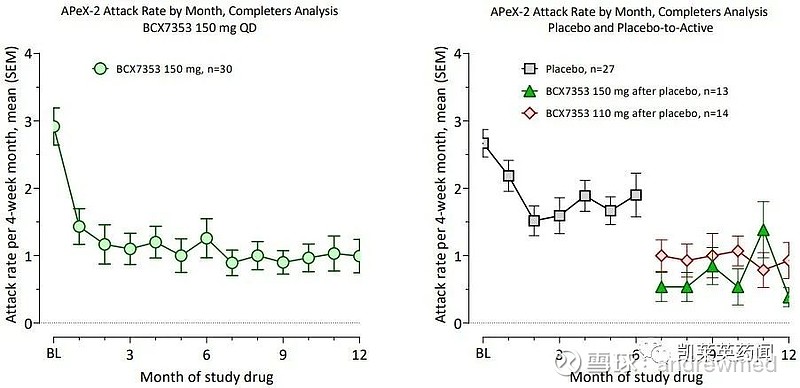
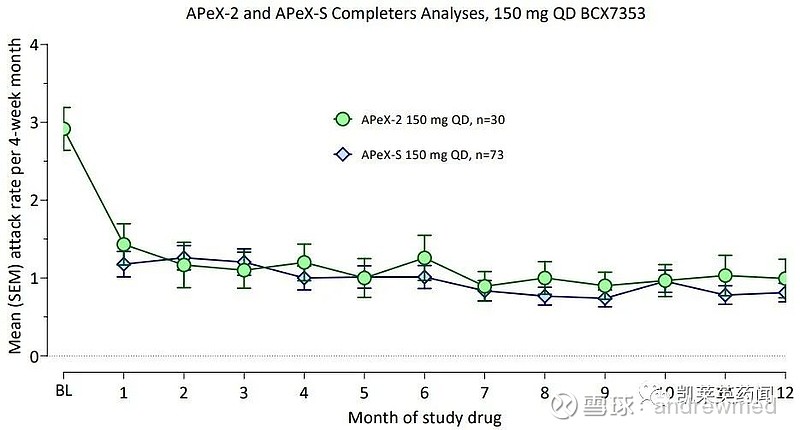
长期开放标签试验APeX-S中,完成48周(150mg)治疗的患者每月平均发作次数为0.8次。
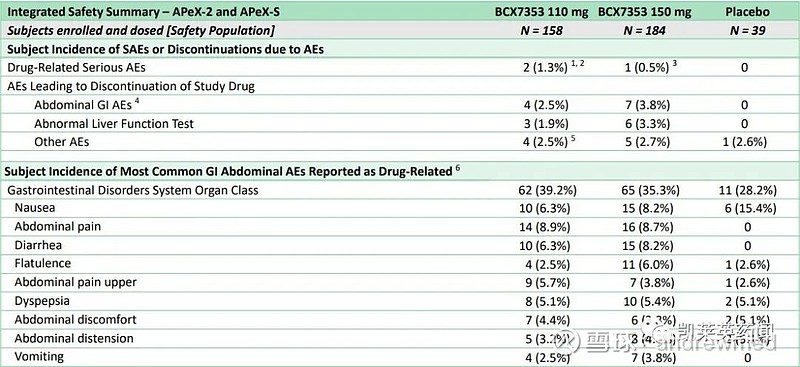
ORLADEYO在两项试验中均表现出良好的安全性和耐受性。与安慰剂相比,接受ORLADEYO患者最常报告的不良反应是胃肠道反应。这些反应通常在ORLADEYO治疗开始后早期发生,随着时间推移频率降低,且通常会自行消失。
APeX-2试验研究人员、加州大学圣迭戈分校HAEA中心临床主任MarcRiedl表示:“患者和医生都坦言,HAE治疗会给患者的生活增加负担。作为每日一次的口服药物,ORLADEYO可以显著减少发作并减轻注射和输注相关的负担。”
Riedl补充说:“有了这种新的治疗选择,医生和患者可以继续进行协作讨论,以选择能够满足每个患者需求、生活状况和偏好的治疗方法。”
现有预防性疗法会给HAE患者带来沉重治疗负担。除了降低HAE发作次数,APeX-2研究数据显示,患者还报告了生活质量和总体满意度的显著改善,以及每月按需使用的标准护理药物的显著减少。
BioCryst总裁兼首席执行官JonStonehouse表示:“FDA批准ORLADEYO使BioCryst履行了对HAE患者的承诺,即我们致力于帮助他们实现每日一次口服药物预防和减轻疾病发作负担的梦想”。
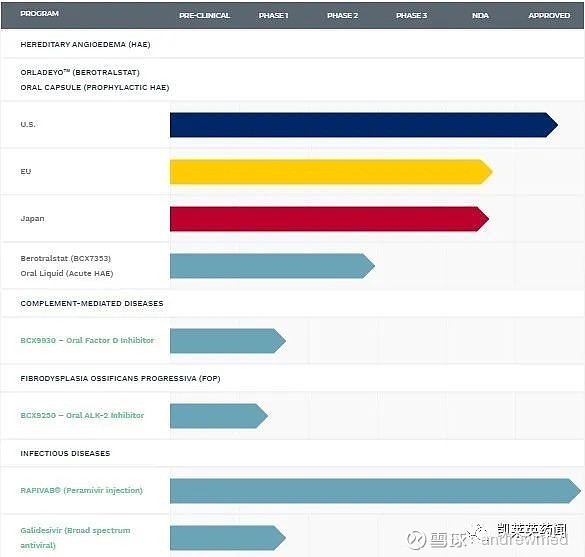
BioCrystPharmaceuticals专注于开发创新口服小分子药物,用于治疗存在重大未满足临床需求且酶在疾病进展中起关键作用的罕见病。除ORLADEYO之外,BioCryst还在进行多项开发计划,包括口服因子D抑制剂BCX9930,用于治疗补体介导的疾病;Galidesivir,用于新冠肺炎、马尔堡病毒感染和黄热病的潜在治疗;以及BCX9250,一款治疗进行性骨化性纤维组织发育不良症(FOP)的ALK-2抑制剂。治疗流感的病毒神经氨酸酶抑制剂RAPIVAB®(peramivir注射液)是BioCryst的首个获批产品,已在美国、加拿大、澳大利亚、日本、台湾、韩国和欧盟上市。
版权说明:本文来自凯莱英,感谢关注、转发。欢迎媒体/机构转载,转载请注明来自“凯莱英药闻”。