注:本文不构成任何投资意见和建议,以官方/公司公告为准;本文仅作医疗健康相关药物介绍,非治疗方案推荐(若涉及),不代表平台立场。任何文章转载需得到授权。
01
BL-B16D1(推测HER3 EGFR靶点)
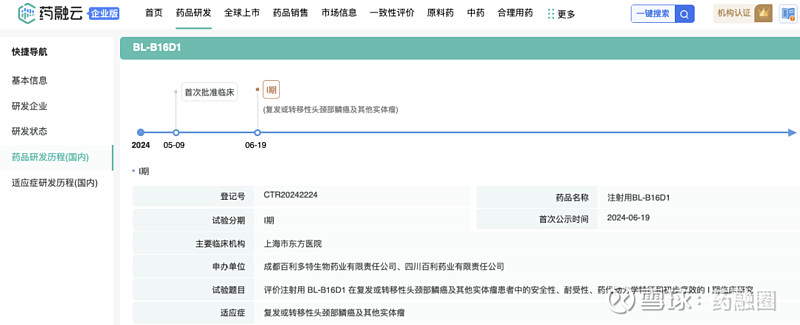
药融云数据
试验目的:1. 剂量递增阶段(Ia)1)主要目的:观察BL-B16D1在局部晚期或转移性实体瘤患者中的安全性和耐受性,从而确定 MTD 和 DLT 。2)次要目的:评估BL-B16D1的药代动力学特征和免疫原性。3)探索性目的:检测肿瘤病理组织中的EGFR 或/和 HER3 蛋白表达或基因扩增,探索其与BL-B16D1有效性指标的相关性。2. 扩大入组阶段(Ib)1)主要目的:进一步观察BL-B16D1在Ia期推荐剂量下的安全性和耐受性,确定 RP2D。2)次要目的:评估BL-B16D1的初步疗效、药代动力学特征和免疫原性。3)探索性目的:根据Ia期的结果,进一步研究所选生物标志物与初步疗效相关性。
根据试验目的推测,BL-B16D1为新的(HER3 EGFR)ADC。后续招股书中亦没有公示

药融圈获悉:BL-M17D1 是与 BL-B16D1 出自同一新的小分子技术平台、与 BL-B16D1 共享同一新的“连接子+毒素”平台的 ADC 药物,其适应症为晚期实体瘤。(该毒素为MMAE/MMAF类型)
此前百利天恒的核心产品BL-B01D1,EGFR/HER3双抗ADC,毒素为TOPOI抑制剂。
02
2024年7月10日,百利天恒港股IPO申请获得受理,BL-B01D1共已开展20余项临床研究,未来需要大量经费拓展试验。百利天恒预计BL-B01D1将于2026年或之前向中国NMPA提交首个适应症的NDA申请,最早于2028年向美国FDA提出首个BLA申请。此前的业绩与研发开支如下:
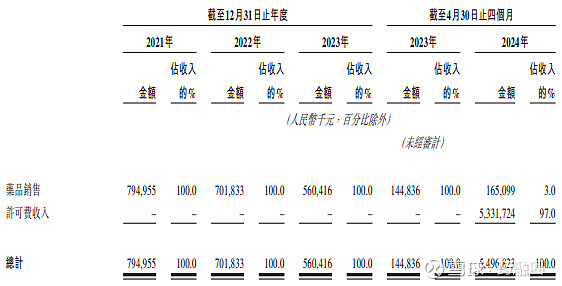

2024年5月29日,Lancet Oncol期刊上发表了BL-B01D1治疗局部晚期或转移性实体瘤患者中的首次人体、开放标签、多中心、1期临床试验结果。
03
药融云数据监测显示:在开发HER3靶点的抗体和ADC的国内企业有:宜联生物;豪森/翰森制药;百利天恒;康宁杰瑞;偌妥生物;启德医药;恒瑞医药/盛迪亚;中国生物上海生物制品研究;映恩生物;信达生物;普米斯;普众发现医药;百奥赛图/多玛医药/思道医药;英诺迈博生物;武汉友芝友等等。
参考:NMPA/CDE;
药融云数据;
FDA/EMA/PMDA;相关公司公开披露;
Ma Y, Huang Y, Zhao Y, Zhao S, Xue J, Yang Y, Fang W, Guo Y, Han Y, Yang K, Li Y, Yang J, Fu Z, Chen G, Chen L, Zhou N, Zhou T, Zhang Y, Zhou H, Liu Q, Zhu Y, Zhu H, Xiao S, Zhang L, Zhao H. BL-B01D1, a first-in-class EGFR-HER3 bispecific antibody-drug conjugate, in patients with locally advanced or metastatic solid tumours: a first-in-human, open-label, multicentre, phase 1 study. Lancet Oncol. 2024 May 29:S1470-2045(24)00159-1. doi: 10.1016/S1470-2045(24)00159-1. Epub ahead of print. PMID: 38823410;等等。
本文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场,不作任何用药推荐