注:本文不构成任何投资意见和建议,以官方/公司公告为准;本文仅作医疗健康相关药物介绍,非治疗方案推荐(若涉及),不代表平台立场。任何文章转载需得到授权。
2018年,美英三位科学家因“定向进化”技术荣获诺贝尔化学奖。现在有一家基因治疗公司正利用“定向进化”的力量解决基因治疗领域最为关键的问题——递送。
药融云数据显示,4D MolecularTherapeutics(以下简称4DMT)(4D Molecular(NASDAQ:FDMT))是一家临床阶段的基因治疗公司。4DMT的使命:成为一家全面整合的生物制药公司,大胆创新,为数百万患者释放基因药物的全部潜力。据了解,4DMT是加州大学伯克利分校的衍生公司,加州大学伯克利分校生物工程和分子与细胞生物学的兼职教授David Kirn博士是该公司的联合创始人兼首席执行官。
截图自药融云数据库
基因治疗药物作为一种变革性的疗法具有巨大的前景。然而,过去大多数基因治疗药物都遇到了诸如炎症和毒性、高剂量要求、疗效有限以及中和抗体削弱疗效等限制,4DMT认为一个重要的原因是它们使用了自然发生和非靶向的传统AAV(腺相关病毒)载体。
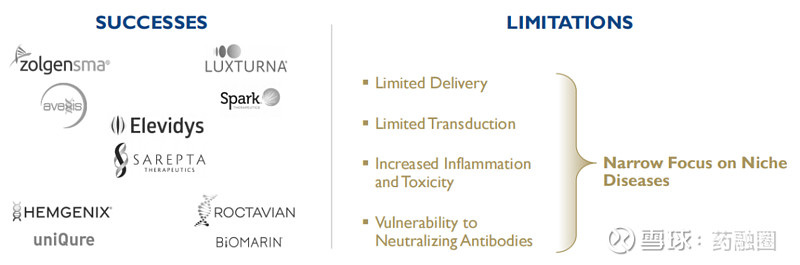
自2013年成立以来,4DMT一直在借助“定向进化”的力量来发明靶向和进化的递送载体,将基因递送到特定的组织类型,以治疗相应的疾病。该公司创建了专有的载体发明平台Therapeutic Vector Evolution,旨在解决传统AAV载体基因治疗药物的局限性。
定向进化的第一步在于生成一个大体量的、多样化的生物变异文库。从多个专有的AAV变异衣壳的基因组开始,这些基因组能够自然产生AAV衣壳变异,首先利用各种不同的分子生物学技术来创建一个专有文库,文库中包含大约10亿个合成的AAV衣壳序列。这些合成的衣壳基因序列随后被用来生成一个庞大的蛋白质衣壳文库,每个衣壳都拥有自己的基因序列。借助这些基因序列“条形码”,可在后续非人类灵长类动物(NHPs)身上进行的多轮选择中,对衣壳载体的生物分布进行追踪和量化。
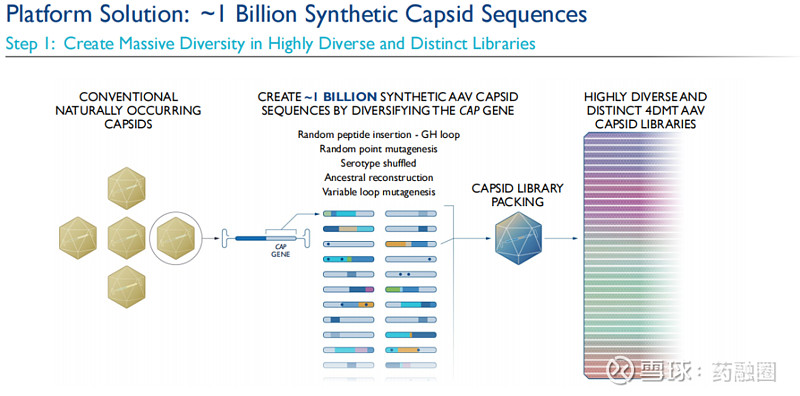
然后,利用这一包含大约10亿个合成衣壳序列的专有文库结合Therapeutic Vector Evolution技术平台,对治疗性载体进行进化,包括非人类灵长类动物的竞争性选择,以识别出适用于目标疾病领域,与目标载体轮廓相匹配的定制和进化的载体。对目标载体轮廓具有最佳适配度的衣壳将在每一轮选择中被富集,并被选定为先导载体。4DMT希望通过这些专有载体克服传统AAV载体的已知局限性,并潜在地影响传统AAV载体无法解决的更加广泛的疾病。
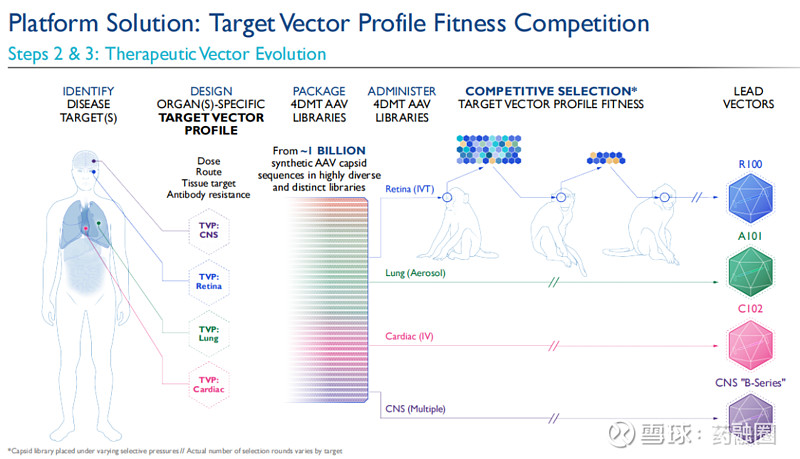
目前,4DMT已在三个治疗领域针对三种专有和进化的载体进行了临床概念验证。每种载体采用了不同的给药途径(玻璃体内给药、气溶胶和静脉注射),并建立了一个深厚的基因治疗候选药物管线。
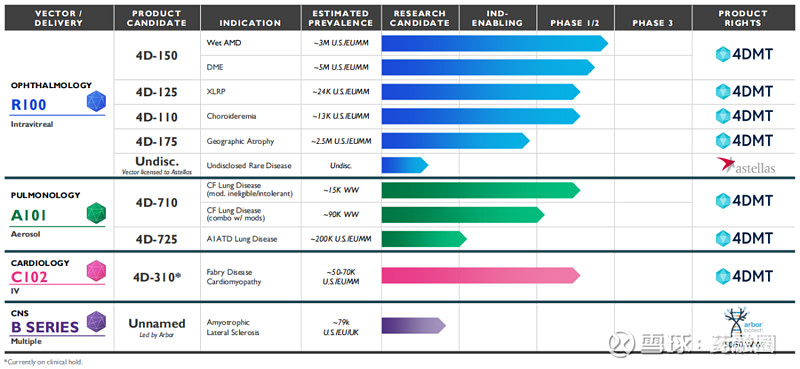

大眼科市场:玻璃体内递送
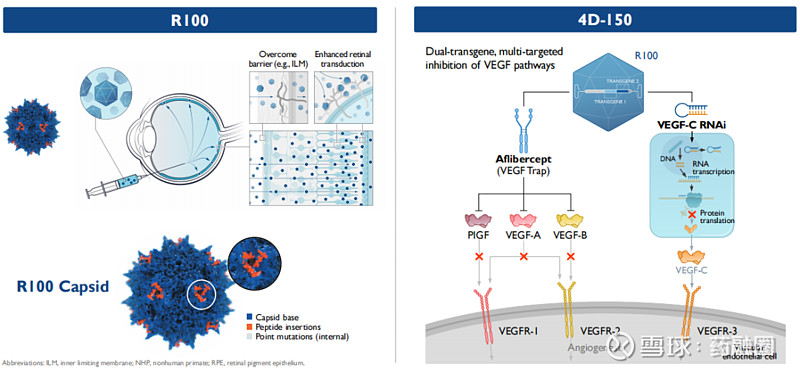
在眼科领域,4DMT采用定制和进化的载体R100,该载体用于常规玻璃体内注射给药,在视网膜的整个表面和视网膜的主要细胞层中表达转基因有效载荷。4DMT将R100应用于大眼科市场的候选产品,如湿性AMD(年龄相关性黄斑变性)、糖尿病性黄斑水肿(DME)和地理性萎缩(GA),这些候选产品有可能成为4DMT的主要价值驱动因素。
4D-150:湿性AMD和DME
4D-150是一种双转基因的玻璃体内基因治疗药物,旨在靶向抑制VEGF家族4个成员(VEGF-A,B,C和PlGF),以防止血管生成,降低血管通透性,用于治疗视网膜的血管生成性疾病,包括湿性AMD(年龄相关性黄斑变性)和DME(糖尿病性黄斑水肿),这两种疾病治疗市场超过180亿美元。湿性AMD是一种高度流行的疾病,在美国和欧洲主要市场估计有300万患者受到影响;DME也是一种高度流行的疾病,有显著的医疗需求未得到满足,据估计,在美国和欧洲主要市场,大约有500万人患有DME。
据了解,4D-150是首个直接抑制四种不同的VEGF靶点(VEGF-A,B,C和PlGF)的眼科基因治疗候选产品。4D-150通过玻璃体内递送表达两个转基因的有效载荷到视网膜,并产生更加完整的、持续的抗血管生成作用,有望通过“一次性治疗”减少患者抗VEGF注射的治疗负担,从而提高治疗依从性。同时,4D-150在临床上观察到的眼内炎症情况较低。因此,该候选药物有望成为VEGF驱动的视网膜疾病的市场领导者。
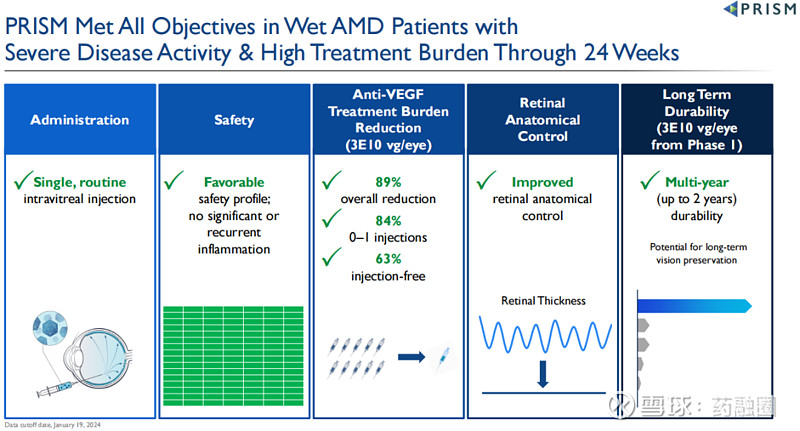
4D-150正在湿性AMD患者群体中开展2期临床试验PRISM。2024年2月3日,4DMT公布了2期PRISM研究的积极中期数据,4D-150在严重疾病活动和高治疗负担患者的随机剂量扩展队列中(N=51),显示出良好的安全性,没有明显或复发的眼内炎症,也没有4D-150相关的严重不良事件,所有患者均停用类固醇(数据截止时间为2024年1月19日);在治疗24周时,高剂量组(3E10 vg/眼)使患者年化治疗负担大幅降低89%,与阿柏西普对照组相比,84%的患者仅需0-1次阿柏西普补充注射,63%的患者无需补充注射,视网膜解剖学控制也有所改善。在1期研究3E10 vg/眼剂量队列中,3名患者在80-104周(最长2年)的随访中无需补充注射。
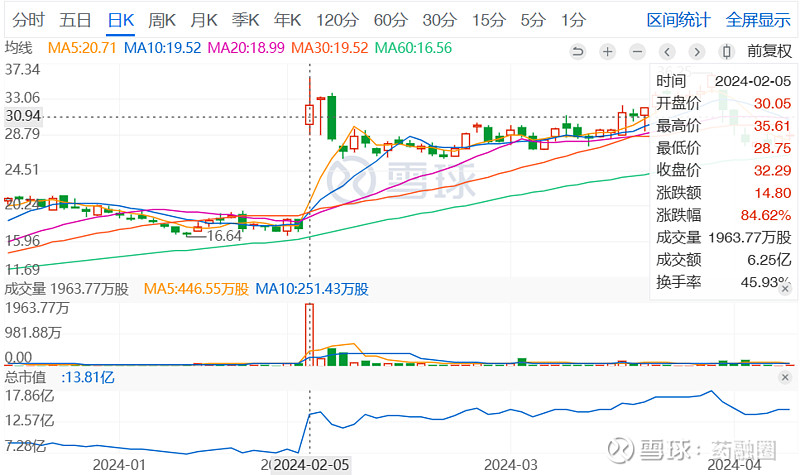
受此消息影响,4DMT股价在2月5日美股开盘时暴涨,到收盘时涨幅达84.62%。
药融云数据显示,4D-150已获得FDA授予的再生医学先进疗法(RMAT)认定,以及EMA的优先药品(PRIME)认定资格,用于治疗湿性AMD。该药是首个获得RMAT认定的湿性AMD候选治疗药物。该公司预计将在2025年第一季度启动针对湿性AMD的3期临床研究。
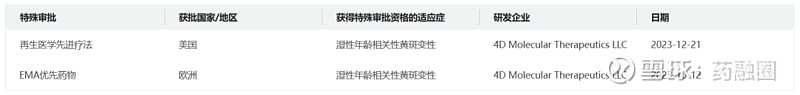
截图自药融云数据库
针对DME(糖尿病性黄斑水肿),该公司正在开展一项随机、双盲、阳性对照的2期临床试验SPECTRA,预计将在2024年下半年获得初始中期数据(N=22)。
4D-175:地图样萎缩
地图样萎缩(GA)又称干性AMD、萎缩性AMD,是AMD的一种晚期形式。据估计,在美国和欧洲主要市场,大约有250万人患有GA。针对该病,4DMT开发了一种单剂量玻璃体内给药基因治疗药物4D-175,已进入IND-enabling研究阶段。4D-175也是采用了4DMT专有的R100玻璃体内载体,递送一个表达短形式的补体因子H(sCFH)的转基因有效载荷。值得一提的是,2023年4月,4DMT从Fortress Biotech子公司Aevitas Therapeutics获得该短型补体因子H的全球权利,交易总金额高达1.4亿美元。
罕见眼科资产
4DMT另有两项临床阶段眼科资产:4D-125用于治疗X连锁性视网膜色素变性(XLRP)。XLRP是一种罕见的遗传性X-连锁隐性遗传疾病,可导致进行性视力丧失和失明,目前尚无药物获批治疗该病,70%的病例是由色素性视网膜炎GTP酶调节因子(RPGR)突变引起。4D-125使用R100载体,荷载有一个密码子优化的RPGR转基因,可在人类光感受器中表达,有望在疾病早期阶段减缓进展并保存视力。目前该药正在开展1/2期剂量扩展临床试验。
4D-110用于治疗无脉络膜症(曾与罗氏合作)。无脉络膜症是一种单基因致盲性疾病,尚无药物获批治疗该病,这种X-连锁的进行性视网膜和脉络膜退行性疾病完全是由编码REP1蛋白的CHM基因突变引起的。4D-110被设计为利用R100载体将无脉络膜症中功能失调的基因CHM转基因安全地传递到人类RPE(视网膜色素上皮)细胞中,从而在疾病进展的早期阶段延缓进展并保存视力。4D-110目前正在开展一项1/2期剂量递增临床试验CHORUS。
肺病学治疗领域:气溶胶递送
在肺病学治疗领域,4DMT采用定制和进化的载体A101,用于气溶胶给药,实现在气道和肺泡的所有区域的转基因表达,并对人体内已存在的AAV抗体存在抗性。
4D-710:囊性纤维化肺病
4DMT在肺病学领域首个候选产品是针对囊性纤维化(CF)的4D-710。市场上有许多生物技术公司曾开发基因疗法来治疗CF,但由于传统的AAV载体无法穿透肺黏液屏障并有效地转导肺细胞,因此先前将AAV基因药物递送到CF患者肺部的尝试均以失败告终。同时,AAV中和抗体的存在也可能影响疗效。据了解,4D-710是目前唯一一款正在开发的,专门设计了用于包括人类在内的灵长类动物气溶胶递送的载体,并对人体内的抗体具有抗性的AAV基因治疗候选产品。
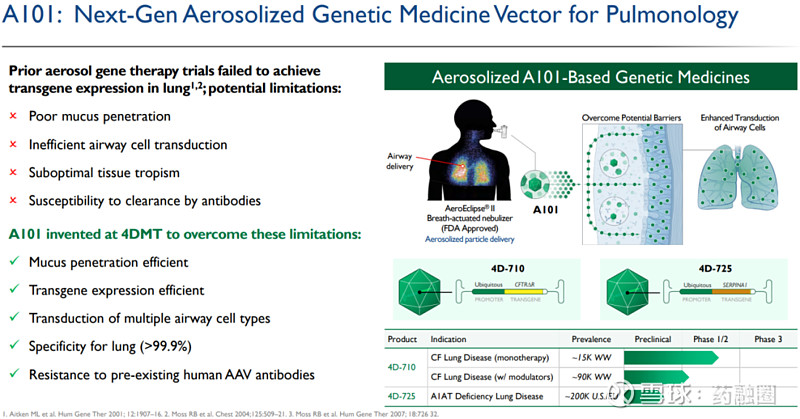
4D-710旨在通过气溶胶递送将气道靶细胞内CFTR(囊性纤维化跨膜传导调节因子)蛋白提高到治疗水平;与CFTR靶向小分子药物需要患者终身每日服药不同,4D-710设计的给药频率明显降低;与仅针对特定突变有效的CFTR靶向小分子不同,4D-710不限于特定基因突变,而是适用于任何突变的CF患者,包括大约15%不能接受标准药物治疗的患者。
4D-710已通过气溶胶递送完成了非GLP剂量范围和GLP灵长类动物毒理学和生物分布研究,目前正在开展一项针对囊性纤维化的1/2期多中心、开放标签、剂量爬坡和剂量扩展的临床试验AEROW。2022年4月,4DMT宣布公司获准加入囊性纤维化疗法开发网络(世界上最大的囊性纤维化临床试验网络)并完成AEROW研究的首例患者给药。2023年11月,4DMT在北美囊性纤维化会议上宣布了该研究积极的中期临床数据,结果显示,雾化的4D-710在17个月的随访中耐受性良好;所有参与者和所收集的肺组织样本均有稳健的、可重复、生理水平以上的CFTR表达,显著超过目标水平;队列1患者的CFQ-RRD和ppFEV1评分改善显示了持久的临床活性。
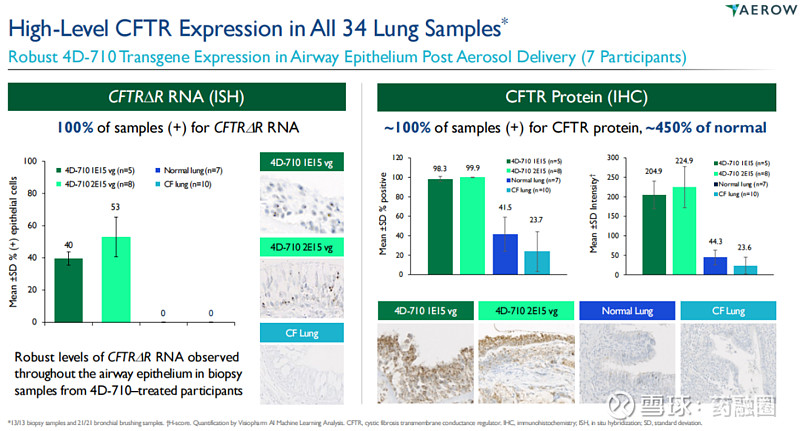
4DMT已经与FDA和EMA就4D-710进行了初步的关键研究互动,且明确了4D-710的注册途径——用于治疗不符合或不能耐受已批准的CF调节剂治疗的CF患者的囊性纤维化(CF)肺病,计划于2025年下半年启动关键3期临床。该公司已经完成了内部流程开发,为4D-710提供了500升规模的悬浮GMP就绪制造工艺,从而支持关键临床研究。
4D-725:α-1抗胰蛋白酶缺乏性肺病
4DMT的第二个肺病科候选产品是4D-725,用于治疗α-1抗胰蛋白酶缺乏症肺病。α-1抗胰蛋白酶缺乏症是由于α1-抗胰蛋白酶缺乏或水平较低而导致肺和肝损伤的一种遗传性疾病,根据美国国立卫生研究院的数据,在美国和欧洲大约有20万人患该病。尽管已批准了治疗方法,但仍有大量的医疗需求未得到满足。4D-725也是采用了4DMT专有的A101气溶胶载体,预计将在2024年启动IND-enabling研究。
心脏病学:低剂量静脉输注
在心脏病学领域,4DMT开发了定制和进化的载体C102,用于低剂量静脉输注,实现转基因在整个心肌层的心肌细胞表达。
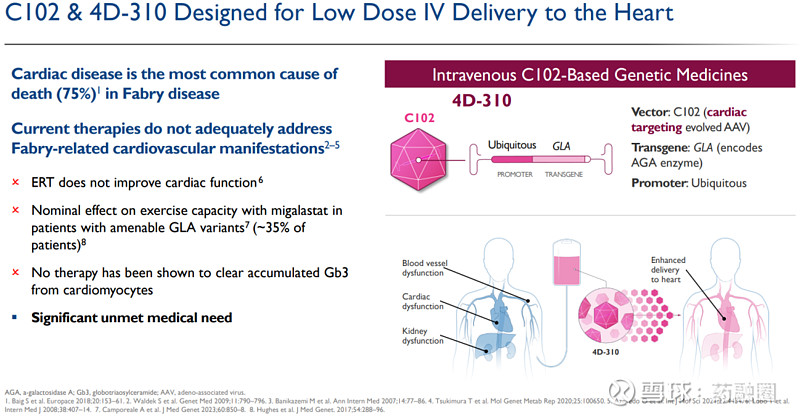
4D-310:法布里病心肌病
法布里病是一种单基因遗传病,由编码α-半乳糖苷酶A(AGA)酶的GLA基因突变引起,导致人体内无法产生足够的活性AGA酶,引起鞘脂在关键器官中,包括心脏、肾脏和血管的毒性累积,例如底物三糖基神经酰胺(lyso-Gb3)。法布里病中的心肌病是导致患者死亡的主要原因,占死亡人数的75%。
法布里病现有治疗方法是酶替代疗法,每两周输注AGA酶,但是据报道,在包括心肌细胞在内的实质细胞中,酶替代疗法缺乏有效吸收,患者仍然有心脏并发症的危险,且AGA抗体的产生会进一步恶化临床结果。因此法布里病的心脏靶向治疗依然存在高度未满足临床需求。
4D-310由C102载体和一个密码子优化的GLA转基因组成,被设计为单次低剂量静脉输注,用于治疗典型的和晚发性法布里病患者,包括那些先前接受过酶替代疗法的患者,并不限于特定AGA突变患者。
4D-310开展了两项1/2期剂量爬坡和剂量扩展临床试验(美国:INGLAXA-1和亚太地区:INGLAXA-2),2023年1月,4DMT报告了3例患者经历了短暂性急性非典型溶血性尿毒症综合征(aHUS),导致该公司自愿暂停两项INGLAXA研究。目前,公司已经与FDA达成一致意见以重启临床试验,包括修改了INGLAXA研究方案,以减少与AAV静脉给药相关的aHUS风险,包括添加利妥昔单抗/西罗莫司(R/S)免疫抑制方案。应FDA的要求,4DMT已经启动了一项单一的非人灵长类安全性研究,评估静脉注射4D-310联合R/S的方案。
2024年2月,4DMT在WORLD Symposium 2024会议上公布了1/2期INGLAXA临床试验的中期临床和活检数据。4D-310在5例可评估患者中,在12-24个月内在多个心脏终点上显示出具有临床意义的改善;1例患者在第6周和第24周的心脏活检显示,心肌细胞中Gb3底物的递送、转基因表达和清除率均稳健持久;既往报道的3例患者非典型溶血性尿毒症综合征(aHUS)已完全消退。
现有战略合作
2023年7月5日,4DMT与安斯泰来基因治疗公司(Astellas Gene Therapies,AGT)就4DMT专有的玻璃体内给药载体R100达成战略合作。根据协议条款,4DMT将向AGT提供其专有的R100载体技术,用于罕见单基因眼科疾病,AGT将负责开展所有后续的研究、开发、制造和商业化活动。此次交易预付款为2000万美元的,未来的潜在里程碑高达9.425亿美元,包括初始靶点的潜在近期开发里程碑1500万美元。此外,4DMT有权从所有许可产品的净销售额中获得中等个位数到两位数的特许权使用费。
2023年12月20日,4DMT与Arbor Biotechnologies(华人科学家张锋博士联合创立)达成战略合作,将在共同承担(50:50)成本和利润的基础上为中枢神经系统治疗领域共同开发和商业化多达6种AAV递送的基于CRISPR/Cas的基因治疗药物,这些药物将结合4DMT的CNS靶向载体和Arbor公司的CRISPR/Cas酶和向导RNA。该合作的第一个候选药物将涉及肌萎缩性侧索硬化症(ALS)相关的分子靶点。
4DMT的现有合作方还包括囊性纤维化基金会(CFF),双方合作始于2016年,随着治疗囊性纤维化的候选产品开发的推进,该公司陆续获得来自CFF的款项。2020年4月,CFF在4DMT的C轮可赎回可转换优先股融资中投资了1000万美元。2021年10月,在FDA接受囊性纤维化肺病候选疗法4D-710的IND申请之后,CFF对4DMT额外进行了400万美元的投资。
财务状况
2024年2月,4DMT完成普通股公开发行,获得3.16亿美元净现金流入,截至2024年3月31日,4DMT拥有5.889亿美元的现金和现金等价物以及有价证券,累计赤字为4.477亿美元,公司现金跑道预计将延续到2027年上半年。
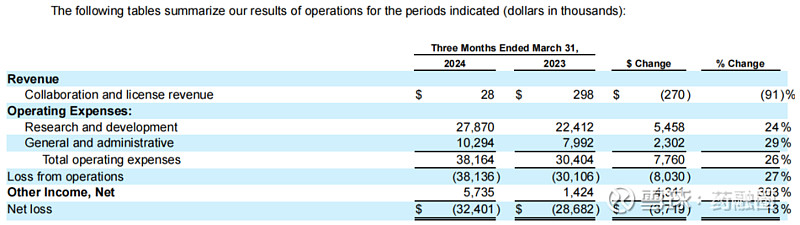
2023年,4DMT全年总收入2072.3万美元,主要是来自与安斯泰来的合作协议;全年R&D费用为9709.6万美元;G&A费用为3649.4万美元;全年净亏损1.008亿美元。
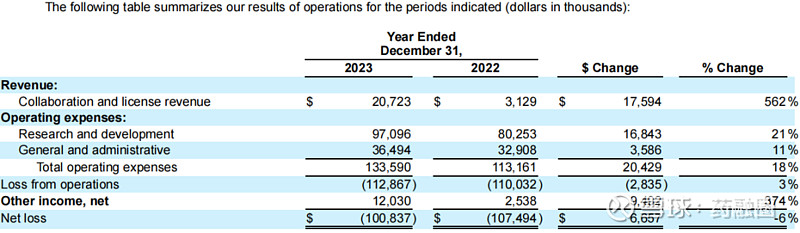
2024年Q1,该公司季度总收入为2.8万美元;R&D费用为2787万美元;G&A费用为1029.4万美元;净亏损3240.1万美元。
4DMT近期里程碑:

曾经有点“倒霉”的4DMT
2020年底,4D Molecular Therapeutics(4DMT)完成2.22亿美元IPO。在此之前,4DMT就已经与罗氏、阿斯利康和基因治疗先驱uniQure NV建立了重要合作,且凭借这些合作吸引了大额的B轮和C轮融资。
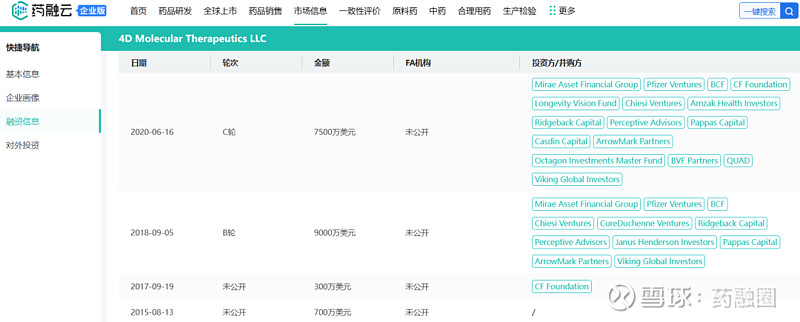
药融云数据库:4DMT部分融资历程
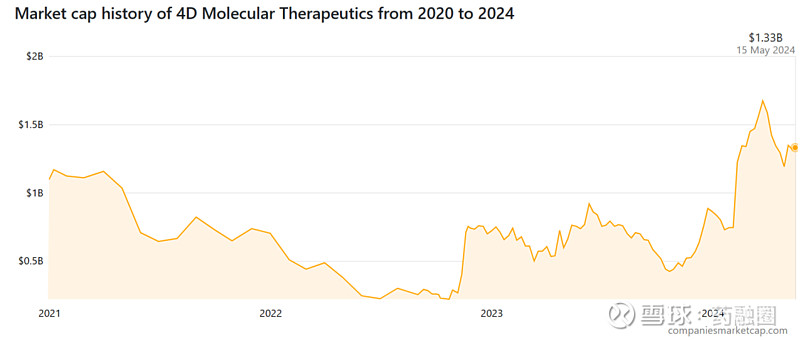
然而在2021年,眼科AAV基因治疗领域的“黑天鹅”事件导致4DMT直接躺枪,其股价在半年时间里近乎腰折。
2021年4月,眼科AAV基因治疗公司Adverum宣布针对DME开展的INFINITY临床试验中有1例患者出现“肌张力低下、全葡萄膜炎和治疗眼视力丧失”的疑似意外严重不良反应。5月份,Biogen宣布从Nightstar Therapeutics收购获得的X-连锁视网膜色素变性AAV疗法2/3临床失败。两家公司接连失败的消息让整个行业对眼科AAV基因治疗领域产生怀疑。
就在2021年6月,4DMT宣布罗氏终止了双方针对无脉络膜症候选药物4D-110的合作。这一挫折使4DMT当月股价大跌。
不过随着4DMT基因疗法的继续开发,候选药物的疗效与安全性在临床上得到初步验证,该公司当前市值已重回IPO时水平。截止发稿前市值为10.94亿美元。
此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场,不作任何用药推荐
参考:
NMPA/CDE;
药融云数据;
FDA/EMA/PMDA;
相关公司公开披露(正文图片均来自企业官方,除非另有说明);等等