注:本文不构成任何投资意见和建议,以官方/公司公告为准;本文仅作医疗健康相关药物介绍,非治疗方案推荐(若涉及),不代表平台立场。任何文章转载需得到授权。
肺动脉高压(PAH)是一种罕见且危及生命的慢性进行性疾病,其会导致肺动脉压升高和局部高血压,从而导致心力衰竭并最终死亡。Mordor Intelligence预测,2024年到2029年肺动脉高压市场的年均复合增长率为5.0%,由于医疗保健行业高度发达,以及传染病和慢性病患病率不断上升,北美在肺动脉高压市场中处于领先地位。肺动脉高压的治疗可以通过使用前列环素和前列环素类似物、钙通道阻滞剂、磷酸二酯酶5、内皮素受体拮抗剂等药物来治疗,前列环素及其类似物是最早用于PAH的靶向治疗药物。曲前列尼尔是由UnitedTherapeutics研发的一款人工合成前列环素药品,可以促进血管舒张,同时可抑制血小板的聚集,用于肺动脉高压的症状治疗。2005年,曲前列尼尔注射液获得FDA批准上市,商品名为Remodulin(瑞莫杜林),但其零售价极高,曾一度成为美国药房零售价最贵的20个药物之一。2019年3月,Sandoz宣布FDA批准其曲前列尼尔注射液上市,可完全替代Remodulin,同时还宣布其将与RareGen公司合作进行曲前列尼尔注射液的商业推广和销售。
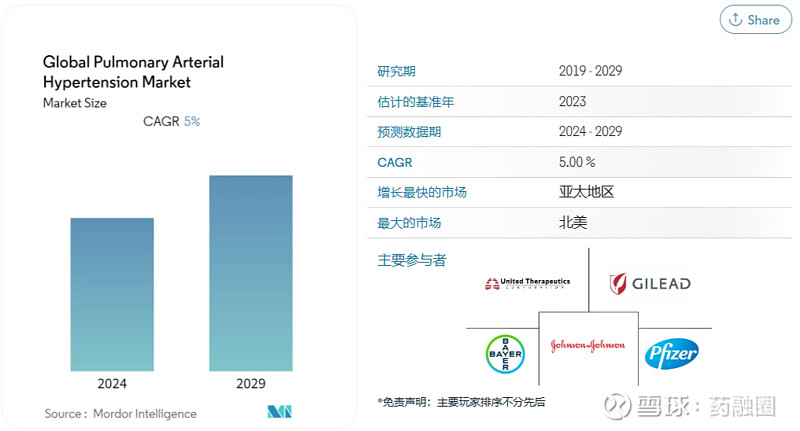
图源:Mordor Intelligence
从药融云数据库获悉,主要为罕见病药品提供商业化服务的RareGen于2020年被Liquidia Technologies收购,Liquidia Technologies是2004年由Joe DeSimone和Ed Samulski从北卡罗来纳大学教堂山分校分离出来的,并于当年在特拉华州注册成立,随着上述合并交易的完成,以上的两家公司均成为Liquidia Corporation的全资运营子公司。目前的Liquidia Corporation(以下简称Liquidia)是一家生物制药公司,主要专注于肺动脉高压产品的开发以及PRINT技术的其他应用,通过两家全资子公司Liquidia Technologies和Liquidia PAH作为单一实体运营。其中,Liquidia Technologies主要负责肺动脉高压相关产品的开发,Liquidia PAH负责治疗肺部疾病药品的商业化。

Liquidia专有的PRINT颗粒工程技术使其能够设计和制造高度均匀的药物颗粒,并对颗粒的尺寸、三维几何形状和化学成分进行精确控制,通过控制颗粒的这些物理和化学参数,PRINT能够将所需的药理学益处设计到开发产品中,包括延长药物释放的持续时间、增加药物负载、设计更方便的给药途径、创造新的组合产品的能力、增强储存和稳定性以及减少副作用的潜力。
专攻PAH和PH-ILD
Liquidia旗下Liquidia PAH主要负责仿制药曲前列尼尔注射液的商业化,Liquidia Technologies负责治疗肺动脉高压(PAH)和间质性肺病相关肺动脉高压(PH-ILD)相关疾病的产品研发,肺动脉高压市场的主要领导者有拜耳、吉利德、强生、辉瑞和United Therapeutics等。当前公司管线的具体进展情况如下:
一
仿制药
曲前列尼尔注射液(仿制药)通过收购RareGen获得,由Liquidia PAH与Sandoz合作进行曲前列尼尔注射液的商业化。2019年,Sandoz宣布FDA批准曲前列尼尔注射液上市,用于治疗肺动脉高压,可完全替代United Therapeutics公司2002年获批上市的原研药Remodulin。
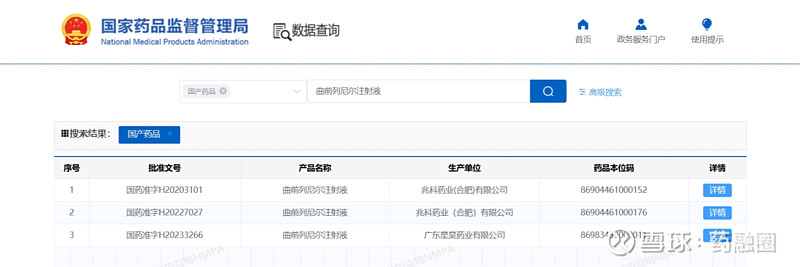
截图来自:国家药品监督管理局
2010年7月,李氏大药厂与United Therapeutics公司达成独家协议,获得Remodulin在中国的独家分销代理权和定价许可权。2020年,李氏大药厂子公司兆科药业按新4类申报的曲前列尼尔注射液获得国家药监局批准上市,视同通过一致性评价。2023年3月,江苏众强药业有限公司的曲前列尼尔注射液仿制药获批上市,同时也是继兆科药业之后获批的国产第二家曲前列尼尔注射液企业。
二
在研管线
1、YUTREPIA(曲前列尼尔吸入粉剂)
YUTREPIA是一种研究性吸入干粉制剂,使用Liquidia的PRINT技术设计,通过方便、省力、手掌大小的装置给药。2021年11月,FDA发布了YUTREPIA用于PAH患者的暂定批准。2023年7月,Liquidia提交了对其YUTREPIA新药申请的修正案,寻求在标签中添加PH-ILD适应症。
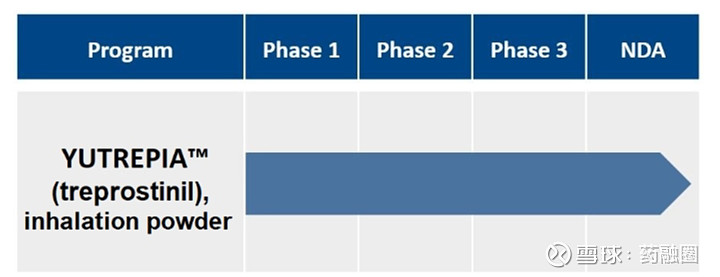
Liquidia在505(b)(2)监管途径下开发了YUTREPIA,使用雾化形式的曲前列尼尔(Tyvaso,美国唯一一个被批准治疗PH-ILD的疗法)作为参考上市药物。2020年1月Liquidia提交了YUTREPIA的新药上市申请,FDA分别于2021年8月和2021年10月对公司的两家美国生产工厂进行了现场批准前检查,2021年11月,FDA发布了YUTREPIA的初步批准,表明该NDA已满足最终批准的所有要求,但尚不能上市。2023年7月,Liquidia提交了NDA修正案,将PH-ILD添加到YUTREPIA的标签中。FDA的最终批准和YUTREPIA的推出直接受到United Therapeutics于2020年6月4日提起的Hatch-Waxman诉讼以及United Therapeutics授予PH-ILD的监管排他性(于2024年3月31日到期)的影响。2024年3月下旬,法官撤销了在最初的Hatch-Waxman诉讼中发布的禁令,该禁令阻止FDA批准YUTREPIA的新药上市申请,截止2024年4月1日,没有进一步的法律阻碍FDA批准YUTREPIA用于PAH和PH-ILD。
Liquidia提交的新药上市申请基于已经完成的INSPIRE试验,即曲前列尼尔干粉吸入的安全性和药理学研究,这是一项开放标签、多中心临床试验3期研究,用于在未吸入曲前列尼尔或正在从Tyvaso(雾化曲前列尼尔)过渡的PAH患者,该试验的主要目的是评估YUTEREPIA的长期安全性,主要终点是评估第2个月的安全性和耐受性。目前正在进行ASCENT试验,这是一项开放标签前瞻性多中心研究,旨在评估干粉吸入曲前列尼尔治疗肺动脉高压的安全性和耐受性,目的是告知YUTEREPIA在PH-ILD患者中的剂量和耐受性特征。
2、L606(脂质体曲前列尼尔)吸入混悬液
L606混悬液是一种吸入式、持续释放的研究性曲前列尼尔缓释制剂,使用Pharmosa Biopharm专有的脂质体配方来封装曲前列尼尔,曲前列尼尔可以以受控速率缓慢释放到肺部,在很长一段时间内增强药物暴露,并减轻对上呼吸道的局部刺激。
2023年6月28日,Liquidia与Pharmosa Biopharm宣布已就L606在北美的开发和商业化达成一项独家许可协议,根据协议条款,Liquidia将负责L606在北美的开发、监管和商业活动,Pharmosa Biopharm将生产L606的临床和商业用品,并支持Liquidia建立一个全球供应链。作为这些独家权利的对价,Liquidia将向Pharmosa Biopharm支付1000万美元预付款,与PAH和PH-ILD适应症相关的高达2.15亿美元的潜在开发和销售里程碑付款,以及L606净销售额的特许权使用费。Pharmosa Biopharm还将获得1000万美元的里程碑付款,用于批准每个额外的适应症和额外的产品。如果Pharmosa Biopharm寻求合作伙伴,Liquidia保留在欧洲和其他地区就L606的开发和商业化进行谈判的优先权,但须满足许可协议中规定的某些条件。

Liquidia打算根据505(b)(2)监管途径在美国寻求L606的首次监管批准。计划中的NDA预计将包括:(1)已完成的临床试验1期研究,证明其耐受性和与Tyvaso相当的药代动力学;(2)在美国的PAH和PH-ILD患者正在进行的开放标签临床试验3期研究数据;(3)来自一项双盲、随机、安慰剂对照研究的临床数据。L606目前正在美国进行一项用于治疗PAH和PH-ILD的开放标签研究,并计划进行一项治疗PH-ILD的全球关键性安慰剂对照疗效研究,计划在2024年上半年启动PH-ILD试验。
财务状况
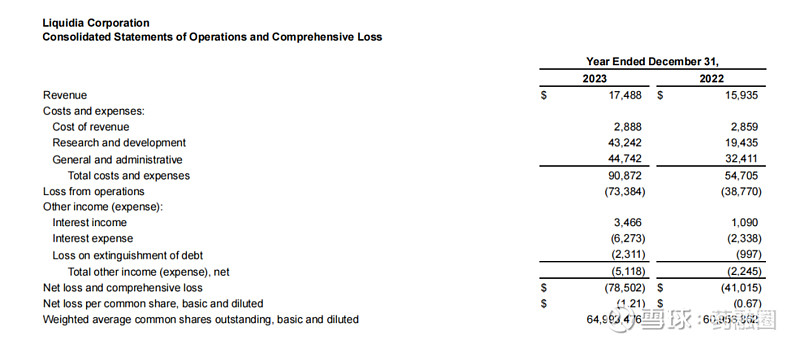
Liquidia Corporation 2023年度收入1750万美元,上年同期收入1590万美元,总的收入主要与Sandoz公司的推广协议销售曲前列尼注射液有关,160万美元的增加主要是由于有利的总退款、回扣和管理式医疗调整,但与上一年相比,销售数量下降的影响抵消了这些调整。2023年度收入成本与上年同期差别不大。研发费用4320万美元,与上年同期相比增长了122%,主要是由于向Pharmosa Biopharm支付了1000万美元的预付款许可费,以获得L606在北美的独家许可。一般及行政费用4470万美元,上年同期3240万美元,增加了38%,主要是由于人事和咨询费用(包括股票薪酬)增加了980万美元,以及为YUTREPIA的潜在商业化做准备而增加的140万美元。2023年度净亏损7850万美元,或每股基本和摊薄亏损1.21美元,上年同期净亏损为4100万美元,或每股基本和摊薄亏损0.67美元。
截止2024年3月31日,2024年第一季度的收入为300万美元,而上年同期为450万美元,与上年同期相比,本年度销售数量减少的影响;收入成本为150万美元,上年同期的收入成本为70万美元,与上一年相比的增长主要是由于公司在2023年第四季度扩大了销售队伍;研发费用为1010万美元,上年同期的研发费用为530万美元,增加了91%,主要是由于与员工人数增加相关的人事费用(包括股票薪酬)增加了200万美元,以及与L606计划相关的临床费用增加了170万美元。此外,与YUTREPIA计划相关的费用增加了130万美元,原因是与2023年下半年启动的ASCENT研究相关的临床和供应费用增加;一般及行政费用为2020万美元,上年同期只有780万美元,增加了1240万美元(160%),主要是由于与正在进行的YUTEREPIA诉讼相关的法律费用增加了310万美元,人事费用(包括股票薪酬)增加了590万美元,以及为YUTREPIA的潜在商业化做准备的商业和咨询费用增加了220万美元;净亏损为4090万美元或每股基本和摊薄亏损0.54美元,上年同期净亏损为1170万美元,或每股基本和摊薄亏损0.18美元。
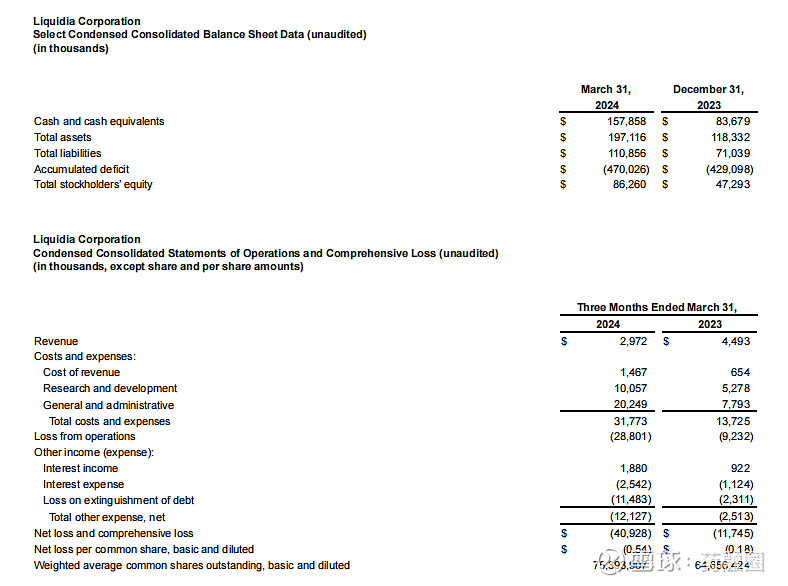
2024年1月,Liquidia宣布获得1亿美元的新融资,主要与公司在当月第一周完成的两笔交易有关。其中,和Patient Square Capital(医疗保健投资公司)的一家附属公司签订了普通股私募购买协议,总收益为7500万美元;同一周,与HealthCare Royalty Partners(HCRx)对收入利息融资协议(RIFA)进行了第四次修订,HCRx额外资助2500万美元,该公司已先投资了6750万美元的非稀释性资本,而最初计划在RIBA下分四批投资1亿美元。第四次修订将2500万美元从第三部分转移到第二部分,因此HCRx在第二部分下总共提供了3500万美元,剩余的第三笔1000万美元和第四笔2250万美元将在未来经HCRx和Liquidia双方同意后提供资金。2024年3月31日,公司的现金和现金等价物总额为1.58亿美元。截止2024年5月30日,Liquidia公司市值还不到10亿美元。截止发稿前为9.14亿美元。

参考:
NMPA/CDE;
药融云数据;
FDA/EMA/PMDA;
相关公司公开披露(除标注外,正文图片均来自企业官网);等等。