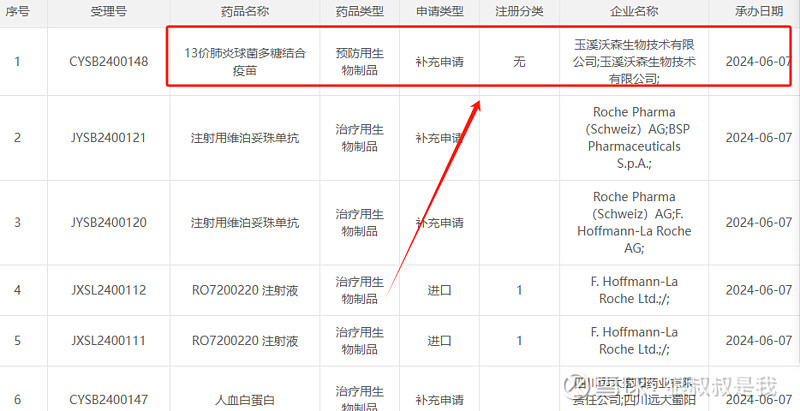
这个是啥意思。
| 发布于: 修改于: | 雪球 | 转发:1 | 回复:7 | 喜欢:0 |

这个是啥意思。

还是想弄个多载体。。。。
二、药品上市后的补充申请
1.变更原药品注册批准证明文件及其附件所载明的事项或者内容
申请人应当按照规定,参照相关技术指导原则,对药品变更进行充分研究和验证,充分评估变更可能对药品安全性、有效性和质量可控性的影响,按照变更程序提出补充申请、备案或者报告。
2.附条件批准的药品
持有人应当在药品上市后采取相应的风险管理措施,并在规定期限内按照要求完成药物临床试验等相关研究,以补充申请方式申报。
3.上市后研究
药品注册证书及附件要求持有人在药品上市后开展相关研究工作的,持有人应当在规定时限内完成并按照要求提出补充申请、备案或者报告。
药品批准上市后,持有人应当持续开展药品安全性和有效性研究,根据有关数据及时备案或者提出修订说明书的补充申请,不断更新完善说明书和标签。药品监督管理部门依职责可以根据药品不良反应监测和药品上市后评价结果等,要求持有人对说明书和标签进行修订。
4.其他变更
以下变更,持有人应当以补充申请方式申报,经批准后实施:
①药品生产过程中的重大变更;
②药品说明书中涉及有效性内容以及增加安全性风险的其他内容的变更;
③持有人转让药品上市许可;
④国家药品监督管理局规定需要审批的其他变更。
此外,药品上市后提出的补充申请,需要核查、检验的,参照《药品注册管理办法》有关药品注册核查、检验程序进行。
5.审评时限
审批类变更的补充申请审评时限为六十日,补充申请合并申报事项的,审评时限为八十日,其中涉及临床试验研究数据审查、药品注册核查检验的审评时限为二百日。
药品上市后,隔几年(记不清了),都有这样来一次。
啥也不干,就是为了花钱的!