7月4日,多玛医药宣布,其首个双抗ADC产品DM001正式获得美国FDA IND批准。2024年6月26日,也正式获得澳大利亚CTN批准,即将开启临床一期研究。

DMO01是一款全人TROP2xEGFR双抗ADC。DM001的共轻链双抗结构是基于百奥赛图RenLite®平台开发得到的,其结构稳定,且纯度较高。DM001使用的Linker-Payload为BLD1102(拓扑异构酶抑制剂类,TOPi)。
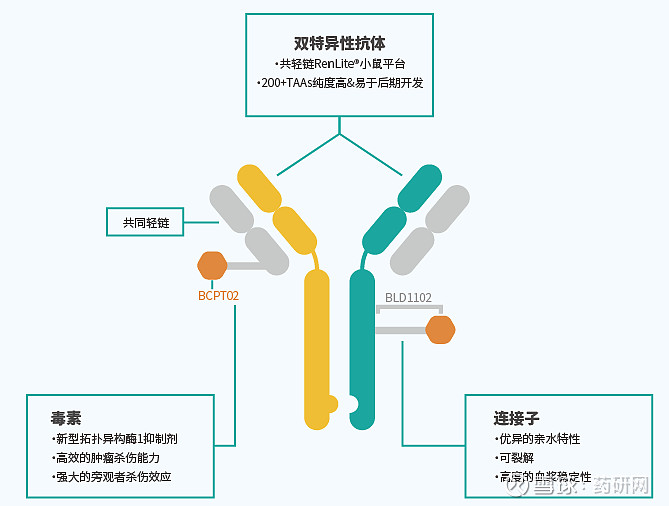
DM001采用最新的双抗ADC技术,结合有协同内吞作用的EGFR和TROP2 IgG1抗体,可酶切的连接子以及高效细胞毒素载荷,新的拓扑异构酶抑制剂,力图在提高肿瘤疗效的同时,降低副作用。

DM001在CDX模型中显示出优秀的肿瘤抑制能力
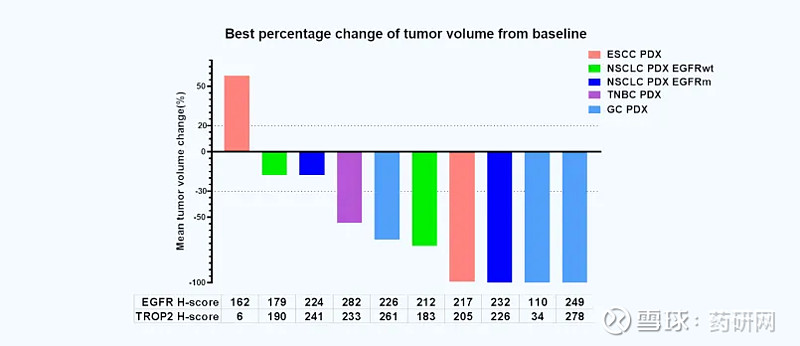
DM001在PDX模型中显示出优秀的肿瘤抑制能力
在临床前研究中,DM001展现出强大的抗肿瘤活性和良好的安全性。动物实验结果显示,DM001能够显著抑制多种实体肿瘤的生长,且耐受性良好,未见显著毒性反应。这些积极的数据为其临床研究奠定了坚实基础。
据clinicaltrials.gov登记信息,多玛生物即将开展全球临床I期、多中心、开放标签、首次人体剂量递增和扩展研究,将招募乳腺癌、EGFR野生型和突变型非小细胞肺癌、食管癌、胃癌、结直肠癌等多种类型实体瘤患者,旨在探索不同剂量下的DM001在人体中的安全性、耐受性,并初步评估其抗肿瘤活性。

该研究预计今年8月开始,这一阶段的研究结果将为后续的临床研发提供关键数据,推动DM001早日惠及更多肿瘤患者。

多玛医药联席CEO宋君博士表示:“我们对DM001的临床前数据充满信心,期望在临床研究中能验证其在抗肿瘤治疗中的巨大潜力。多玛医药致力于通过创新的治疗手段,为癌症患者提供更多的生存机会和更好的生活质量。”

关于多玛医药
多玛医药于2021年9月在苏州BioBAY成立,是一家以生物学为引领的兼顾孵化功能的生物医药研发公司。2022年6月宣布完成A轮融资9.5亿元,融资由百奥赛图、国寿股权、人保资本、国投基金、苏州工业园区、太平医疗健康基金以及招银国际共同完成。
据首席运营官黄蕤博士介绍,多玛医药专注于从1到10,打造具有国际竞争力的创新产品线,其背后的是包括百奥赛图在内的多位创始股东,这些股东拥有国内顶级的技术创新资源网。
多玛医药所孵化公司在初期可借助百奥赛图强大的新药发现平台,针对某类疾病的一系列靶点定制具有潜力的新药管线,快速构建成熟丰富的pipeline,节省早期研发投入。其第一个孵化子公司为专注于双抗ADC新药研发的思道医药,有多款双抗adc在研。
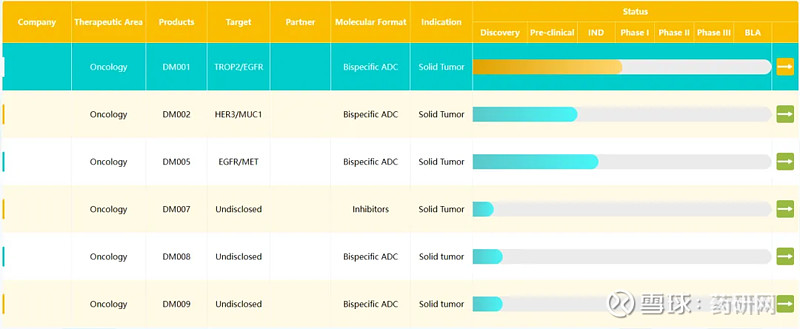
多玛医药产品管线
来源文章:公众号药研网,欢迎专注医药行业资讯分享,市场洞察及靶点介绍
