5月7日,信达生物制药宣布,其重组人源抗CLDN18.2 ADC药物IBI343已被CDE纳入突破性治疗药物(BTD)品种名单,拟定适应症为至少接受过二种系统性治疗的CLDN18.2表达阳性的晚期胃/胃食管交界处腺癌。
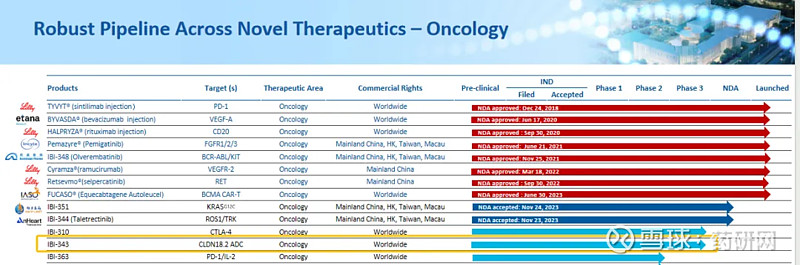
信达生物部分产品管线 | 来源:CDE
IBI343是重组人源抗CLDN18.2 ADC,与表达CLDN18.2的肿瘤细胞结合后,可发生CLDN18.2依赖性ADC内化,并释放毒素药物引起DNA损伤,导致肿瘤细胞凋亡。IBI343在CLDN18.2低表达和高表达的荷瘤药理学模型中均展现出了良好抗肿瘤活性,同时在临床前模型中安全性特征良好,整体安全性可控。
信达生物部分产品管线|来源:官网
本次突破性治疗药物认定是基于一项正在中国和澳洲进行的1期临床研究结果(NCT05458219)。该项开放、多中心I期研究的主要目的是评估IBI343在晚期实体瘤受试者中的安全性、耐受性和初步有效性,并确定最大耐受剂量(MTD)和/或II期推荐剂量(RP2D)。
据本次BTD申请资料,IBI343单药在晚期胃/胃食管交界处腺癌患者中显示了令人鼓舞的疗效和良好的耐受性。相关研究结果将在近期的ASCO大会上发布,近期公布摘要如下:
IBI343 (抗CLDN18.2 ADC)
摘要标题:IBI343(抗Claudin18.2 ADC)在晚期胰腺导管腺癌或胆道癌患者的安全性和疗效:I期研究的初步结果
摘要编号:3037
会议类型及展现形式:壁报分会场-开发治疗-分子靶向药物和肿瘤生物学
展示时间:2024年6月1日 上午9:00-12:00 (美国中部时间)
演讲者:复旦大学附属肿瘤医院 虞先濬教授
目前,信达生物一项IBI343针对CLDN18.2阳性、HER2阴性胃/胃食管交界处腺癌的国际多中心III期临床研究(NCT06238843)即将启动,该研究预计招募450例受试者,预计完成时间为2026年5月。


IBI343注册性III期试验|来源:clinicaltrials
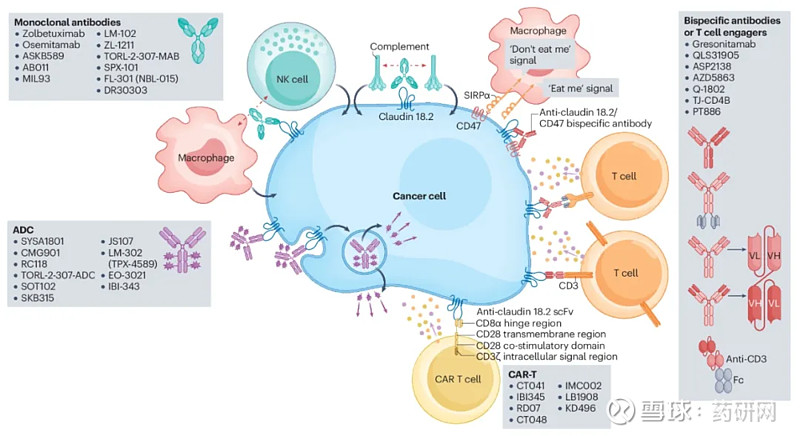
胃癌和胰腺癌等肿瘤的靶向治疗手段较匮乏,存在巨大的未满足的临床需求。CLDN18.2高表达于胃癌和胰腺癌中,靶向CLDN18.2的药物是潜在的新型抗肿瘤治疗方案。
目前为止,全球20多家药企布局了claudin 18.2靶向药物的临床开发,大部分在研项目属于单靶点抗体药物,此外还包括claudin 18.2双抗药物、ADC和CAR-T等。
3月27日,安斯泰来靶向Claudin18.2单抗Vyloy(zolbetuximab)获日本厚生劳动省批准上市,用于治疗CLDN18.2阳性、不可切除、晚期或复发性胃癌患者。Vyloy成为首个获得全球监管机构批准的CLDN18.2靶向疗法。两项关键临床试验(SPOTLIGHT研究和GLOW研究)积极结果确立了CLDN18.2阳性可作为晚期胃癌一个独立的治疗亚型,晚期胃癌患者将从Zolbetuximab联合化疗中获益。
文章来源:公众号药研网,欢迎专注医药行业资讯分享,市场洞察及靶点介绍