日前,艾伯维的ADC新药 Telisotuzumab Vedotin(Teliso-V;ABBV-399)在国内启动 III 期临床,评估该药物在既往接受过治疗的非鳞状非小细胞肺癌患者中的疗效和安全性。下文梳理了艾伯维包括ABBV-399在内的5款已进入临床的ADC。

Telisotuzumab vedotin
这是一款靶向c-Met的ADC,由ABT-700(c-Met靶向)抗体通过可裂解的缬氨酸-瓜氨酸(vc)连接物与细胞毒性微管抑制剂MMAE结合而成。
在NSCLC中,相对于邻近的正常肺组织,c-Met和HGF都过度表达。c-Met抗体与c-Met受体结合,c-Met受体被内化,通过连接物附着在抗体上的细胞毒素被释放到细胞膜上,杀伤癌细胞。
c-Met的唯一已知配体是肝细胞生长因子(HGF),HGF与c-Met的结合激活多种细胞内信号传导途径,包括:MAPK/RAS级联、PI3K/AKT级联和STAT通路。
这些信号通路负责驱动增殖、细胞生存、迁移和侵袭,另外c-Met/HGF对胚胎发育和组织修复至关重要。
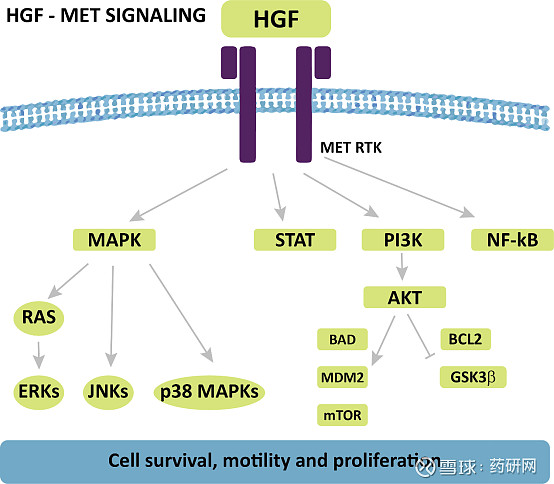
c-Met过量表达在各种实体瘤中具有预后意义。乳腺癌(20-30%),非小细胞肺癌(37-67%;IHC≥2+),胃癌(50%),结直肠癌(61%),头颈部癌症(高达80%),肾癌(32%),胰腺癌(40-60%),由于c-Met引导的途径的冗余激活,肿瘤上的c-Met表达本身并不能充分预测小分子抑制剂的活性。c-Met抑制剂的抗肿瘤活性一般只限于主要由MET信号驱动的肿瘤患者的子集,必须选择有MET扩增的患者。
靶向c-Met的抗体药物结合物(ADCs)代表了一种有吸引力的治疗策略,其疗效不依赖于对下游信号传导的抑制,而是依赖于靶点表达。
与正常组织相比,许多癌症的c-Met蛋白表达明显较高,比如说在携带EGFR突变的NSCLC肿瘤样本中发现c-Met的高表达。50%的原发性EGFR-TKI无效的NSCLC肿瘤显示c-Met高表达,而只有3%显示c-Met扩增。c-Met的表达与EGFR突变之间存在明显的相关性(p = 0.029)。
在晚期NSCLC中,MET突变对总生存率有不利影响(危险比为23.65;p = 0.005),表明预后不良。先前的c-Met抑制剂需要MET扩增或c-Met激活才能发挥作用,而临床前模型证明Telisotuzumab vedotin向c-Met过表达的肿瘤细胞提供细胞毒素,使细胞被杀死而不依赖MET信号。
尽管针对c-Met的ADC可能会出现基于c-Met正常组织表达的靶向毒性风险,但目前来看安全性尚可。
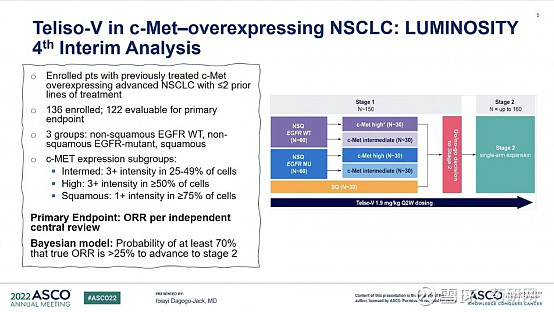
2022年初,这款药获FDA突破性疗法认定,用于治疗晚期/转移性EGFR野生型、非鳞状NSCLC且c-Met过表达水平较高、疾病在铂类治疗中或之后出现进展的患者。这是基于2期LUMINOSITY(研究M14-239)的数据。
2022年ASCO大会上披露的更新数据如下图所示。试验共评估了 122 例患者的 ORR,结果显示, EGFR 野生型非鳞癌组 ORR 为 36.5%,其中,高度 c-Met 过表达人群的 ORR 为 52.2%,中度 c-Met 过表达人群的 ORR 为 24.1%;EGFR 突变型非鳞癌组和鳞癌组的 ORR 则相对较低,分别为 11.6%,11.1%。

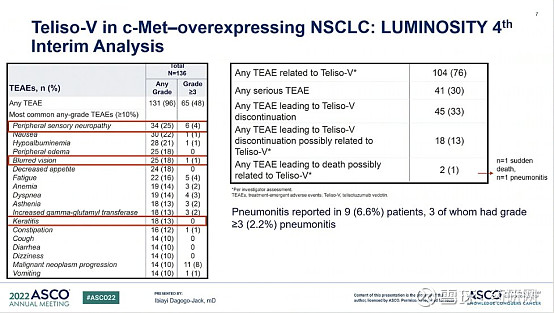
目前,Teliso-V的III期临床试验已在进行中,主要目的是确定Teliso-V是否比多西紫杉醇效果更好,并评估 Teliso-V在以前接受过治疗的 NSCLC 成人参与者中的安全性。
ABBV-400
ABBV-400是艾伯维的下一代c-Met药物,payload用了topoisomerase inhibitor,主要针对cMET表达量在中~高水平的患者,对表达量低的患者毒性增加。利用c-Met向过度表达的肿瘤细胞提供拓扑异构酶抑制剂,抑制DNA复制,从而阻止细胞增殖并诱发细胞毒性。

目前,ABBV-400已进展到临床I期试验(NCT05029882),主要目的是评估ABBV-400治疗晚期实体肿瘤成年患者时的不良事件和疾病活动变化。试验包括剂量扩增和剂量扩展阶段,剂量扩增阶段治疗组接受不同剂量的ABBV-400,以探索推荐的第二阶段剂量(RP2D)。
ABBV-011
ABBV-011是一种靶向SEZ6的ADC,能诱导受体快速内化,携带的卡利奇霉素弹头对小鼠肿瘤,如白血病和实体瘤表现出非凡的活性,是非常有效的序列特异性、双链DNA裂解剂。
SEZ6是一种跨膜蛋白,能够选择性地高表达在神经内分泌肿瘤上,包括SCLC,而在正常组织中表达有限,因此被用于开发携带有效载荷的新型ADC。
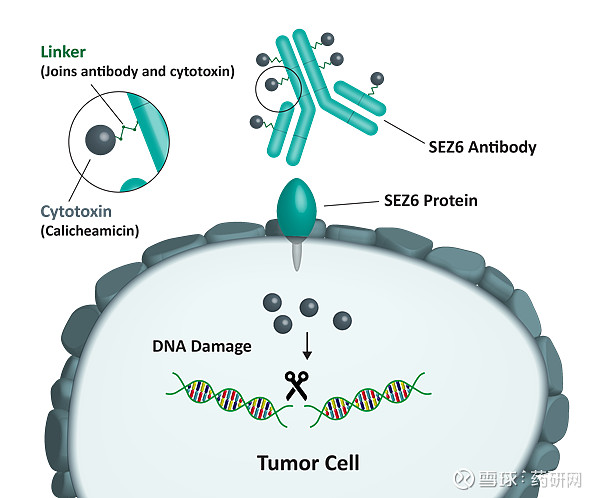
临床前试验表明ABBV-011在体外有效和选择性地杀死 SEZ6 阳性细胞,具有靶向特异性细胞毒性:
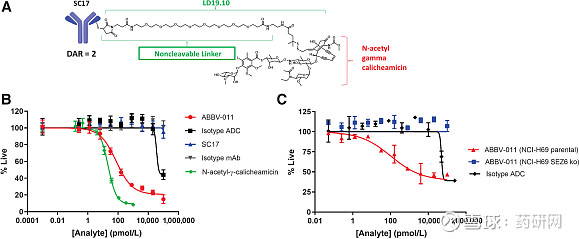
药物活性
ABBV-011 在 SEZ6 阳性SCLC PDX 模型中诱导剂量依赖性肿瘤消退:

ABBV-011目前正处于I期临床试验,主要目的是研究单独使用ABBV-011和与ABBV-181(抗PD1)联合治疗复发或难治性小细胞肺癌的疗效和安全性。
Mirzotamab clezutoclax
Mirzotamab clezutoclax(ABBV-155)是一种靶向B7H3的ADC药物,结合BCL-XL抑制剂作为有效载荷。
B7H3是一种免疫调节性跨膜N链糖蛋白,在一些实体瘤中过表达,包括小细胞肺癌、非小细胞肺癌、乳腺癌等。ABBV-155与细胞表面的B7H3结合,导致ADC内化、连接体裂解以及细胞内有效载荷的释放,从而导致细胞凋亡。
目前,ABBV-155已进行到I期临床试验。试验包括剂量递增和剂量扩展阶段,以评估ABBV-155单独使用和与紫杉醇或多西紫杉醇联合使用在治疗复发和/或难治性实体瘤成人患者中的安全性、药代动力学(PK)和初步疗效。
该试验的初步结果已在2021年ASCO年会上公布。主要结果如下表,ABBV-155暴露的中位持续时间是3个周期(范围1-14)和联合治疗的5个周期(范围1-14)。
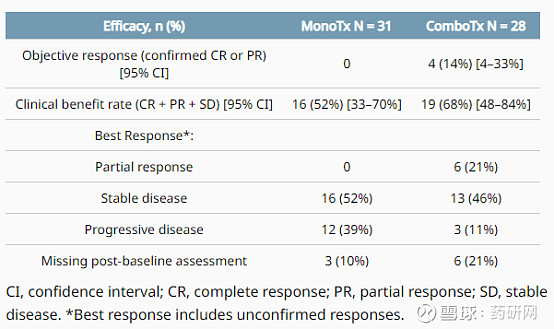
组合疗法中,2例出现DLT(4级中性粒细胞计数减少和3级淋巴细胞计数减少)。97%的患者有不良事件(AEs)。最常见的AE(≥20%的患者)是疲劳(39%)、恶心(25%)、腹泻和关节痛(各22%)、呕吐和低血钾(各20%)。一名使用单药的患者出现了致命的心脏骤停。

联合疗法肿瘤病变大小变化如下:

目前正在对前瞻性选择的B7H3阳性肿瘤做进一步调查,作为R/R小细胞肺癌患者的单药治疗,以及R/R乳腺癌患者的紫杉醇和R/R非小细胞肺癌患者的多西紫杉醇的剂量扩展阶段。
Cofetuzumab pelidotin
Cofetuzumab pelidotin(ABBV-647/PF-06647020)是一款靶向PTK7的ADC药物,由 PTK7 靶向的人源化单克隆抗体、可切割的缬氨酸-瓜氨酸接头和微管抑制剂 Aur0101 构成。
PTK7是Wnt信号通路中一种高度保守但无催化作用的受体酪氨酸激酶。PTK7在至少三种肿瘤类型(三阴性乳腺癌、非小细胞肺癌和卵巢癌)的TICs中富集,相较于正常组织,其在肿瘤中的表达量增加。
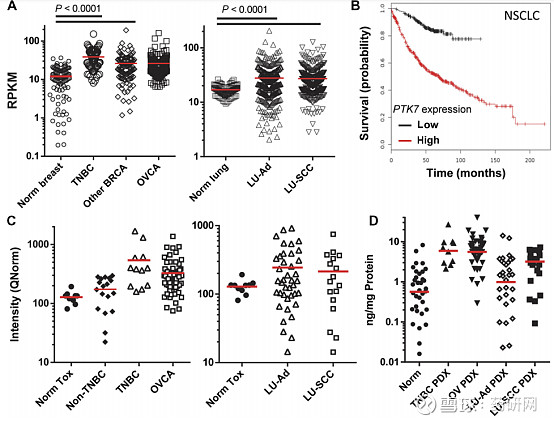
(A) PTK7 mRNA在TCGA原发性人类肿瘤中的表达与正常组织相比。(B) PTK7 mRNA表达的NSCLC患者生存率的Kaplan-Meier图。(C) PTK7 mRNA在PDX中的表达(D) PDXs和正常组织裂解液中PTK7蛋白的表达
目前cofetuzumab pelidotin针对复发性NSCLC的I期临床试验(NCT04189614)正在进行中,一项研究cofetuzumab pelidotin在晚期实体瘤患者中的I期临床试验(NCT02222922)显示已完成。
NCT02222922临床结果显示每3周给药一次,最常见的与治疗相关的AEs是恶心、脱发、疲劳、头痛、中性粒细胞减少和呕吐(45%–25%)。两名患者在每3周评估的最高剂量时出现剂量限制性毒性(3 级头痛和疲劳)。

每3周给药一次,>10%患者报告的TRAE

每3周给药不同剂量的TRAEs
在实体瘤患者中每3周给药一次的平均药代动力学曲线如下图:

ADC (A)、总抗体 (B) 和未偶联payload (C)
晚期卵巢癌(A和D)、NSCLC(B和E)和TNBC(C)患者的PTK7蛋白表达和对这款ADC每3周(A、B和C)或每2周(D和E)治疗的最佳总反应如下。

推荐的 II 期剂量为每3周2.8 mg/kg。每3周和每2周的组别中表现出抗肿瘤活性,在评估的所有剂量水平中,卵巢癌患者的ORRs分别为27%和26%,NSCLC为16%和33%,TNBC为21%(每3周方案)。

该临床试验结果表明cofetuzumab pelidotin在2.1-3.2 mg/kg 的剂量范围内对既往接受过治疗的卵巢癌、NSCLC 和 TNBC 患者显示出治疗活性。更多ADC梳理见微信自媒体:药研网
参考:
4.企业官网