日前,ImmunoGen宣布FDA已接受该公司为旗下靶向叶酸受体α(FRα)的ADC药物mirvetuximab soravtansine递交的生物制品许可申请(BLA),单药治疗FRα高表达,对含铂疗法耐药的经治晚期卵巢癌患者。FDA同时授予这一BLA优先审评资格,预计在今年11月28日之前做出回复。
2020年10月,华东医药和ImmunoGen达成协议,获得后者mirvetuximab soravtansine在大中华区的独家开发和商业化权益。ImmunoGen获得4000万美元的首付款,并在实现临床开发、注册和商业里程碑后,获得至多2.65亿美元的里程碑付款,还将获得分级的,两位数的销售额分成。
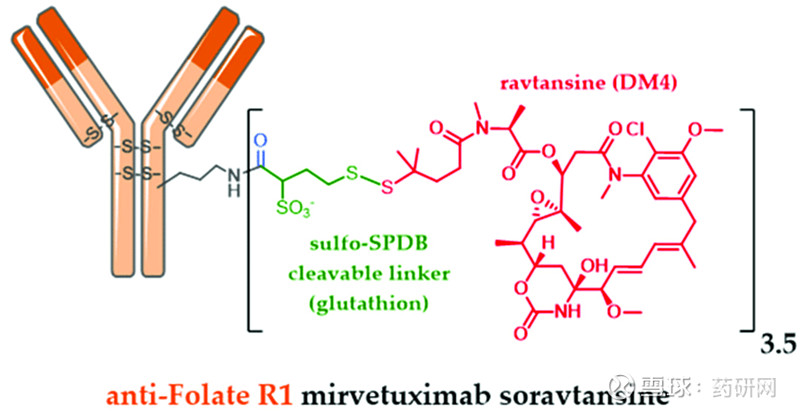
Mirvetuximab将与FRα结合的人源化单克隆抗体,与能够产生细胞毒性的DM4分子通过二硫键连接起来。当ADC与FRα结合之后,FRα能够将ADC转移到细胞内部,ADC携带的细胞毒性分子从而抑制肿瘤细胞的有丝分裂。
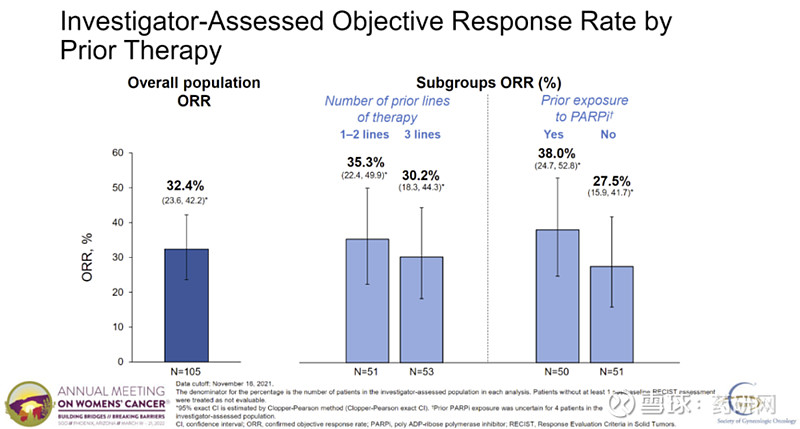
本次申请是基于关键性3期临床试验SORAYA的结果。该3期临床试验入组了106例肿瘤表达高水平FRα的含铂药物耐药卵巢癌患者,患者中位既往治疗线数为3线,并且都接受过贝伐珠单抗治疗。试验达到其主要终点,经研究者评估确认的客观缓解率(ORR)为32.4%(95% CI:23.6%,42.2%),包括5例完全缓解(CR),与既往治疗线数或既往PARP抑制剂(PARPi)治疗无关。
在中位缓解持续时间(DOR)的关键次要终点上,截至2022年3月3日,研究者评估的中位DOR为6.9个月(95% CI:5.6,8.1)。此外,研究者评估的中位无进展生存期(PFS)为4.3个月(95% CI:3.7,5.1)。