

引言

2022年1月19日,药审中心承办了恒瑞医药1类生物制品阿得贝利单抗注射液(SHR-1316)的上市申请。这是我国申报上市的第5款PD-L1单抗。之前还有思路康瑞的恩沃利单抗、基石药业的舒格利单抗获批、兆科药业的首克注利单抗和科伦药业的泰特利单抗。

(图源:CDE官网)
阿得贝利单抗注射液
阿得贝利单抗注射液是恒瑞医药自主研发的人源化抗PD-L1单克隆抗体,能通过特异性结合PD-L1分子从而阻断导致肿瘤免疫耐受的 PD-1/ PD-L1通路,重新激活免疫系统的抗肿瘤活性,从而达到治疗肿瘤的目的。
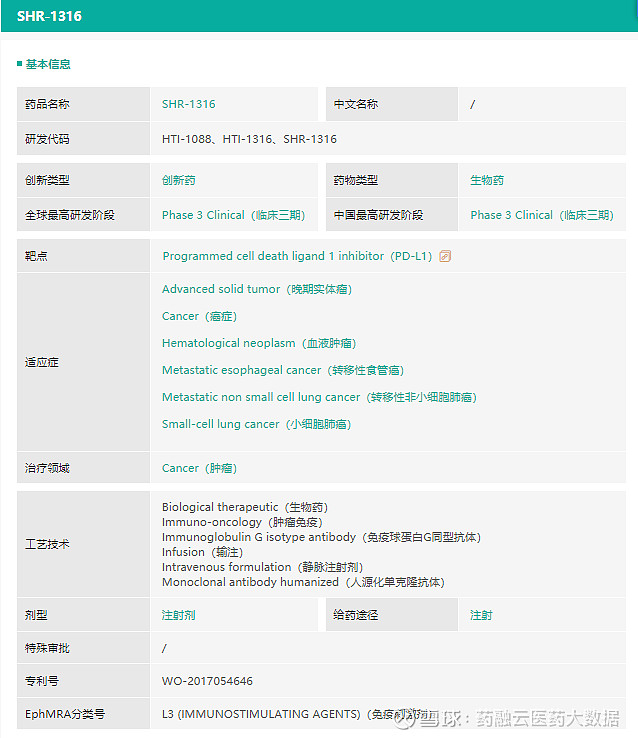
截图来源:药融云全球药物研发数据库
2021年10月,恒瑞医药公布数据显示阿得贝利单抗注射液联合化疗一线治疗广泛期小细胞肺癌(NSCLC)的随机、双盲、安慰剂对照、多中心的III期临床研究(SHR-1316-III-301)主要研究终点结果达到方案预设的优效标准。
SHR-1316-III-301由吉林省肿瘤医院程颖教授和中国医学科学院肿瘤医院王洁教授共同担任主要研究者。全国49家中心共同参与。主要研究终点是总生存期(OS)。次要研究终点包括无进展生存期(PFS)、客观缓解率(ORR)、缓解持续时间(DoR)、疾病控制率(DCR)和安全性等。研究共入组462例受试者,按照1:1随机入组,分别接受阿得贝利单抗或安慰剂联合依托泊苷和卡铂,每3周给药1次,完成4-6个周期联合治疗后,进入阿得贝利单抗或安慰剂维持治疗,直至疾病进展、毒性不可耐受或其他需要终止治疗的情况。研究结果表明,阿得贝利单抗联合化疗对比安慰剂联合化疗获得显著且具有临床意义的总生存期(OS)延长。恒瑞医药基于此宣布计划向CDE递交新适应症上市申请的沟通交流申请。
阿得贝利单抗最终会被批准哪项适应症暂不可知。FDA对PD-1/L1单抗治疗NSCLC的态度较为审慎,对于基因检测有明确的要求。2020年5月18日,FDA批准了阿替利珠单抗(Roche的T药)用于肿瘤细胞PD-L1表达≥50%(TC≥50%)或肿瘤浸润免疫细胞PD-L1表达≥10%(IC≥10%)且肿瘤细胞无 EGFR 或 ALK 变异的转移性非小细胞肺癌患者的一线治疗。是PD-L1单抗首个获批的NSCLC适应症。
PD-L1单抗
继PD-1单抗之后,国产的PD-L1单抗也将迎来一波爆发期。2021年思路康瑞的恩沃利单抗和基石药业的舒格利单抗获批,分别拿下了国产PD-L1单抗的第一和第二。兆科药业的首克注利单抗和科伦药业的泰特利单抗也已提交了NDA。
下图整理了根据药融云数据库得到的国内PD-L1靶向药物研发进度的的信息(统计截止2021年12月31日),供大家参考:
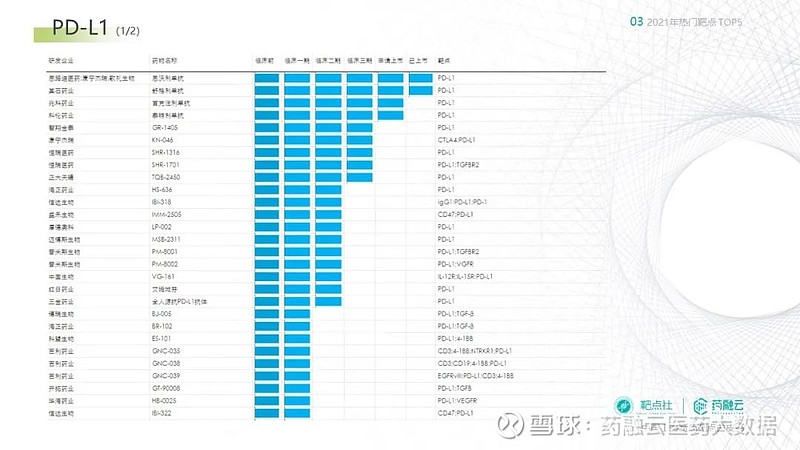
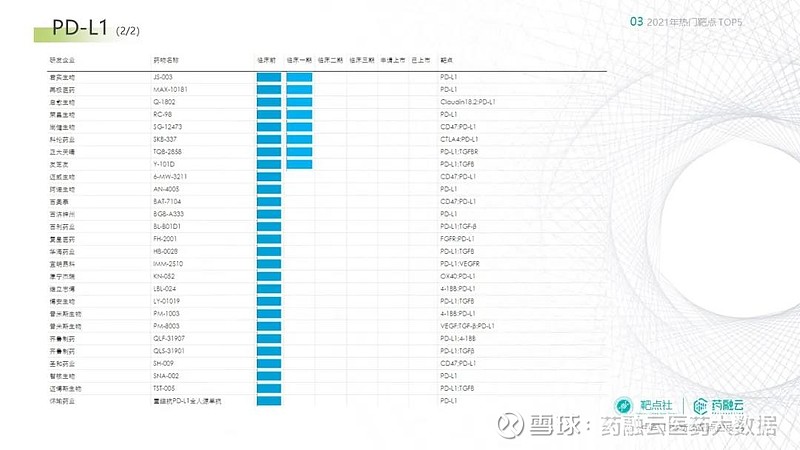
(来源:药融云数据库)
恒瑞医药产品
经药融云数据查询,恒瑞医药目前共有126款创新药产品在研,其中14款产品已上市;加上此次阿得贝利单抗注射液报上市,7款已提交上市申请。值得注意的是,还有46款产品在进行临床1期试验。在治疗领域上,恒瑞医药瞄准肿瘤,有70款是针对该靶向,占比39.77%。
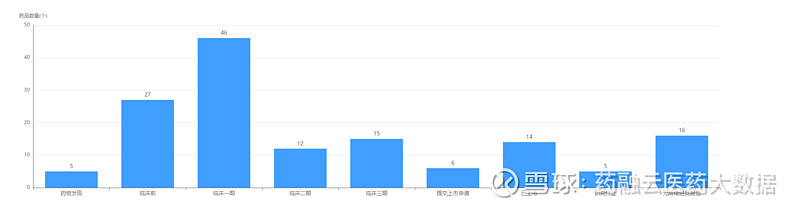
图片来源:药融云全球药物研发数据库
另外在仿制药方面,恒瑞医药至今已有49品种(65品规)通过(含视同通过)一致性评价(见图1),其中有25品种(32品规)拿下了首家过评。此前,恒瑞医药曾表示,“暂停研发部分没有竞争力的仿制药项目,只做创新药和有核心价值的高端仿制药”。据粗略统计,恒瑞目前还有30个品种的一致性评价工作正在开展(见图2)。
图1.恒瑞医药已过评品种
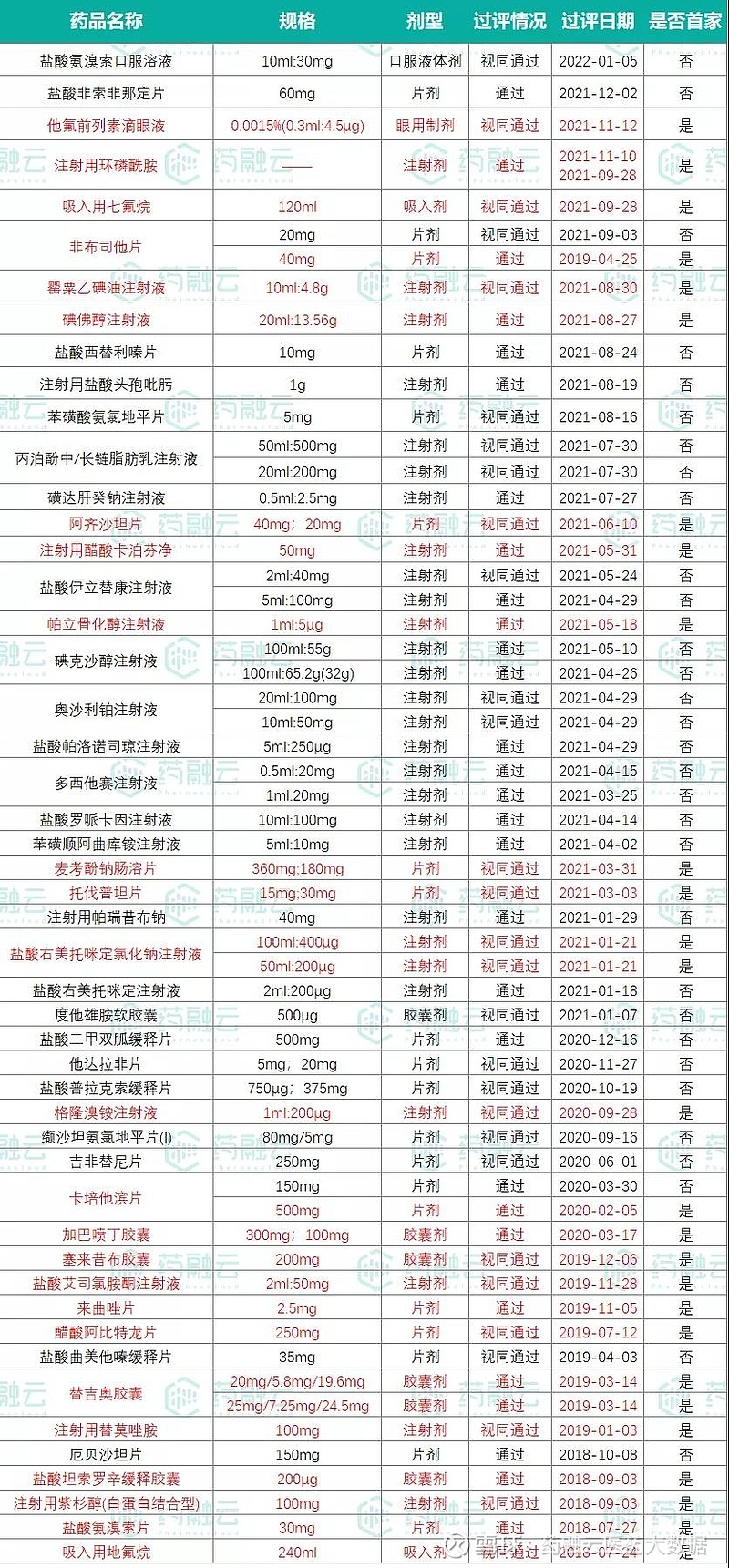
图2.恒瑞医药当前一致性评价在审情况
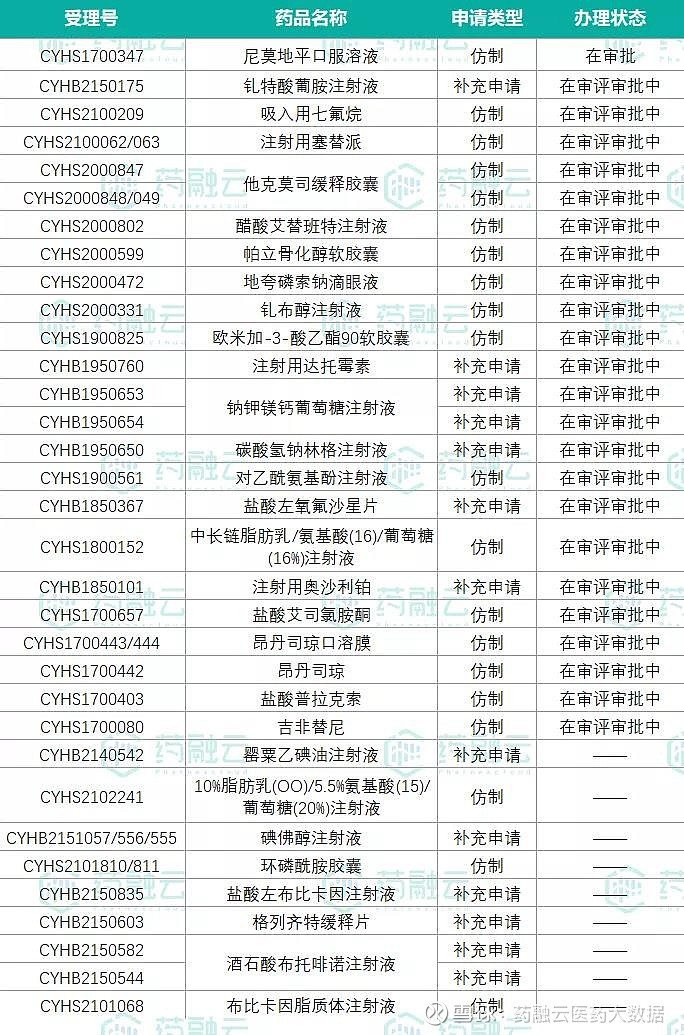
▲数据来源:药融云药品审评数据库
参考来源:
[1] CDE官网
[2] 药融云数据
$恒瑞医药(SH600276)$ $恒瑞股份(NQ837089)$ #PD-L1# #创新药# #恒瑞医药#
<END>
文章来源:靶点社