下半个月18a有个众所周知的盲盒开奖,盲盒是免疫疗法治疗胰腺癌,所以针对胰腺癌提前做点功课,这功课是我做过的最难最复杂的功课,癌王名不虚传。 癌症特点各类科普文讲了很多了,所以简单略过,重点说说难治的逻辑,有问题欢迎讨论指正。
一、胰腺癌的位置和分类
胰腺位于上腹部胃的后方,紧贴脊柱,分为胰头、胰体、胰尾三部分,胰头被十二指肠包绕,胰体在胃下面,胰尾位于左腹部靠近脾脏。胰腺是由外分泌部(分泌胰液的腺泡及逐级增大的输送导管)和内分泌部(胰岛)组成的。
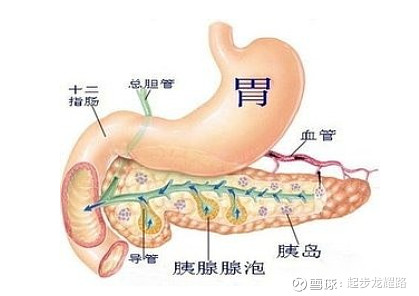
外分泌腺可以分泌消化酶,通过胰导管与胆总管(肝脏的胆汁导管)汇合然后释放到十二指肠内,帮助消化食物。内分泌细胞占胰腺细胞的比例很小,在胰岛组织中负责产生二十多种人体激素,如胰岛素和胰高血糖素,并直接释放到血液中。通常所说的胰腺癌是指外分泌部发生的上皮源性恶性肿瘤,胰腺癌常见类型90%为导管腺癌,内分泌部肿瘤较为稀少,而且胰腺神经内分泌癌的预后较好。
同时胰腺上的肿瘤根据生长位置侵犯程度,主要症状不同。比如当肿瘤位于胰脏头部时,因为位置靠近总胆管,挤压总胆管时肝脏制造的胆汁无法排出,会造成黄疸;肿瘤压迫十二指肠造成食物无法通过,引起恶心、食欲不振、体重减轻的症状。
二、胰腺癌为什么难治
胰腺癌的难治从原理上讲非常复杂,主要分为几个层级。
1、早期难以筛查,导致发现多晚期
胰腺癌早期没有明显的症状或体征,有些症状和其他疾病的症状类似,如胃炎胃溃疡等,因而经常造成误诊。另外胰腺位于胃、小肠、肝脏后面,影像学筛查很难看到或直接摸到早期的肿瘤。
2、无法手术或难手术
当肿瘤被发现时已经成长较大或者侵犯到腹主动脉、上肠系膜动脉(负责给胃、肠等器官供血),能够手术的空间有限,仅有不到 20% 的患者在确诊时具有手术治疗机会。就算病人能够接受手术治疗,根治手术的难度也高,胰头十二指肠切除需要切除部分胃部、空肠、十二指肠以及胰头。
3、容易转移
胰腺血供主要来自胃十二指肠动脉、肠系膜上动脉和脾动脉的分支,这些分支在胰腺内相互吻合形成丰富的动脉网,静脉回流主要通过肠系膜上静脉和脾静脉,最终汇入门静脉往肝脏流去,所以易发生肝转移。同时胰腺的腺泡周围有许多毛细淋巴管,这些毛细淋巴管逐渐汇合形成较大的淋巴管,伴随着胰腺内血管的走行,汇聚到胰腺周围淋巴结。按照这个特点,胰腺癌的转移主要可分为淋巴性转移、腹膜种植、血行转移、直接侵润转移、沿神经周围转移,而往往在发病初期就已伴随淋巴结侵犯或远处脏器转移。我在之前组织因子的分析里就讲过接受根治手术的胰腺癌患者中,术后由于易转移原因高发静脉血栓,就是肿瘤细胞转移中产生的循环肿瘤细胞CTC导致。
4、常规药物效果差
对于不能手术切除的胰腺癌,化疗和放疗是目前主要的治疗方式,包括吉西他滨,FOLFIRINOX和Nab-紫杉醇等,但由于胰腺癌缺乏有效的靶向治疗药物,而且肿瘤具有实质高纤维化及“冷肿瘤”的特征,常规化疗方案极易在短期内出现耐药性和强烈化疗副作用,OS仅为6-10个月。 虽然PD-1/PD-L1的免疫检查点抑制剂在多种肿瘤中显示了疗效,但PDAC患者在免疫治疗中仍未显著获益,总体来看胰腺癌的综合治疗效果不佳。
三、胰腺癌导致化疗、靶向和免疫疗法具有明显的抵抗性的原因
胰腺癌之所以预后极差,是因为胰腺癌对化疗、靶向疗法和免疫等疗法具有明显的抵抗性,而这主要由于胰腺癌致密的间质,能够占到胰腺肿瘤体积的90%,所以胰腺癌又被称作硬癌。
胰腺癌肿瘤微环境(TME)由3个部分组成:基质成分,如胶原蛋白、纤维连接蛋白、层黏连蛋白、蛋白多糖等;细胞成分,以胰腺癌细胞、肿瘤相关成纤维细胞(CAF,最丰富的细胞成分)、髓系来源抑制细胞、肿瘤相关巨噬细胞等为主;可溶性因子,如转化生长因子-β(TGF-β)、IL-1、IL-6、IL-10、血管内皮生长因子、血小板衍生生长因子等。其中CAF能产生大量的细胞外基质(ECM)成分,促进间质纤维化,是胰腺癌致密组织结构的重要来源。胰腺癌CAF细胞来源、表型及功能多种多样、随着肿瘤进展而动态变化。多种研究表明,CAF和肿瘤细胞及基质的其他细胞存在广泛且复杂的相互作用,导致肿瘤微环境中间质高度纤维化、致密结缔组织增生、免疫抑制及乏血供、乏氧等特性,是胰腺癌化疗、放疗、靶向治疗、免疫治疗耐药的主要原因。
1、CAF的构成和来源
胰腺癌TME由成纤维细胞、免疫细胞、内皮细胞及可溶性因子等组成了一个高度异质的微生态系统。其中肿瘤相关成纤维细胞CAF有多种起源而且高度异质性,除了组织常驻成纤维细胞,内皮细胞、骨髓来源等各种来源的间充质干细胞可以分化为CAF,也可以通过上皮-间充质转化(EMT)形成CAF。除了复杂的异质性之外,CAF本身的作用复杂,不仅可以促进胰腺癌的发展,CAF本身也具有抑制肿瘤的作用,所以本身亚型中也可分为促肿瘤CAF和抑肿瘤CAF。一项临床前研究表明,平滑肌肌动蛋白阳性的CAF细胞去除意外增强了肿瘤细胞的上皮-间充质转换促进了肿瘤侵袭,因此需要有效区分CAF亚群标识。
目前已鉴定出比较重要的几类CAF亚型包括肌成纤维型myCAF(更靠近肿瘤,高表达αSMA和转化生长因子β下游基因)、炎症型iCAF(远离肿瘤,高表达炎症介质基因如JAK/STAT)、apCAF(不表达共刺激分子但表达抗原呈递分子,激活T细胞或Treg细胞具有免疫调节能力)、meCAF(促使肿瘤细胞氧化磷酸化)等。 还有更变态的,不同的亚型CAF之间在一定空间条件下可以互相转化或者继续分化。。。
胰腺中的驻留型成纤维细胞,也被称为胰腺星状细胞(PSCs),PSCs占正常情况下实质细胞的4%~7%,静止成纤维细胞转录活性和蛋白质合成水平较低,当胰腺组织受到损伤或刺激时,PSCs被活化产生大量ECM成分,此外还能分泌细胞因子、脂肪因子和生长因子,PSCs是胰腺癌CAF的最重要的来源,也是肿瘤基质中胶原蛋白的主要来源。研究已发现,坏死、炎症过程是激活PSCs的先决条件,如果炎症缓解,PSCs可能会凋亡或恢复成静止状态。
2、CAF导致化疗药效差的原因:
CAF细胞通过不同的作用途径或方式发挥促进或抑制胰腺肿瘤的功能,主要分为三大类:分泌基质相关蛋白;分泌细胞因子和趋化因子;代谢产物。
(1)激活的CAF不断产生ECM,在癌细胞周围形成瘢痕状组织茧,阻止化疗药物进入癌细胞,另外细胞周围ECM会产生微观机械力,这种细胞外的微观机械力驱动着细胞组织形态的变化,CAF产生的透明质酸堆积增加了间质压力(胰腺癌的肿瘤组织间液压力比已知的其他肿瘤类型的都要高),挤压血管造成乏氧乏营养的状态,同时,血管塌陷会阻碍对小分子药物的扩散和免疫细胞的浸润。
细胞中间质压力还可以激活相关信号通路,比如激活整合素相关通路(介导肿瘤细胞与ECM蛋白的相互作用,影响癌细胞侵袭)、黏着斑激酶信号通路等。肿瘤转移依赖肿瘤细胞侵入细胞外基质,并且同时向血管及淋巴管道内迁移,再通过循环肿瘤细胞 (CTC)这种运输形式,才能向肝脏、大脑、骨骼等部位转移,而成纤维细胞产生的大量转化生长因子 β 诱导蛋白(βig-H3)作为一种细胞外基质蛋白,不仅对肿瘤细胞的转移侵袭能力有着很重要的促进作用,胰腺癌基质金属蛋白酶 (MMPs) 可以有效破坏癌症细胞的细胞外基质以及基底膜,而βig-H3正是MMPs的底物。而且βig-h3还通过与CD8+T淋巴细胞上高表达的整合素β3结合,减少CD8+T淋巴细胞的增殖和活化。
除了阻止药物输送外,CAF还可以直接诱导药物清除或直接影响化疗药物摄取和代谢,比如部分CAF可以把活性吉西他滨包裹在细胞内;PSCs分泌肝细胞生长因子激活c-Met/PI3K/Akt信号通路、分泌纤维连接蛋白促进癌细胞中ERK1/2的高活性以及生成的脱氧胞苷抑制脱氧胞苷激酶对吉西他滨磷酸化均可引起胰腺癌细胞对吉西他滨的抵抗。
(2)CAF可以分泌细胞因子或多种生长因子、趋化因子(调节免疫细胞的定位和浸润)、促炎成分,直接或通过肿瘤细胞所处的微环境激活抗凋亡信号通路。比如KRAS突变的胰腺肿瘤细胞及CAF可以分泌IL-1β,激活IL1β- IRAK4环路,驱动肿瘤细胞内的NF-κB活性,而且KRAS突变的肿瘤细胞分泌的PAI-1会增加其a-SMA表达和基质成分的产生,促使胰腺癌细胞的增殖、间质纤维化及肿瘤细胞对化疗耐药;IL-6介导了CAF对胰腺癌细胞EMT和侵袭转移的促进作用;IL-lα和IL-1β诱导CAF产生TSLP,进一步调节表达TSLP受体的树突状细胞,促进幼稚CD4T细胞的Th2型分化;TGFβ和IL-10可以吸引免疫抑制细胞如Tregs和骨髓来源的抑制性细胞(MDSCs)进入肿瘤微环境,从而关闭组织的进一步免疫反应,尤其是TGFβ可以显著抑制NK细胞的激活和功能,保护PDAC细胞免受NK细胞介导的死亡。
(3)癌细胞通常通过糖有氧酵解的方式来获取能量,虽然胰腺癌具有乏氧乏营养的特征,但胰腺癌肿瘤细胞具有重塑获取营养物质的途径或利用营养物质的方式维持生长。。。
一方面KRAS突变可以促进葡萄糖代谢,为肿瘤细胞提供ATP,同时使胰腺肿瘤细胞通过巨胞饮摄取胞外蛋白。另一方面,CAF同时也具有促进胰腺癌细胞糖代谢的能力,myCAF可以上调糖酵解相关基因并通过分泌乳酸和丙酮酸,该途径所产生的碳取代三羧酸循环中的葡萄糖所衍生的碳来为三羧酸循环循环提供燃料,而且CAF高表达HIFla,主动将乳酸运送到肿瘤细胞中。当肿瘤细胞面对营养压力时,如缺乏葡萄糖和脂类物质,肿瘤细胞会转而优先以丙酮酸碳源形式产生能量。
(4)化疗本身诱导促肿瘤反应,会引起CAF的分子变化,化疗后的CAF比未治疗的CAF更支持肿瘤细胞的存活、迁移和侵袭。
四、目前用药的策略方向
由于上文提到的各类原因,大量关于胰腺癌的靶向治疗或者免疫药物在临床试验中,但仍未有单药能使得PDAC患者显著获益。根据《中国胰腺癌综合诊治指南》 ,可将胰腺癌的药物治疗选择分为以下几大类:
1、可切除胰腺癌的化疗用药选择,均推荐进行术后辅助化疗。以吉西他滨和氟尿嘧啶类为主,SWOG S1505临床试验针对围手术期中位生存时间分别为 22-23个月。
2、交界可切除胰腺癌的化疗用药选择。由奥沙利铂、伊立替康、氟尿嘧啶、亚叶酸钙组成化疗方案(FOLFIRINOX)新辅助化疗,或者是吉西他滨加白蛋白紫杉醇。2020 年 ASCO 年会上公布了 ESPAC-4 试验的长期生存结果,吉西他滨+卡培他滨组的中位 OS 时间27.7 个月,APACT实验中白蛋白紫杉醇联合吉西他滨组中位 OS 时间达到41.8 个月。
3、局部进展期不可切除或合并远处转移胰腺癌化疗用药选择,切除率较低,推荐新辅助治疗改善预后。一线化疗方案目前有 2 个国际公认标准:FOLFIRINOX三药方案和 AG(白蛋白紫杉醇+吉西他滨)两药方案,其中 FOLFIRINOX 方案预期有效率为 30%,预期生存 11-12 个月,AG 方案预期有效率为 25%~30%,预期生存 8.5-11 个月。基于 NAPOLI-1 研究,国外推荐 nal-IRI(伊立替康脂质体)联合 5-FU/LV(5-氟尿嘧啶/亚叶酸)作为标准二线治疗方案。
除了常规化疗药物之外,免疫疗法和靶向药物在二线中推荐使用。但是2020年esmo公布的吉西他滨+白蛋白紫杉醇+度伐利尤单抗三药联合结果并没有比AG方案获得显著优势。。靶向治疗探索方向主要集中在BRAC 突变(尼拉帕利作为一线后维持治疗,尼拉帕利+伊匹木用于维持治疗对缺乏任何DDR突变的患者中mOS为15个月)、KRAS突变($加科思-B(01167)$ 格莱雷塞完成注册性临床首个病人入组)、NTRK突变(NCCN 指南已将 TRK 抑制剂拉罗替尼等推荐用于晚期胰腺癌适用患者,ntrk突变在胰腺癌中占比极低,远不如kras和parp抑制剂广谱,所以kras其实备受期待)等。
不仅肿瘤微环境极度恶劣,就算免疫检查点抑制剂能穿越抵达肿瘤部位,而由于肿瘤中缺少有效的CD8+T细胞,无法激活足够的免疫应答反应,而且很变态的地方是,由于胰腺癌中即使杀伤了肿瘤细胞,高度致密的结缔组织仍然存在,从肿瘤整体来讲并没有得到有效缓解(revolution被低估了)。。。所以目前免疫、靶向等单药的效果不佳,将免疫治疗或其他治疗方法结合的联合疗法以及将靶向肿瘤细胞和CAF的疗法结合才是是主要探索方向:
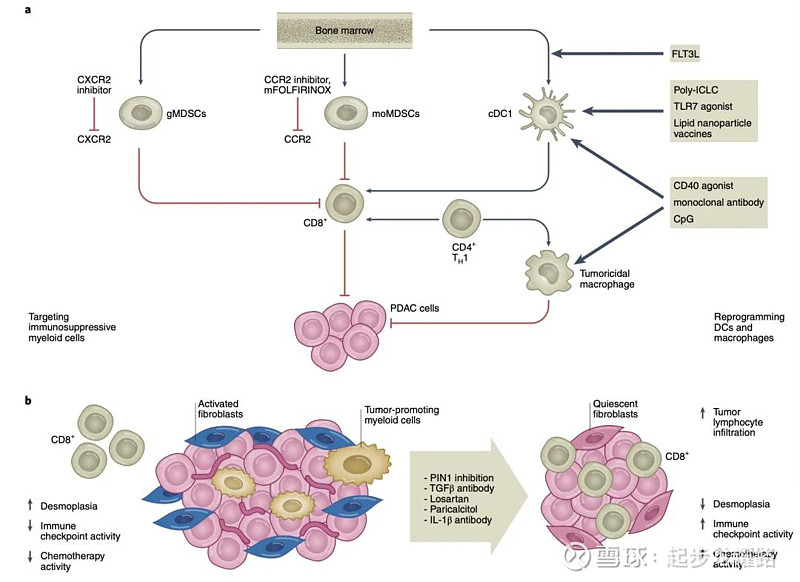
图来源:医世象
1、通过放疗和化疗等方式可杀死肿瘤细胞暴露肿瘤抗原,进而刺激免疫治疗。 $康宁杰瑞制药-B(09966)$ KN046联合标准化疗II期研究表明,ORR为45.2%,DCR为93.5%;O药和K药联用AG方案也展现出了OS获益,但是K药联用BTK、CD73抑制剂等靶向药物的临床中没有显示出获益;$再鼎医药(09688)$ PANOVA电场疗法加吉西他滨和nab-紫杉醇中位无进展生存期为12.7个月,电场疗法加吉西他滨组中位总生存期为14.9个月。(个人感觉,电场疗法由于无需穿越复杂微环境递送的优势,在胰腺癌更体现优势)
2、通过靶向CAF来源的基质蛋白或其他的基质成分,改善胰腺癌纤维结缔组织增生的情况,改善微环境,增加T细胞高浸润可以获得更好的生存期 。
Wang等通过抑制PAK1基因的表达,减少了PSCs刺激的PD-L1表达;用热休克蛋白90抑制剂处理过的PSCs可降低IL-6的分泌;TGF-β通过激活PSCs促进肿瘤的免疫逃避,抑制TGF-β的血管紧张素抑制剂氯沙坦和TGF-β抑制剂galunisertib与吉西他滨联合,可协同增加CD8+T细胞浸润和细胞毒作用来发挥抗肿瘤免疫;敲除CAF中的NetG1基因可部分通过IL-15消除其免疫抑制表型,使得NK细胞发挥抗肿瘤功能;趋化因子 CXCL12抑制剂,2020 年 ESMO NOX-A12 和K药治疗转移性胰腺癌患者的 I/II 期研究,探索了抑制 CXCL12 是否可以逆转肿瘤免疫微环境的免疫豁免状态,从而拓宽免疫检查点抑制剂对转移性胰腺癌微卫星稳定群体的适用性;COMBAT试验探索了验证BL-8040 (CXCR4抑制剂)+帕博利珠单抗+伊立替康脂质体+氟尿嘧啶+亚叶酸钙的三药化疗方案。。在控制安全性的前提下DCR达到了77%;伊立替康+5-FU/LV + IL-1α 拮抗剂 bermekimab 治疗晚期胰腺癌合并恶病质患者的研究(OnFX)一期显示联用患者得到了 10.5 个月的 OS 获益;小鼠来源的胰腺细胞培养的培养基中,使用了 βig-H3 耗竭剂后,可以发现 CD8+ T 细胞的增殖出现了显著的增加。
3、胰腺癌的僵硬微环境在维持PSCs表型方面起着关键作用,考虑药物诱导癌组织软化或者利用CAF的分子标志直接消融胰腺癌中的CAF。Turaga等以整合素avb3为靶点,用ProAgio蛋白特异性诱导肿瘤相关PSCs的凋亡,吸收胶原,打开塌陷的肿瘤血管,增强化疗药物的递送。
最后惯例总结
1、胰腺癌的难治体现在:难发现 -> 难手术 -> 易转移 -> 药效差
2、药效差主要由于复杂肿瘤微环境,而微环境恶劣体现在:高度异质性(来源、亚型复杂) -> 不同亚型具有促癌、抑癌作用,还会相互转化。
3、微环境影响药效的原因是:高压血管塌陷影响药物递送、肿瘤组织中T细胞受到抑制属于冷肿瘤、多种趋化炎症因子激活抗凋亡信号通路、特殊供能系统。
4、药物现状和方向:化疗药物为主,靶向药(kras、parp等探索中)、免疫疗法等联用是大方向,靶向微环境的药物还在研发中,但没有明显成果。
个人感想,胰腺癌药物研发刚刚从化疗药物迈出到靶向肿瘤药物和免疫疗法而已,微环境如何改善由于极其复杂的机制仍然还遥遥无期。可能的重点解决方向就是如何将药物更好递送、靶向药如何解决异质性以及激活胰腺癌组织中的免疫环境,免疫治疗或其他治疗方法结合的联合疗法,以及将靶向肿瘤细胞和CAF的疗法结合才是主要探索方向。