营养学杂志,第 139 卷,第 8 期,2009 年 8 月,第 1525-1533 页
研究介绍
我们在几项对照大鼠和人类感染研究中表明,膳食钙可提高肠道抵抗力并增强粘膜屏障。增强肠道屏障功能可以缓解炎症性肠病 (IBD)。
因此,我们在 IBD 实验大鼠模型中研究了补充钙对自发性结肠炎发展的影响。给 HLA-B27 转基因大鼠喂食含有低或高钙浓度(30 和 120 mmol CaHPO 4/kg饮食)几乎7周。将惰性铬 EDTA (CrEDTA) 添加到饮食中以通过测量尿 CrEDTA 排泄来量化肠道通透性。确定相对粪便湿重以量化腹泻。通过组织学和测量粘膜白细胞介素 (IL)-1 β确定结肠炎症。
此外,使用全基因组微阵列分析了个体大鼠的结肠粘膜基因表达。与对照转基因大鼠相比,钙饮食显着抑制了发生结肠炎的 HLA-B27 大鼠肠道通透性和腹泻随时间的增加。钙喂养大鼠黏膜 IL-1 β水平较低,组织学结肠炎评分较低(P= 0.08)。
补充钙可防止结肠炎引起的细胞外基质重塑基因(例如基质金属蛋白酶、前胶原和纤连蛋白)的表达增加,这已通过定量实时 PCR 和明胶酶谱法得到证实。
总之,膳食钙可以改善 HLA-B27 转基因大鼠结肠炎严重程度的几个重要方面。减少管腔成分对粘膜的刺激可能是该机制的一部分。这些结果表明补充钙有望作为 IBD 的有效辅助疗法。
研究方法
实验方案得到瓦赫宁根大学(荷兰)动物福利委员会的批准。近交Fisher 344背景下的雌性HLA-B27/ β2-微球蛋白转基因大鼠及其非转基因大鼠(n= 7) (Taconic Farms),8-10 周龄,实验开始时平均体重为 128 克,被单独安置在代谢笼中。
不幸的是,在实验开始时,1只转基因大鼠在获得眼眶血时死亡。因此,对照组包括9只转基因大鼠,钙组包括8只转基因大鼠。三只非转基因大鼠喂食对照饮食,四只喂食钙饮食。将大鼠保持在温度和湿度受控的环境中,并处于 12 小时光照/黑暗循环中。
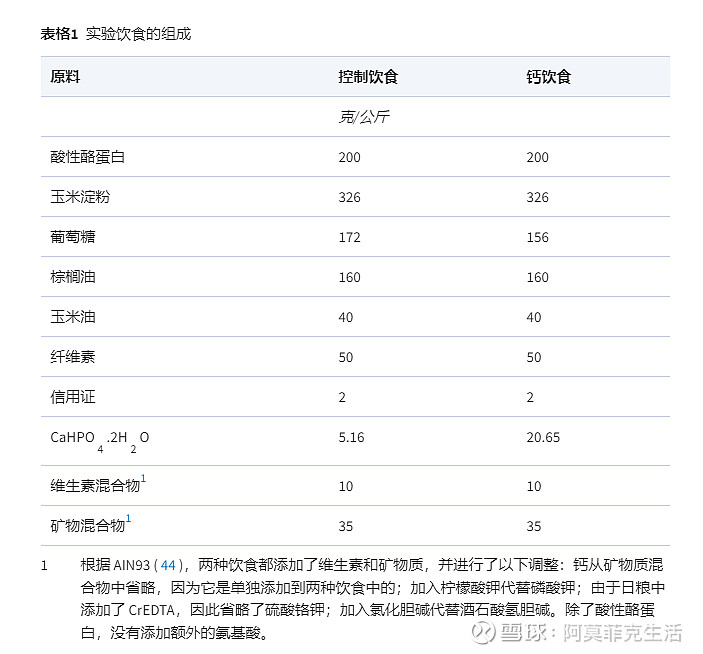
大鼠随意食用纯化的“人性化”西方饮食。饮食中钙含量低(30 mmol/kg 饮食;Sigma-Aldrich)并且脂肪含量高,以模仿西方人类饮食的组成。钙饮食包含 120 mmol 钙/kg 饮食,但以葡萄糖为代价。饮食的确切组成见表 1。
CrEDTA 溶液如其他地方所述制备,随后冷冻干燥。为了检查 CrEDTA 复合物的完全形成和稳定性,将制备的 CrEDTA 溶液通过阳离子交换树脂柱 (Chelex 100 Resin; Bio-Rad)。没有未络合的 Cr 3+离子存在。每天记录食物摄入量,每周记录体重两次。
在实验开始时,在异氟醚麻醉下获得眼眶血以制备血清。事先无法预测结肠炎的出现时间。
因此,每 1 或 2 周监测一次肠道通透性和腹泻情况,以确定合适的切片时刻。实验开始后几乎 7 周,当至少 1 个饮食组中可测量到肠道通透性和腹泻明显增加时(见结果),通过吸入二氧化碳杀死大鼠并再次获得眼眶血以制备血清。取出结肠,在盐水中洗涤,并测量重量和长度。从结肠中部切下一块 1 cm 的小块并储存在 10% 中性缓冲福尔马林中用于组织学检查。剩余的结肠部分被纵向切除。
随后,用刮刀刮掉粘膜并立即在液氮中冷冻,直到进一步处理和分析。
粪便分析
每2周收集所有粪便3天并冷冻干燥。确定粪便湿重百分比以量化腹泻。如前所述制备粪便水。如前所述,生理渗透压 (300 mOsmol/L) 的粪便水的细胞毒性通过人类红细胞悬液与粪便水孵育后的钾释放来确定,并在早期用肠上皮细胞进行了验证 。计算细胞毒性并表示为最大裂解的百分比。为了测量粪便水中的钙,用 50 g/L 三氯乙酸酸化粪便水,离心,用 0.5 g/L CsCl 稀释,并通过电感耦合等离子体原子发射分光光度法 (Varian) 进行分析。
测量肠道通透性
每周 1 天收集全部 24 小时尿样。对于 CrEDTA 测量,尿液用 50 g/L 三氯乙酸酸化,以 14,000 × g离心;2 分钟并用 0.5 g/L CsCl 稀释。然后,通过电感耦合等离子体原子发射分光光度法分析铬。使用 ELISA 试剂盒(EndoCab;Hycult biotechnology;检测限:125 个任意单位/L),使用山羊抗大鼠抗体作为示踪剂,测定血清中的抗脂多糖 (LPS) 抗体,该抗体是由 LPS 通过肠粘膜渗漏引起的。 1:20,000;Sigma-Aldrich)。
结肠组织学
结肠组织标本包埋在石蜡中,切片用苏木精和伊红染色。在分析之前,对载玻片进行重新编码以保证在不了解治疗组的情况下进行评分。使用经过验证的炎症组织学评分系统。根据炎症细胞浸润、杯状细胞耗竭、黏膜增厚和黏膜结构破坏等标准,评分范围为 0 到 4。
结肠黏膜髓过氧化物酶和白细胞介素 1 β分析
使用预冷的研钵和杵在液氮中手动粉碎冷冻的结肠粘膜刮片。均质化后,部分粉末用于 RNA 分离(见下文),其余部分悬浮在含有 200 mmol/L 蔗糖、20 mmol/L Tris、1 mmol/L 二硫苏糖醇和蛋白酶抑制剂的溶液中,然后进行蛋白质分析。
根据制造商的说明,使用 ELISA 试剂盒(检测限分别为 1.0 μ g/L 和 3.0 ng/L)测定髓过氧化物酶 (MPO) (Hycult biotechnology) 和白细胞介素 (IL)-1 β (Biosource)。IL-1 β优先于肿瘤坏死因子-α作为重要的促炎标志物进行测量,因为已经描述了肿瘤坏死因子-HLA-B27 转基因大鼠组织中的α水平要低得多。使用 BCA 蛋白质测定试剂盒 (Uptima) 以牛血清白蛋白 (Sigma-Aldrich) 作为标准分光光度法测量刮片的总蛋白质含量。
结肠黏膜 RNA 分离
根据制造商的方案,使用 TRIzol 试剂 (Invitrogen) 从冷冻匀浆的结肠刮片中分离总 RNA。用 RNeasy 柱 (Qiagen) 纯化 RNA,并使用 Nanodrop ND-1000 (Isogen Life Science) 量化纯度和浓度。A 260 :A 280比率均在1.83和2.16之间,表明RNA纯度高。
此外,我们使用 Experion (Bio-Rad) 检查了 RNA 质量,显示没有 RNA 降解。
粘膜样品的微阵列杂交
除非另有说明,否则按照全基因组微阵列技术 (Agilent Technologies) 的安捷伦程序对单个转基因大鼠的结肠粘膜样品进行扩增、标记和微阵列杂交。
简而言之,对每只大鼠的 1 μ g 总 RNA 进行逆转录。每个 cDNA 样品被分成 2 个部分,随后用于线性 RNA 扩增,并分别使用制造商指示的量的一半用 Cy5 和 Cy3 标记。使用 RNeasy 柱 (Qiagen) 纯化标记的 cRNA 样品。
我们使用 Nanodrop ND-1000 分光光度计测量染料掺入和 cRNA 浓度。每个单独样品的产量 > 825 ng,比活性 > 8.0 pmol Cy3 或 Cy5/ μg cRNA。合并所有大鼠的等量 Cy3 cRNA 作为标准参考库。
片段化后,含有单个大鼠的 Cy5 标记的 cRNA 和 Cy3 标记的池 cRNA 的样品在 4 × 44K 大鼠全基因组安捷伦阵列 (G4131F) 上杂交。
洗涤后,在整合每个阵列的低强度和高强度扫描的基础上,用安捷伦 G2565B 微阵列扫描仪扫描阵列,以获得更大的点荧光定量线性范围。
微阵列实验的数据分析
使用特征提取 9.5 (Agilent Technologies) 量化每个点的信号强度。提取实验样品 (Cy5) 和参考样品 (Cy3) 的每个点的中值密度值和背景值。使用来自 Bioconductor 的 R 中的 LimmaGUI 包和 Microsoft Excel对每个微阵列进行基于原始数据的质量检查。数据被导出到 GeneMaths XT 1.60(应用数学)进行分析。
在所有阵列中,我们丢弃了平均强度为 Cy5 < 2 倍于平均背景强度以上的点。然后,如前所述对 Cy5 强度进行归一化。显着改变的基因(学生t测试)对钙的反应被选择用于途径分析。
基因表达结果报告为钙喂养转基因大鼠与对照转基因大鼠相比的倍数变化。<1 的倍数变化被报告为它们的负数。P值仅用于根据最高显着性对数据进行优先级排序,以供进一步分析。使用 MetaCore (GeneGo) 和 ErmineJ 进行通路分析。
微阵列数据可在国家生物技术信息中心的基因表达综合库中公开访问,登录号为GSE11022。
粘膜样本的定量实时 PCR
使用 Bio-Rad 的 iScript cDNA 合成试剂盒将来自转基因和非转基因大鼠的单个样品的总 RNA (1 μ g) 用于 cDNA 合成。使用 MyIQ 实时 PCR 检测系统 (Bio-Rad) 进行实时反应,如前所述,使用 Beacon Designer 7.00 (Premier Biosoft International) 设计引物 (补充表 1)。
使用 GeNorm将数据标准化为 3 个参考基因的几何平均值:醛缩酶、ADP-核糖基化因子 1 和β-肌动蛋白。
由于基于阵列数据的钙干预,这些基因没有显示出调节。使用包含来自所有反应的 cDNA 的合并样本的连续稀释生成所有基因的标准曲线,以下例外:为了检测基质金属蛋白酶 (MMP),仅对照转基因大鼠的 cDNA 合并样本(其中 MMP 最多大量表达)被使用。从适当的标准曲线一式两份测定单个样品的mRNA水平并取平均值。mRNA 水平低于最低标准值并因此低于检测限的样品被给予该最低标准值的一半。
结果表示为控制的倍数变化。<1 的倍数变化被报告为它们的负数。
结肠黏膜样本的明胶酶谱
如前所述,进行明胶酶谱以量化 MMP2 和 9 的明胶酶活性。MMP10 和 13 在该酶谱上不可见,因为这些 MMP 是胶原酶。
此外,特别是 MMP9 在动物结肠炎研究中被认为是重要的。将结肠粘膜刮片加载到凝胶上(用样品缓冲液 1:1 稀释)。蛋白水解活性通过指示明胶溶解的透明区域显现。
使用 Sharp Jx-330 扫描仪和 Imagemaster ID 软件(Amersham Pharmacia)进行定量,酶活性表示为基于裂解面积的任意单位/mg 蛋白质。
统计分析
该研究能够检测到 MPO 水平存在 65% 的差异,假设 SD 为 40%。对于 90% 的功率和α5%,所需的样本量为每组 8 只大鼠。所有结果均表示为平均值±SEM。
我们预定义的主要兴趣比较是喂食对照饮食的 HLA-B27 大鼠与喂食钙饮食的 HLA-B27 大鼠。本研究中包括非转基因大鼠作为非结肠参考,以提供有关测量变量基线值的一些一般比较信息。
因此,将非转基因大鼠与转基因大鼠进行比较,每组被视为1组,以测试炎症的影响。将对照转基因大鼠与钙喂养的转基因大鼠进行比较,以测试膳食钙的影响。使用Student's t分析正态分布的数据检验,而非正态分布的数据通过 Mann-Whitney U 检验(所有 2 面)进行分析。正态性通过 Kolmogorov-Smirnov 检验进行检验。
除 MMP9、MMP10 和 MMP13 的组织学评分和定量实时 PCR (Q-PCR) 结果外,所有数据均呈正态分布。当P < 0.05时,差异被认为是显着的。使用 Graphpad 软件进行统计分析。
研究结果
大鼠、食物摄入和结肠的宏观评估
转基因大鼠的食物摄入在实验期间保持稳定(10.7 ± 0.2 g/d),并且在饮食组之间没有差异。饮食不影响转基因大鼠的体重增加 (1.0 ± 0.1 g/d)。
与非转基因大鼠相比,转基因大鼠体重增加较少(1.7 ± 0.1 g/d;P < 0.001),食物消耗量较低(11.8 ± 0.4 g/d;P < 0.05)。喂食对照饮食的转基因大鼠的结肠(13.7 ± 0.1 cm)比喂食钙补充饮食的小鼠短(14.4 ± 0.3 cm;P < 0.05)。
饮食干预不影响转基因大鼠的结肠重量(2.1 ± 0.03 g),尽管它远高于非转基因大鼠(1.0 ± 0.1 g;P < 0.0001),这是慢性肠道炎症的典型特征。
膳食钙对腹泻和肠道通透性的影响
腹泻是结肠炎的一个突出特征,可以通过测定相对粪便湿重来量化。从第 4 周开始,膳食钙保护转基因大鼠免受相对粪便湿重的增加(图 1;P < 0.01)。IBD 的另一个主要特征是肠道通透性增加。在实验的第一周内,钙喂养的 HLA-B27 大鼠的肠道通透性低于对照组饮食的转基因大鼠(图 2;P < 0.05)。
从第 5 周开始,对照转基因大鼠的肠道通透性与钙喂养 HLA-B27 大鼠的肠道通透性差异更大(P < 0.01),表明肠道炎症加重(图 2 ))。为了确定增加的肠道通透性是否确实影响进入体循环的腔内抗原量,我们测量了血清中针对 LPS 的抗体。
对照组的转基因大鼠(336±111 kAU/L)比补钙的HLA-B27大鼠的抗体效价从第0周到实验结束的增加更明显(P =0.09)(P=0.09)。 119 ± 39 kAU/L)。
这与使用肠道通透性标记 CrEDTA 获得的结果一致。这些变量是相关的(R 2 = 0.29;P = 0.03),但大鼠数量很少,因此我们谨慎解释这些结果。
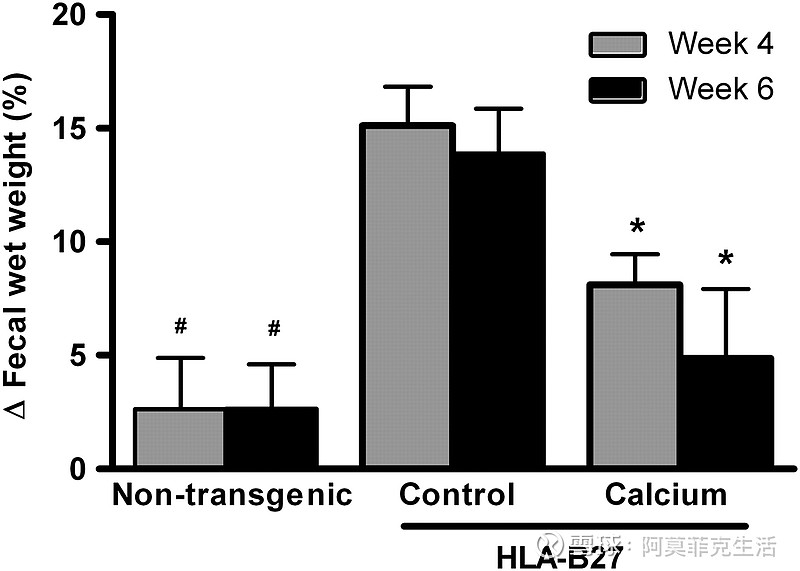
图1
Effect of dietary calcium on the change in relative fecal wet weight in wk 4 and 6 compared with wk 2 in HLA-B27 transgenic rats. Results are means ± SEM, n = 7–9. *Different from control transgenic rats, P < 0.01; #different from transgenic rats, P < 0.05.
与第 2 周相比,在 HLA-B27 转基因大鼠中,膳食钙对第 4 周和第 6 周相对粪便湿重变化的影响。结果是平均值±SEM,n = 7-9。*与对照转基因大鼠不同,P < 0.01;#与转基因大鼠不同,P < 0.05。
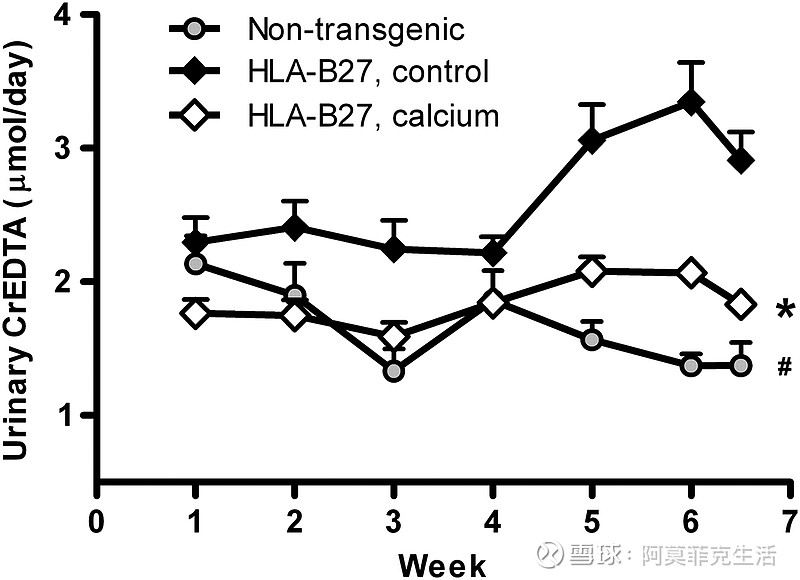
图 2
Effect of dietary calcium on urinary CrEDTA excretion, a marker for intestinal permeability, in HLA-B27 transgenic rats. Results are means ± SEM, n = 7–9. *Different from control transgenic rats at all time points, P < 0.05; #different from transgenic rats at wk 3, 5, 6, and 6.5, P < 0.05.
膳食钙对 HLA-B27 转基因大鼠尿 CrEDTA 排泄(肠道通透性标志物)的影响。结果是平均值±SEM,n = 7-9。*在所有时间点与对照转基因大鼠不同,P < 0.05;#在第 3、5、6 和 6.5 周时与转基因大鼠不同,P < 0.05。
膳食钙对黏膜炎症的影响
由于膳食钙对腹泻和肠道通透性产生有益影响,我们对伴随的肠道炎症是否也受到补充钙的影响感兴趣。肠道炎症通过组织学和测量结肠黏膜 MPO 和 IL-1 β蛋白水平来确定。喂食钙的转基因大鼠的组织学炎症评分往往低于喂食对照饮食的转基因大鼠(图 3;P = 0.08)。
尽管与非转基因大鼠相比,HLA-B27 大鼠的结肠黏膜 MPO 水平要高得多(1.4 ± 0.2 ng/mg 蛋白;P< 0.0001),饮食不影响转基因大鼠的 MPO 浓度(对照饮食,337.2 ± 21.8 ng/mg 蛋白质;钙饮食,298.3 ± 27.1 ng/mg 蛋白质)。
然而,与对照转基因大鼠相比,补钙转基因大鼠的IL-1 β水平较低(图 3;P < 0.05)。
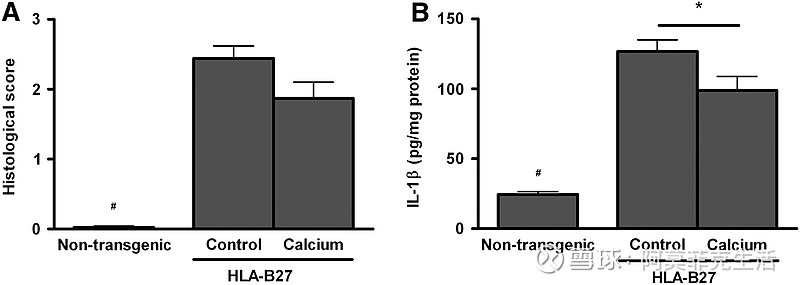
图 3
Effect of dietary calcium on inflammation in HLA-B27 transgenic rats. (A) Effect of calcium on histological score (0–4). (B) Effect of calcium on colonic mucosal IL-1β levels. Results are means ± SEM, n = 7–9. *Different from control transgenic rats, P < 0.05; #different from transgenic rats, P < 0.0001.
膳食钙对 HLA-B27 转基因大鼠炎症的影响。(一)钙对组织学评分的影响(0-4)。( B )钙对结肠黏膜IL- 1β水平的影响。结果是平均值±SEM,n = 7-9。*与对照转基因大鼠不同,P < 0.05;#与转基因大鼠不同,P < 0.0001。
膳食钙影响管腔细胞毒性
为了验证钙是否具有管腔细胞保护作用,我们测量了粪便水的细胞毒性。
从第 2 周收集的粪便制备的粪便水的细胞毒活性在喂食钙饮食的转基因大鼠中 (5.6 ± 1.9%) 显着低于喂食对照饮食的转基因大鼠 (21.5 ± 5.8%; P < 0.05)。
然而,这种影响在第 6 周并不显着(数据未显示)。由于钙也可能直接影响肠上皮,我们检查了由于钙补充引起的粪便水中钙浓度的差异。
事实上,钙喂养的 HLA-B27 大鼠第 2 周粪便水中的总钙浓度 (10.9 ± 0.8 mmol/L) 高于对照转基因大鼠 (5.5 ± 0.6 mmol/L; P< 0.0001)。第 6 周钙浓度的差异相似(数据未显示)。
然而,管腔细胞毒性和粪便水中的钙浓度不相关(R 2 = 0.17;P = 0.10)。
鉴定受膳食钙影响的结肠粘膜基因
在证明膳食钙影响结肠炎发展的一些主要特征后,我们希望更深入地了解发挥作用的机制。
为了以公正的方式实现这一目标,对个体转基因大鼠的结肠粘膜样本进行了全基因组微阵列分析。28,213 个点的信号强度大于背景值的 2 倍,这些点被包括在分析中。补钙改变了转基因大鼠结肠黏膜中709个转录本的表达(P < 0.01)。
随后将这组 709 个转录本用于通路分析。膳食钙明显调节一种生物过程:细胞外基质重塑 ( P < 10 -22; MetaCore 中该图谱中分类的 60 个基因中有 22 个基因受到调控,而排名第二的过程具有P < 10 -8 )。
因为并非所有基因都在通路程序中进行了注释,所以我们使用生物数据库将基因手动分类到过程中。为此,我们使用了被调节至少 1.3 倍对照且P值 < 0.05(212 个基因)的独特基因,并且我们仅在分类至少 3 个调节基因时指定过程(图 4)。
与细胞外基质重塑过程相关的差异调节基因见表2。与喂食对照饮食的 HLA-B27 大鼠相比,在这一过程中受影响的所有基因在喂钙的转基因大鼠中的表达水平始终较低,而这些基因的表达在 IBD 中通常增加。
212 个基因的其余部分显示在补充表 2。这一额外的分析强调,细胞外基质重塑是受钙补充最显着调节的过程,其次是参与免疫系统的基因。此外,钙在转基因大鼠中主要下调(或诱导较少的上调)这些基因。
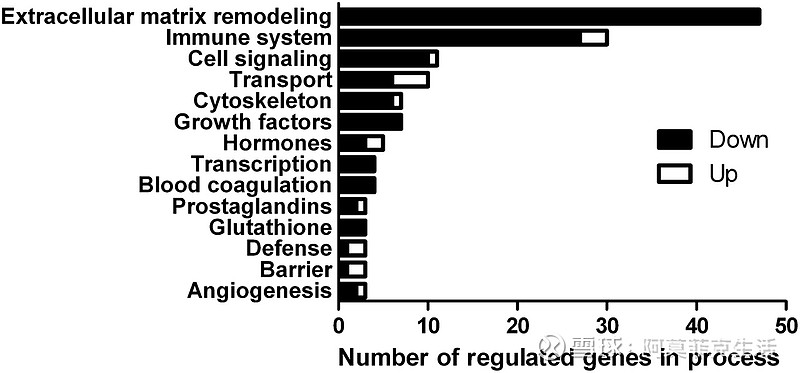
图 4
The number of regulated genes in colonic mucosa of transgenic HLA-B27 rats fed the calcium diet (n = 8) compared with control transgenic HLA-B27 rats (n = 9) classified in different processes. Genes included showed an absolute fold-change of at least 1.3 of control and a P-value < 0.05. Only processes with at least 3 regulated genes are mentioned.
与分类为不同过程的对照转基因 HLA-B27 大鼠 ( n = 9) 相比,喂食钙饮食的转基因 HLA-B27 大鼠 ( n = 8)结肠粘膜中调节基因的数量。包括的基因显示出至少 1.3 的对照的绝对倍数变化和P值 < 0.05。仅提及具有至少 3 个受调控基因的过程。
表 2
与 HLA-B27 转基因大鼠钙饮食反应的细胞外基质重塑相关的差异调节基因
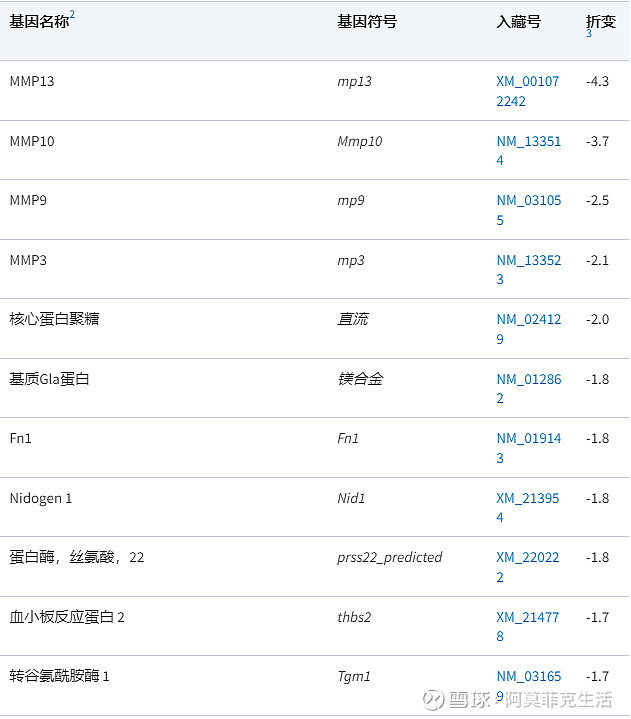
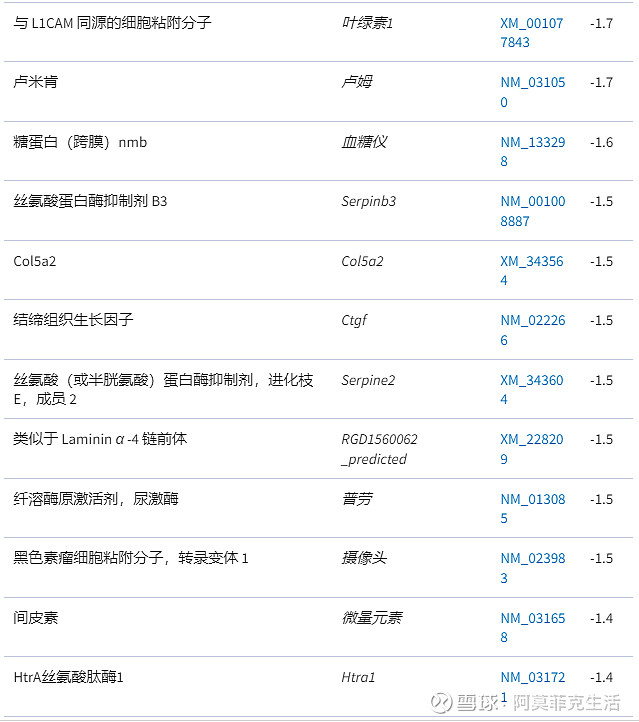
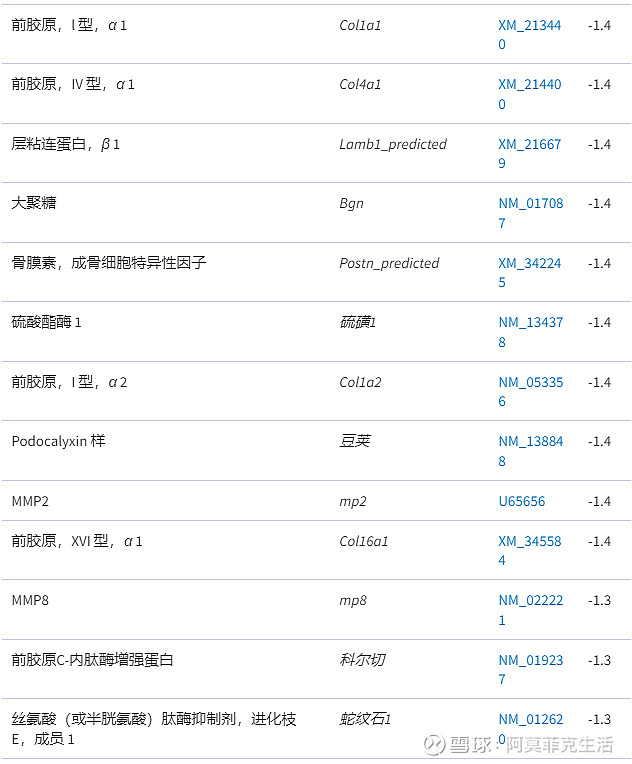
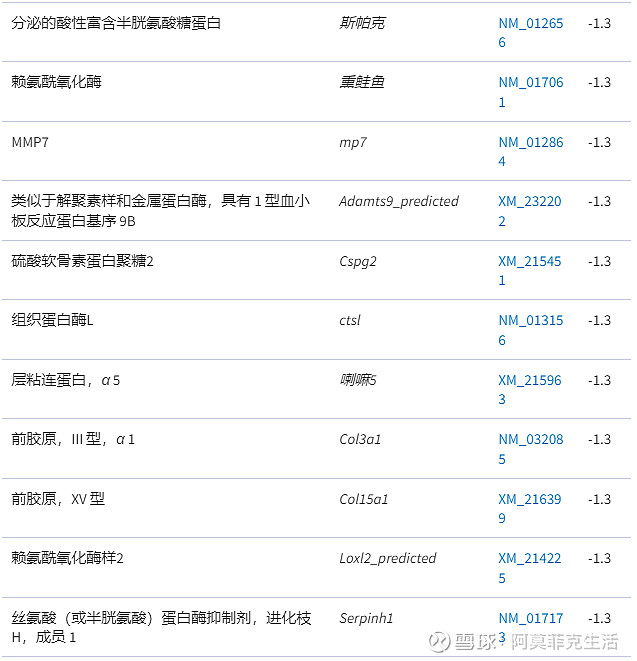
1.结果是与细胞外基质重塑相关的基因,与喂食对照饮食(n = 9)。
2.根据控制的绝对倍数变化对基因进行分类。
3.< 1 的倍数变化被报告为它们的负数。请注意,与 HLA-B27 大鼠的对照饮食相比,所有与细胞外基质重塑相关的基因都被钙饮食下调。
值得注意的是钙对一些重要的粘膜屏障基因的影响很小但很重要。膳食钙上调粘蛋白 MUC2(倍数变化 = 1.2;P = 0.002)、三叶因子 1(倍数变化 = 1.3;P = 0.009)和三叶因子 3(倍数变化 = 1.2;P = 0.011)。有趣的是,钙饮食略微下调了环氧合酶 2(ptgs2/cox2;倍数变化 = -1.3;P = 0.012)。
在转基因和非转基因大鼠中通过 Q-PCR 确认调节基因
为了确认微阵列数据,通过 Q-PCR 分析选定基因子集的 mRNA 表达。MMP9、MMP10、MMP13、前胶原 V α 2 (Col5a2) 和纤连蛋白 1 (Fn1) 被测量为细胞外基质重塑过程的重要代表。
所有基因的 Q-PCR 分析证实了微阵列数据 (补充图1);膳食钙降低 MMP9(倍数变化 = -3.4)、MMP10(倍数变化 = -5.4)、MMP13(倍数变化 = -6.1)、Col5a2(倍数变化 = -1.6)和 Fn1(倍数)的 mRNA 表达-变化 = -3.0)。
正如预期的那样,所有分析的 MMP、Col5a2 和 Fn1 的表达在非转基因大鼠的结肠粘膜中都很低。
膳食钙对黏膜 MMP 活性的影响
为了表明膳食钙对细胞外基质重塑的影响在蛋白质水平上也很明显,我们进行了定量明胶酶谱分析。
显然,结肠粘膜刮片含有不同分子量的活性明胶酶,即proMMP9、proMMP2和MMP2(图5A)。~80 kDa 的裂解带代表一些未鉴定的蛋白水解活性,它不是 MMP9 ( 24 )。
重要的是,与对照转基因大鼠相比,喂食钙饮食的转基因大鼠的 proMMP2 和 MMP2 活性较低(图 5B;P< 0.05),证实了蛋白质水平上的 MMP mRNA 结果。
与对照转基因大鼠(8.4±0.7 任意单位/mg 蛋白质)相比,喂食钙饮食(7.5 ± 0.7 任意单位/mg 蛋白质)的转基因大鼠的 ProMMP9 活性没有差异,表明 mRNA 数据并不总是反映在蛋白质水平上.
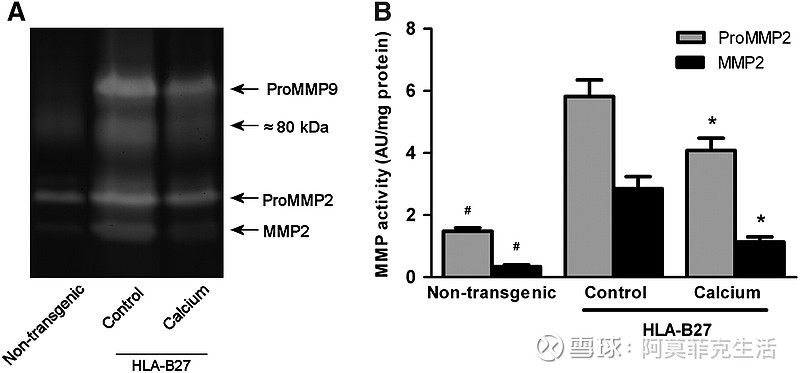
图 5
Effect of dietary calcium on MMP activity in colonic mucosa. (A) Example of MMP activity as analyzed by gelatin zymography. Representative samples are shown for nontransgenic rats (n = 7) and HLA-B27 transgenic rats fed the control diet (n = 9) and calcium diet (n = 8). (B) Effect of calcium on proMMP2 and MMP2 activity indicated in arbitrary unit (AU)/mg protein. Results are means ± SEM. *Different from control transgenic rats, P < 0.05; #different from transgenic rats, P < 0.005.
膳食钙对结肠黏膜 MMP 活性的影响。(一)通过明胶酶谱分析的 MMP 活性示例。显示了非转基因大鼠 ( n = 7) 和 HLA-B27 转基因大鼠喂食对照饮食 ( n = 9) 和钙饮食 ( n = 8)的代表性样本。( B ) 钙对 proMMP2 和 MMP2 活性的影响,以任意单位 (AU)/mg 蛋白质表示。结果是平均值±SEM。*与对照转基因大鼠不同,P < 0.05;#与转基因大鼠不同,P < 0.005。
研究讨论
本研究表明,膳食钙抑制 HLA-B27 转基因大鼠结肠炎严重程度的重要方面。膳食钙有效防止肠道通透性增加和减少腹泻,这都是 IBD 的众所周知的特征。
此外,补钙大鼠黏膜 IL-1 β水平较低,组织学炎症评分趋于降低,这与结肠黏膜细胞外基质分解减少相吻合。
钙对肠道通透性的有益作用特别有趣,因为增加的通透性被认为是人类 IBD 发展过程中首先发生的事件之一,并且在疾病复发之前 ( 28 – 30 )。
在这项研究中,喂食对照饮食的转基因大鼠的肠道通透性从第 5 周开始增加。
相反,喂食补钙饮食的转基因大鼠的肠道通透性保持稳定。由于肠道总是在一定程度上是可渗透的,因此与非转基因大鼠相比,由于其过度反应的免疫系统,转基因大鼠对(相同数量的)易位腔内抗原的反应要强烈得多,因此存在或不存在结肠炎。
虽然,我们不能从我们的研究中明确得出结论,肠道通透性的增加先于结肠炎症,但我们很容易推测膳食钙通过保持肠道屏障功能至少可以部分地防止炎症。
众所周知,肠道微生物群及其与过度反应的免疫系统的密切肠道接触是 IBD 慢性炎症的驱动力。
通过膳食钙改善肠道屏障功能,从而减少肠道细菌或细菌抗原的易位,可能是一种非常有吸引力和安全的补充干预措施,有待在 IBD 患者中进一步探索。
影响肠道通透性可能是保护作用的一部分,但钙对结肠炎严重程度的有益作用背后的分子机制尚不清楚。先前的研究表明,钙与小肠上部的磷酸盐形成不溶性复合物 。这种无定形磷酸钙与管腔胆汁酸和脂肪酸结合,从而限制了这些刺激性物质的溶解度,从而减少对脆弱的结肠上皮细胞的损伤。事实上,在本研究中,根据早期结果,钙降低了肠道内容物的细胞毒性。
为了更深入地了解膳食钙对黏膜完整性的影响,我们分析了总结肠黏膜基因的表达。应该认识到,在营养干预中基因表达变化通常很小。然而,通过将显着改变的基因的微小影响结合到共同的生物学途径中,可以识别生理相关的调节过程。
在这项研究中,许多参与细胞外基质重塑的基因在钙喂养的转基因大鼠中的上调一直较低,尤其是几种 MMP 和细胞外基质成分,如前胶原和纤连蛋白。
在生理条件下,MMP 被 MMP 的组织抑制剂抵消;然而,没有观察到饮食对这些抑制剂的基因表达有影响。
对结肠黏膜样品进行明胶酶谱学以量化特定类别 MMP 的实际活性,并表明与转基因对照大鼠相比,喂食钙饮食的转基因大鼠中的 MMP2 活性确实较低。越来越多的证据表明 MMP 与肠道炎症性疾病有关并导致组织损伤。IBD 患者的活检显示 MMP 水平升高 。
此外,与对照组相比,克罗恩病患者肠黏膜下层的胶原蛋白含量增加。然而,我们推测钙对细胞外基质重塑的影响不一定是炎症反应减弱的结果,而是膳食钙对肠道通透性有益影响的结果。降低肠道通透性可减少结肠粘膜对腔内抗原的暴露,可能导致炎症减少和细胞外基质重塑相一致。
由于钙导致的管腔细胞毒性降低,肠道通透性是否仍然很低尚不清楚,将进一步研究。由于结肠黏膜钙浓度不同,钙对黏膜过程的直接影响预计不会发生,因为钙的吸收受到非常严格的调节,主要发生在近端小肠。
此外,全身(血清)钙浓度非常稳定,不受膳食钙补充剂的影响。另一方面,由于我们的饮食干预而观察到的管腔钙浓度差异可能更直接地影响肠道屏障功能。显然,作为肠道通透性主要调节剂的紧密连接蛋白的变化是预期的。尽管钙不会引起紧密连接蛋白(例如密闭蛋白、封闭蛋白、封闭带和肌球蛋白 IXb)基因表达的变化,但紧密连接的形态和结构改变可能存在。例如,细胞质内化和紧密连接蛋白的磷酸化被认为对粘膜屏障的渗漏很重要。
在细胞研究中,细胞外(管腔)钙对于维持肠道紧密连接功能至关重要。然而,这些影响似乎发生在高达 0.1 mmol/L的游离钙浓度下,这远低于我们研究中观察到的管腔钙水平。另一种将进一步探索的可能性是钙影响粘液层的粘度,从而改变肠道通透性。
有趣的是,与对照转基因大鼠相比,钙喂养大鼠的 IL-1 β水平较低,组织学结肠炎评分往往较低,而黏膜 MPO 水平在各组之间没有差异。
这可以通过以下事实来解释:浸润在 HLA-B27 转基因大鼠粘膜中的炎症细胞主要由单核细胞和嗜酸性粒细胞组成,其中 MPO 不像中性粒细胞那样大量存在。虽然 MPO 通常被认为是量化炎症的黄金标准,但在这个大鼠模型中,黏膜 MPO 的测量可能不太准确,并且低估了钙的抗炎作用。
据我们所知,2 项研究报告了膳食钙对肠道炎症的可能保护作用。朱等人。发现IL-10基因敲除小鼠对肠道炎症有改善作用,但本研究主要集中在维生素D在IBD中的作用。Pele 等人最近的工作。
表明膳食钙可预防小鼠中葡聚糖硫酸钠 (DSS) 诱导的结肠炎,但应谨慎解释这些结果,因为 DSS 是由钙沉淀的(制造商的信息)。他们试图通过对巨噬细胞进行相当间接的分析来解决这个问题,而上皮细胞的腔暴露于 DSS 不包括在该测定中。
钙对口服 DSS 的肠道沉淀会导致小鼠暴露于结肠炎诱导剂的不良差异。HLA-B27 转基因大鼠模型的一个主要优点是其独立于化学诱导,从而排除了营养或药理学干预与诱导结肠炎所需的化学物质之间的直接相互作用。
为了模拟人类西式饮食的组成并促进对人类情况的推断,与标准啮齿动物饮食相比,我们的大鼠饮食具有相对较高的脂肪含量。
因为吸收了如此少量的补充钙摄入(通常<10%),重新计算每公斤体重的钙剂量和表达几乎没有相关性。因此,假设人类每日干粮摄入量约为 500 g,则对照饮食中的钙含量(30 mmol 或 1.2 g/kg 干粮)相当于人类每日钙摄入量 600 mg。
一般来说,西方国家的人类膳食钙摄入量范围为 600-1100 毫克/天。
因此,对照饮食与人体摄入范围的下限相匹配,而补钙饮食(相当于 2.4 g/d)提供的钙摄入量超过了一般习惯性饮食中的钙摄入量。然而,在使用钙补充剂时,这并不是不切实际的摄入量。
总之,本研究表明膳食钙抑制 HLA-B27 转基因大鼠结肠炎严重程度的重要方面。需要并计划进行临床试验以确定补充钙是否对 IBD 患者具有类似的有益作用。
本研究的结果表明:营养在调节肠道黏膜完整性方面的作用。与药物相比,营养干预没有不良副作用是一个主要优势。
我们意识到营养不能代替药物;然而,它可能作为辅助治疗策略有用。此外,膳食钙的保护作用不仅限于炎症性肠病。如上所述,补充钙可防止肠道感染和结肠癌发生。
原文链接:网页链接