靶向RNA
核酸是所有生物体遗传信息的载体,涵盖脱氧核糖核酸(DNA)和核糖核酸(RNA)两大类,基因是一段有遗传效应的DNA,记载着蛋白质上的氨基酸排列顺序,需要通过RNA的转录(mRNA)和tRNA的翻译在细胞质中产生蛋白质。
与现在药物市场中主流的小分子药物和抗体药物运行机制不同,RNA疗法背后的运行机制是通过抑制相关疾病的基因表达,在转录层面上以沉默或补偿缺陷和异常基因实现对疾病的治疗。RNA疗法除了能够绕开在靶蛋白层面上,目前阻碍小分子药物和抗体药物成药的蛋白限制外,与靶向DNA层面的基因治疗相比,靶向RNA层面的疗法不会在基因层面上造成永久的潜在未知影响,故在预防感染性疾病、遗传疾病、癌症等领域具有重大的潜力。
RNA疗法主要分为mRNA疗法和寡核苷酸药物(小核酸)两大类,其中mRNA疗法可分为mRNA疫苗和mRNA药物,小核酸药物主要包括反义核酸(ASO)、小干扰核酸(siRNA)、Micro RNA(miRNA)和核酸适配体等等。
图表 1:近十年RNA疗法新开临床试验
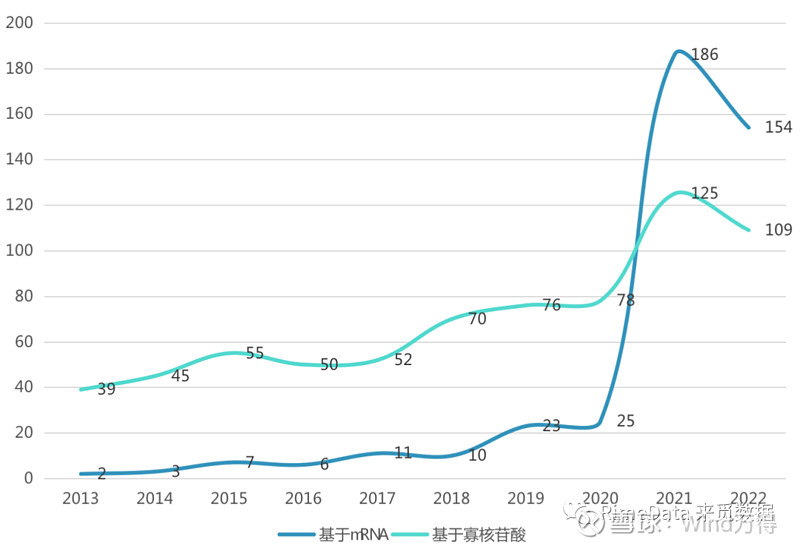
来源:Beacon,来觅数据整理
据Beacon的数据显示,自新冠大流行开始以来,全球RNA疗法迎来了井喷式的发展,2021年基于mRNA技术的新开临床管线达到186个,基于寡核苷酸的新开临床管线达125个,皆同比2020年大幅增长。从适应症来看,目前在研的RNA治疗主要针对感染性疾病、肿瘤等,其中感染性疾病占比最高,主要是由于2020年开始新冠大流行使以新冠感染为适应症的药物研究大量上升。
图表 2:RNA疗法适应症分布
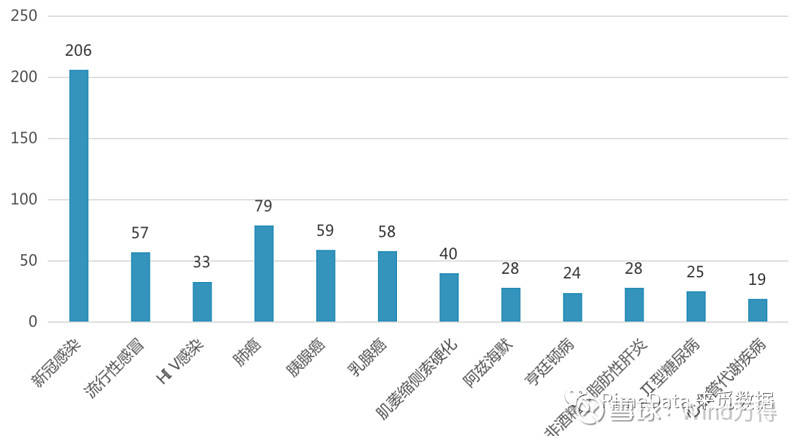
来源:Beacon,来觅数据整理
作为RNA疗法下的另一研发重点,与主要依赖于基因切割与沉默为机制的寡核苷酸相比,mRNA疗法是通过向体内注入合成性的、能诱导正常蛋白质表达,补偿有缺陷的基因/蛋白质的疗法,mRNA疗法可分为预防性的mRNA疫苗和治疗性的mRNA药物。
2019年底COVID-19的爆发对世界的运行造成了巨大的冲击,随后辉瑞(Pfizer)-BioNtech和莫德纳(Moderna) 基于mRNA技术针对SARS-CoV-2病毒的疫苗研制在2021年斩获了惊人的581亿美元全球销售额同时,一举向各大市场参与者展示了mRNA技术的广阔商业化前景。
有别于传统疫苗通过失活抗原诱发人体免疫反应的运作机制,编码抗原序列的 mRNA 疫苗通过脂质纳米载体等递送平台引入细胞,然后体内细胞(如树突状细胞等)翻译以产生抗原并激活免疫反应,如新冠mRNA疫苗针对的SARS-CoV-2编码的冠状蛋白,能使人体的免疫系统提前制备对应的抗体以及对T细胞的激活,从而使预热过的T细胞能在真正面临感染时快速识别并杀伤受病毒感染的细胞。通过内源性表达抗原蛋白,mRNA 疫苗可以诱导更广泛和有效的细胞和体液免疫反应,从而比传统疫苗具有更高的保护率。
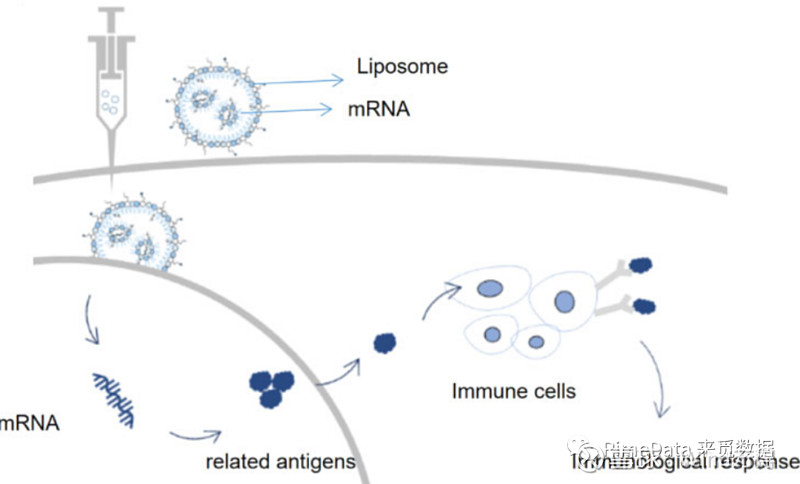
来源:《How far are the new wave of mRNA drugs from us? mRNA product current perspective and future development》
除了在防治感染领域的应用外,业界对于mRNA技术在其他病症中的应用寄予了厚望,其中癌症领域是Moderna、BioNtech等Biotech新贵发展的重点方向之一。从相关研发布局来看,目前业界对于mRNA技术在癌症中的布局有治疗性的癌症疫苗,以及可以增强抗原递呈、增强T细胞活性的mRNA编码的免疫增强剂(Immunostimulants)等。
免疫增强剂通常是通过mRNA技术编码的细胞因子或趋化因子,可诱导 APC的成熟和激活,同时激活T细胞介导的免疫反应并调节功能失调的免疫肿瘤微环境。以Moderna正在研发中的mRNA-2416为例,其编码的OX40配体 (OX40L)是一种共刺激膜结合蛋白,可增强T细胞的扩增、功能和存活,从而增强T细胞对癌细胞的免疫反应。
治疗性的mRAN肿瘤疫苗背后的机制是将编码一个或多个肿瘤特异性抗原(TSA)/肿瘤相关抗原(TAA)递送到宿主细胞(如树突状等APC)的细胞质中,从而使这些TSA/TAA可以通过组织相容性复合体(MHCs)递呈到APC表面,激活B细胞介导的体液免疫和T细胞介导的细胞免疫。由于不同肿瘤类型中仅确定了有限的TAA,肿瘤细胞存在高度逃逸性且TAA在正常细胞中也会表达等因素,近年来研发的新方向在TSA上,即研发靶向肿瘤抗原(Neoantigens)的高度个性化mRNA癌症疫苗。在此方向上,2023年4月16日消息显示,Moderna和美国默克公司联合研发的个性化癌症疫苗mRNA-4517联用PD-1单抗Keytruda,在最新发布的试验结果中,将黑色素瘤患者复发或死亡的风险降低了 44%,结果显示157个受试者的79%在18个月后无复发,标志着个性化mRNA肿瘤疫苗的巨大潜力。
图表 3:部分Moderna和BioNtech的mRNA管线
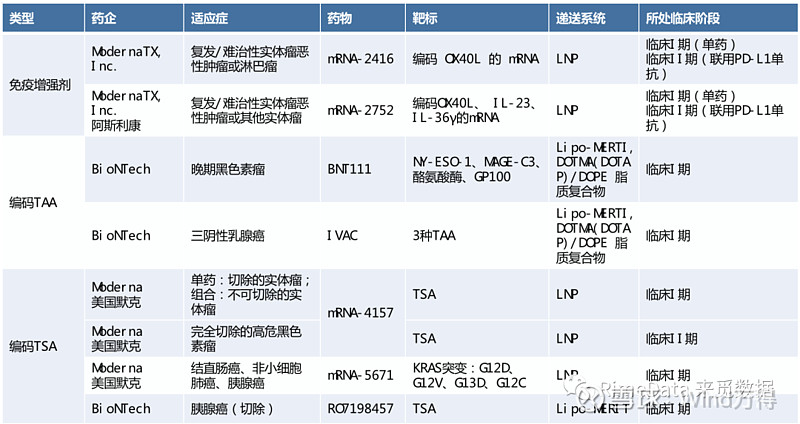
来源:《mRNA vaccine for cancer immunotherapy》,来觅数据整理
递送系统
mRNA疗法理论来说可以通过表达出任意一种蛋白来治愈和预防多种疾病,且关于在体内成功使用合成 mRNA 的第一份报告最早就发表于 1990 年代初期,但由于裸露的mRNA容易被核糖核酸酶降解,为了在体内发挥作用,mRNA 需要安全、有效和稳定的递送系统,以保护核酸免于降解并允许细胞摄取和释放mRNA。
mRNA在体内的低稳定性、低翻译效率、免疫原性问题和体内递送效率低下一直是该技术发展的拦路石,故针对mRNA的化学修饰和递送系统设计尤为重要。在化学修饰层面,研究发现针对5端的修饰以及针对非翻译区域(UTR)的优化、针对3端的Poly (a) 尾的修饰等等可以提升mRNA稳定性和翻译效率,如通过优化5端UTR序列以最小化可能损害核糖体募集或转运的二级结构、在3端UTR中添加稳定作用元件、优化3端的Poly (a) 尾的长度等等。
在递送层面,针对2019年爆发的COVID-19疫情的mRNA疫苗的成功临床转化使含有可电离脂质的LNP作为最具临床可转化性的非病毒递送载体。mRNA分子通过与脂质的静电相互作用被封装在内部核心中,这种结构保护mRNA分子免受核酸酶降解,并增加纳米颗粒的稳定性。一旦LNP-mRNA 制剂到达靶细胞,脂质纳米颗粒可以通过胞饮作用等多种机制内化,同时由于带正电荷的脂质可能由于静电相互作用与带负电荷的内体膜融合,导致仅只有mRNA 分子会被泄漏进细胞质中,达到对mRNA药物的释放
与COVID-19的抗争加速了mRNA技术的发展,证明了mRNA 是一种功能强大且用途广泛的技术,它在临床转化方面的成功发展将显着增强人类抗击多种疾病的能力。作为目前创新疗法中的大热赛道之一,RNA疗法下mRNA在中国一级市场上的热度也在逐步上升。据来觅数据不完全统计,2022年全国在RNA药物领域合计发生融资事件31起,其中14起融资事件与mRNA疗法有关。
图表 4:2022年中国mRNA领域融资事件
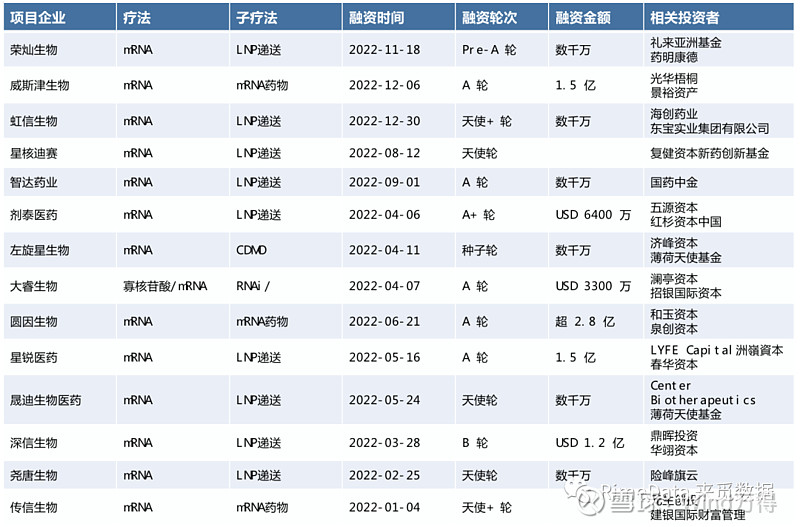
来源:来觅数据整理
参考资料:
1.《How far are the new wave of mRNA drugs from us? mRNA product current perspective and future development》, 2022, Frontiers in Inmmunology
2.《mRNA vaccine for cancer immunotherapy》, 2021, BMC
3.《The Limitless Future of RNA Therapeutics》, 2021, Frontiers in Bioengineering and Biotechnology