两款口服小分子新冠病毒治疗药物同日获批上市。
1月29日,国家药品监督管理局官网显示,按照药品特别审批程序,附条件批准先声药业1类创新药先诺特韦片/利托那韦片组合包装(商品名称:先诺欣)、旺实生物1类创新药氢溴酸氘瑞米德韦片(商品名称:民得维)上市。

上述两款药物均用于治疗轻中度新冠病毒感染的成年患者。国家药监局要求上市许可持有人继续开展相关研究工作,限期完成附条件的要求,及时提交后续研究结果。
截至目前,我国已有五款口服小分子新冠病毒治疗药物获批上市,分别是辉瑞的Paxlovid、默沙东的莫诺拉韦、真实生物的阿兹夫定、先诺欣和民得维。
先诺欣是一款口服小分子抗新冠病毒创新药,其中先诺特韦针对SARS-CoV-2病毒复制必须的3CL蛋白酶,与低剂量利托那韦联用有助于减缓先诺特韦在体内的代谢或分解,提高抗病毒效果。
2021年11月17日,港股公司先声药业与中国科学院上海药物研究所、武汉病毒研究所订立技术转让合同,获得先诺特韦(SIM0417)在全球开发、生产及商业化的独家权利。
先声药业介绍,先诺欣III期注册临床研究是迄今覆盖最广泛感染新冠奥密克戎毒株的中国患者人群下,第一个进入III期注册性临床试验并完成全部计划入组病例数的注册临床。该研究也是按照国际标准设计,全球首个达成以11种症状持续恢复为主要终点的III期注册临床研究。

研究纳入有症状的轻中度新型冠状病毒感染(COVID-19)患者、年龄≥18岁、SARS-CoV-2首次感染≤5天且COVID-19症状发作≤3天的受试者。主要终点为从首次给药至11种目标COVID-19症状首次持续恢复(症状评分均为0且持续2天)的时间,次要终点包括病毒学指标等。
11种目标COVID-19症状包括:咳嗽、鼻塞或流涕、咽痛或咽干、呼吸短促或呼吸困难、头痛、感觉发热或发热等。
在临床疗效方面,先声药业称,先诺欣组病毒载量呈现快速、大幅的下降;用药后第5天,病毒载量对比安慰剂最大下降超96%。先诺欣组核酸转阴时间较安慰剂组缩短约2.2天。
“推荐剂量为先诺特韦0.750g(0.375gx2片)联用利托那韦0.1g(0.1gx1片),每12小时一次口服给药,连续服用5天。”先声药业表示,作为首款具有自主知识产权的国产3CL抗新冠创新药,先诺欣的成功上市,有望为中国患者带来更有效的治疗选择。
安信证券1月2日研报曾预计,今年H1将迎来多个国产新冠药上市。目前,众生药业RAY1216、前沿生物FB2001、广生堂GST-HG171、开拓药业普克鲁胺均处于3期临床阶段。
从临床数据上看,截至目前,辉瑞Paxlovid仍被看作是最有效的小分子口服药物,而辉瑞医保国谈的失败无疑让国产药得到了发展的绝佳机会。
作为国内获批的第一款国产新冠药,阿兹夫定势必有自身的优势。
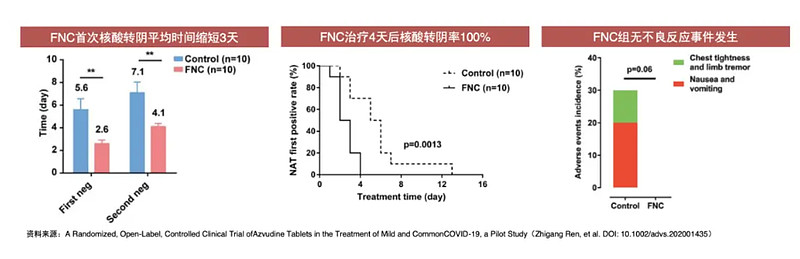
根据真实生物此前披露的临床数据显示,首次给药后第7天临床症状改善的受试者比例阿兹夫定组40.43%,安慰剂组10.87%;病毒清除时间为5天左右。
安全性方面,总体耐受性良好,不良事件发生率阿兹夫定组与安慰剂组无统计学差异。
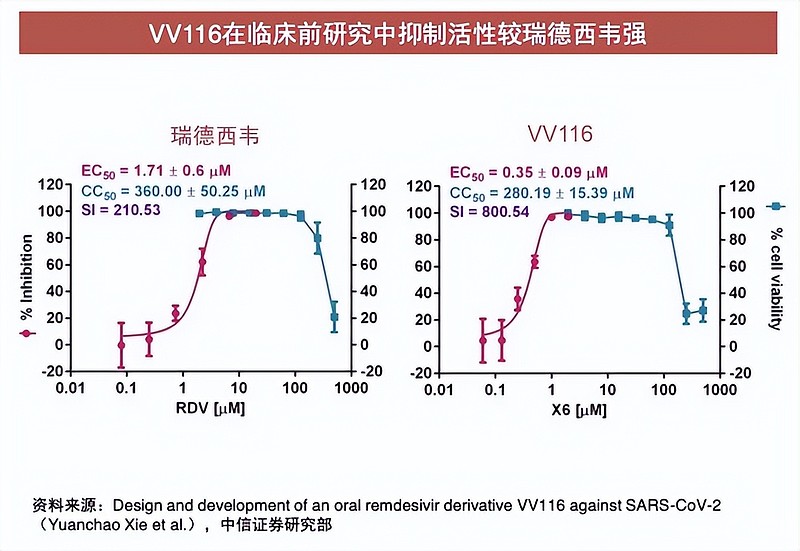
资料显示,君实生物的VV116是全球第3款口服新冠小分子药物。中信证券去年4月16日研报表示,其是全球首款新冠药瑞德西韦的衍生物,临床数据显示,瑞德西韦能够将新冠患者的住院或死亡风险降低87%,VV116作为升级版瑞德西韦,临床效果非常值得期待。
广生堂于1月10日公告披露新冠口服药泰中定(泰阿特韦GST-HG171片/利托那韦片)的IIT研究数据,显示在缩短新冠患者核酸转阴时间上明显优于阳性对照Paxlovid和安慰剂对照,泰中定(试验组)中位转阴时间为8.4天,Paxlovid(阳性对照组)中位转阴时间为9.5天,安慰剂组中位转阴时间为10.3天。
众生药业RAY1216为同是3CL靶点的国产新冠药,1月2日公司公告III期临床研究完成全部病例数入组。
此前研究显示,公告显示,RAY1216在野生株、阿尔法、贝塔、德尔塔、奥密克戎等多种新冠病毒感染的细胞模型中,可以有效抑制新冠病毒复制,展现了广谱抗新冠病毒的能力。
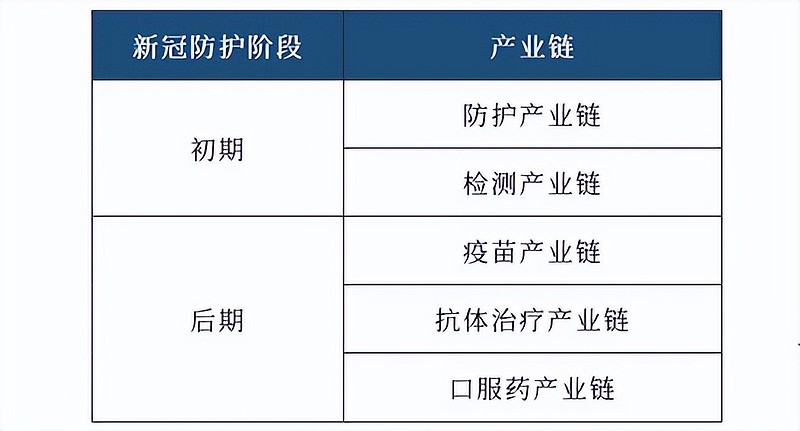
中航证券沈文文在近日研报表示,当前防疫重心从防控感染转到医疗救治,除对大多数人群进行对症治疗外,对于高风险人群,如何降低重症、死亡风险成为重中之重。
上市的新冠小分子口服药在降低重症率、死亡率方面具有确定证据,在大规模感染的背景下仍是未来产业链投资机会中的重要一环。