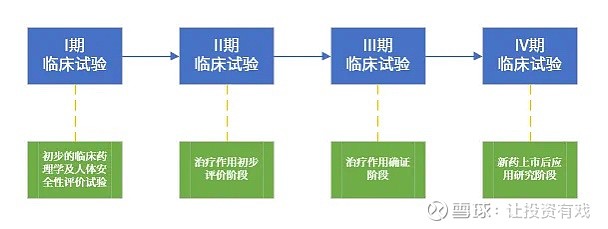
$中源协和(SH600645)$ 药物临床试验的分期
药物从研发到临床应用需要经历一个漫长的过程。一般而言,一款新药的研发流程包括探索阶段—药学研究阶段—临床前生物研究阶段—临床研究阶段,然后才能审批上市。药物临床试验就是临床研究阶段和药物上市后的再评价阶段,它是指任何在人体(病人或健康志愿者)进行的药物系统性研究,以证实或发现试验药物的临床、药理和/或其他药效学方面的作用、不良反应和/或吸收、分布、代谢及排泄,目的是确定试验药物的安全性和有效性。I期临床试验:该期也被称为临床药理和毒性作用试验期。试验通常在健康志愿者中实施,试验的目的是确定新药的最大耐受量,获得新药的药代动力学资料以及不良反应等。一般所需的健康志愿者为20-30人。
II期临床试验:该期也称临床治疗效果的初步探索阶段。本期试验在选定的适应症患者中进行,受试者经过严格的筛选,符合相关入选条件及标准后方能进入试验,也就是说在特定的人群中确定药物的有效性,进而确定有效性终点指标和安全性资料。同时为III期临床试验做准备,以确定初步的临床适应症和治疗方案。此期一般观察的病例数为100人以上。
III期临床试验:该期也称治疗的全面评价临床试验。该期一般会采取随机、双盲、对照的试验原则,在较大样本中确定药物的安全性和有效性。此期试验必须有严格的入选标准,合格后方可进入临床治疗,还必须有明确的有效性终点指标和安全性评价标准,同时经过严格的对比试验,全面评价新药的疗效和安全性。所以这期是决定新药能否批准生产上市的关键,参加本期的人数一般不少于300人,有的也会更多。
IV期临床试验:该期临床试验也称为销售后的临床监测期。也就是在新药批准上市后用更大数量的人群进行安全性观察。一般会采用开放、不设对照组的试验方案进行,最主要观察药物的疗效和不良反应等。如果此期发现疗效不理想、不良反应发生率高且严重,新药即使已经上市也仍然会被淘汰。此期观察的例数一般在2000例以上。