IPO企业暂缓!三年前被否也出现同一个问题!19岁成为IPO企业实控人及控股股东缺近11年未参与发行人业务经营?
1、(1)请发行人代表说明发行人1999年设立时,黄凯表兄马立勋代黄凯持有发行人控股权的具体原因及其合理性,黄凯是否存在当时不适合担任发行人股东的情形;黄凯自发行人设立至2010年期间长期未在发行人处任职且未参与发行人业务经营,而认定黄凯为发行人实际控制人的合理性。
有限公司的设立情况
发行人前身系南海市百合医疗科技有限公司(后更名为广东百合医疗有限责任公司)。1999 年 8 月 23 日,自然人马立勋、吴敏、李明、黄伟洪、荆文普签署了《南海市百合医疗科技有限公司章程》,章程约定南海百合注册资本为人民币 50.00 万元。其中,马立勋以货币出资 25.50 万元,吴敏以货币出资 9.50 万元,李明、黄伟洪、荆文普分别以货币出资 5.00 万元。
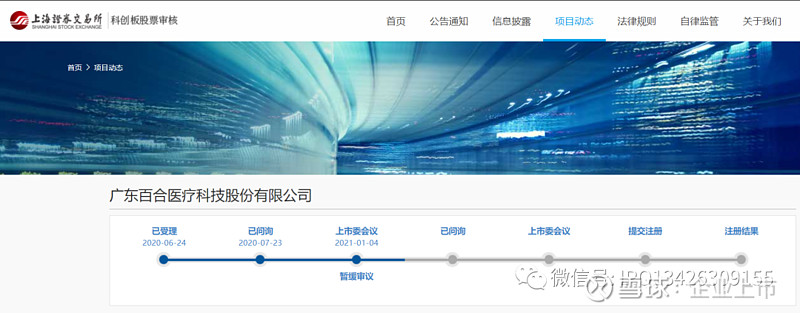
科创板上市委 2021 年第 1 次审议会议
结果公告
上海证券交易所科创板上市委员会2021 年第 1 次审议会议于 2021 年 1 月 4 日上午召开,现将会议审议情况公告如下:
一、审议结果
(一)浙江海盐力源环保科技股份有限公司(首发):符合发行条件、上市条件和信息披露要求。
(二)广东百合医疗科技股份有限公司(首发):暂缓审议。
二、上市委现场问询问题
(二)广东百合医疗科技股份有限公司
1.请发行人代表以定量的形式进一步说明发行人主营产品在各级带量采购过程中目前受到的影响和未来的潜在影响。请保荐代表人发表明确意见。
2.请发行人代表说明发行人设立及历次增资中马立勋代黄凯投入资金来源是否合法合规,马立勋代黄凯持有股份的真实性、合理性。请保荐代表人发表明确意见。
三、需进一步落实事项
(二)广东百合医疗科技股份有限公司
请发行人结合发行人前身百合有限设立和第一次增资相关资金全部由黄凯母亲戴伟健提供、黄凯与马立勋之间不存在有关百合有限的股权代持文件等事实,进一步说明马立勋系代黄凯持有百合有限股权的真实性和合理性。请保荐人、发行人律师发表明确核查意见。
科创板上市委员会
2021 年 1 月 4 日
创业板发审委2017年第4次会议审核结果公告
中国证券监督管理委员会创业板发行审核委员会2017年第4次发审委会议于2017年1月13日召开,现将会议审核情况公告如下:
一、审核结果
广东百合医疗科技股份有限公司(首发)未通过。
二、发审委会议提出询问的主要问题
广东百合医疗科技股份有限公司
1、(1)请发行人代表说明发行人1999年设立时,黄凯表兄马立勋代黄凯持有发行人控股权的具体原因及其合理性,黄凯是否存在当时不适合担任发行人股东的情形;黄凯自发行人设立至2010年期间长期未在发行人处任职且未参与发行人业务经营,而认定黄凯为发行人实际控制人的合理性。(2)请发行人代表说明黄凯向发行人的累积出资(包括历次出资、增资及股权受让)的资金以及向发行人提供借款的资金(以下简称“上述资金”)的具体来源是否合法合规。(3)反馈意见显示,黄凯上述资金大部分来自于华晨经贸、益安贸易、宏路贸易三企业。请发行人代表说明三企业2013年-2015年实现的营业收入及净利润很低,而此前累计实现的营业收入及利润总额很高的具体原因及其合理性、真实性,华晨经贸、益安贸易的盈利水平较好而停止营业准备注销的具体原因及其合理性、真实性,宏路贸易的收入水平及盈利水平大幅下滑的具体原因及其合理性、真实性;请发行人代表结合上述情况,说明黄凯上述资金大部分来自于三企业的真实合法性。请保荐代表人说明对上述问题的核查过程并发表核查意见。
2、发行人报告期长期待摊费用截至2016年6月30日为3,363.32万元,其中各类厂房改造支出、车间装修费等合计1,786.29万元。请发行人代表进一步说明:(1)该等支出的性质;(2)摊销年限及其确定依据;(3)归集和列报是否符合《企业会计准则》的规定。请保荐代表人发表核查意见。
发行监管部
2017年1月13日
IPO企业在飞行检查中被发现存在1项严重缺陷!13项一般缺陷,1 项严重缺陷
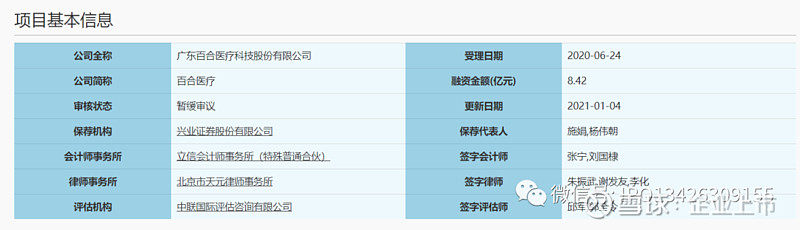
中文名称:广东百合医疗科技股份有限公司
有限公司成立日期:1999 年 11 月 1 日
股份公司成立日期:2013 年 12 月 23 日
注册资本:9,000.00 万元
法定代表人:黄凯
注册地址及主要生产经营地址:佛山市南海区桃园东路 89号
控股股东及实际控制人:黄凯
行业分类:专用设备制造业(C35)
发行人是一家致力于创新医疗器械的研发和产业化应用的高新技术企业,主营业务为输液管理、血液净化和护创敷料等领域的一次性医疗器械的研发、生产和销售,主要产品涵盖了静脉留置针、中心静脉导管、无针输液接头、血液透析导管、血液灌流器及海藻酸盐敷料等 70 余种品类,可广泛应用于手术室、急诊科、ICU 病房、肾科、血管外科、肝内科等科室,满足各级医疗机构的临床应用需求。
截至 2020 年 9 月 30 日,公司已获得授权专利268 项,其中发明专利 48 项。
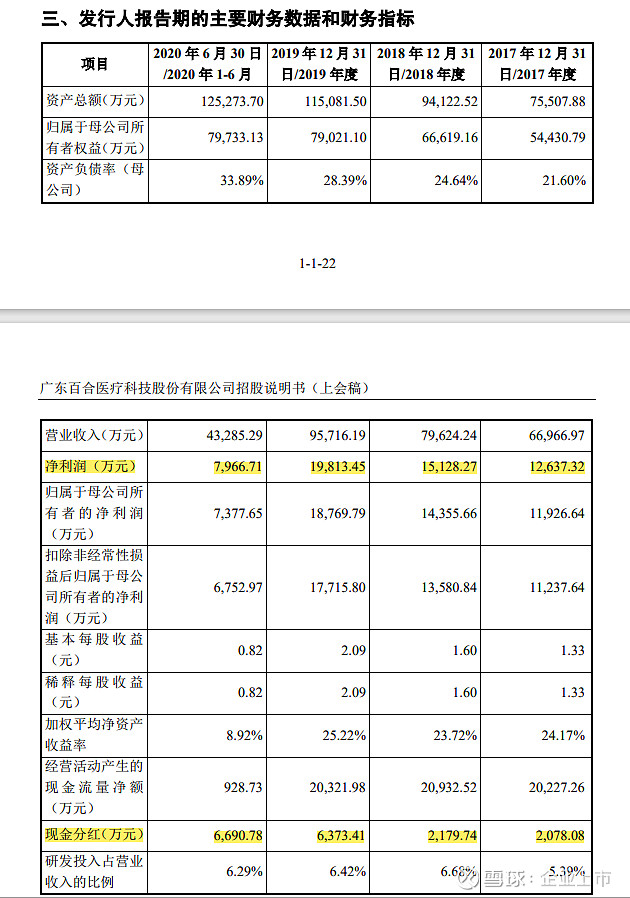
2017 年至 2020 年 6 月,发行人实现的营业收入分别为 66,966.97 万元、79,624.24万元、95,716.19 万元和 43,285.29 万元;实现的归属于母公司所有者的净利润分别为 11,926.64 万元、14,355.66 万元、18,769.79 万元和 7,377.65 万元,具备较强的产业化能力。
血液灌流器产品召回事项
2018 年 8 月,贵州省药品监督管理局对发行人子公司博新生物销售的血液灌流器产品进行监督抽验,结果显示公司血液灌流器的血室容量指标不符合企业制定的标准。博新生物的企业标准对各规格产品的血室容量规定了上、下限,与行业标准相比,范围较小且严格。本次抽验的结果虽然不符合企业制定的标称值,但符合行业标准规定的基本参数(小于 200mL 的指标)。同时,血室容量属于物理性能,不会影响产品的安全性和有效性。博新生物已对相关事项进行整改,相关事项未导致质量事故。
依照《医疗器械召回管理办法》的规定,博新生物开展对监督抽验不合格的同批次产品的召回工作,涉及产品共计 2,989 支,已办理退货 352 支,封存1,838 支,拟召回 799 支。其中,退货和封存产品的销售价值为 69.31 万元,存货价值 18.81 万元,公司已冲减当期营业收入并全额计提跌价准备;拟召回的产品已全部用于临床治疗,依据临床使用单位的回复,相关产品安全、有效,无不良反应。
该产品召回事件影响了公司血液灌流器产品的销售。2019 年度,公司血液灌流器产品销售收入较上年度下降 3,886.21 万元,降幅为 46.91%;2020 年 1-6月,公司血液灌流器产品实现销售收入 1,707.03 万元,同比保持平稳。同时,基于市场销售的预期,2019 年末,公司针对血液灌流器相关原材料树脂、半成品树脂及血液灌流器成品计提了充分的跌价准备,共计 1,501.58 万元。
虽然上述产品召回事件对发行人产品的安全性、有效性不存在实质性影响,相关事项未导致质量事故,但本次召回事件导致血液灌流器产品收入下降和库存跌价损失,对发行人经营业绩产生了一定的不利影响。
报告期内,公司经销模式收入分别为66,412.23万元、79,014.67万元、94,737.67万元和42,533.29万元,占主营业务收入比例分别为99.57%、99.68%、99.66%和99.13%。
2020 年 1-6 月,随着境内新冠肺炎疫情逐步得到控制,公司生产经营已恢复正常,实现的营业收入为43,285.29 万元,较上年同期略有增加;实现净利润7,966.71 万元,较上年同期减少 913.03 万元,降幅为 10.28%,主要系毛利率下降 4.22%,使得营业毛利减少 1,548.26 万元所致。毛利率下降原因有:(1)受带量采购、境内疫情等因素影响,公司部分产品的销售价格有所下降;(2)因疫情影响,公司上半年度产量有所减少,产能利用率下降,致使单位成本有所上升。
报告期各期末,公司存货余额分别为8,369.00万元、11,951.61万元、19,456.25万元和21,405.01万元,增幅较快,具体情况如下:
2019年末,公司存货余额较上年末增加7,504.64万元,主要系:1)受产品召回事件影响,公司血液灌流器销售未达预期,导致期末血液灌流器相关的半成品、产成品余额增加2,181.75万元;2)受限于产能不足,公司于2018年末血液回路、留置针、中心静脉导管等主要产品出现供不应求的现象,为了避免库存短缺现象,公司2019年末主动增加了库存备货量,导致期末库存余额较上年末增加较多。
2020年6月末,公司存货余额较2019年末增加1,948.76万元,主要系:1)随着境内疫情逐步得到控制,预计市场需求将集中增加,公司加大了原材料的备货量并对主要产品保持较为充足的备货量。其中,原材料余额较上年末增加1,096.43万元;留置针产品因子公司青岛佳康受疫情影响销售未达预期等因素,期末余额增加了786.12万元,该产品期后销售情况良好;2)公司新取得医用口罩产品注册证,受疫情影响境外市场的口罩需求较高,公司增加相关产品备货642.00万元。
公司分配的归属于2019年度现金分红共计10,361.75万元,分别于2019年12月和2020年6月两次宣告分配。其中,2019年12月,公司宣告派发现金股利3,670.97万元,主要为了满足自然人股东缴纳因发行人股份制改制时资本公积转增股本产生的个人所得税的资金需求;2020年6月,经公司第三届董事会第八次会议审议,宣告派发2019年度的现金股利为6,690.78万元,系综合考虑企业经营和现金流等因素,在保证未来可持续发展的前提下,依据现行有效的《公司章程》所规定的股利分配政策,按当年可分配利润的40%派发现金分红。
2019 年末宣告派发的现金股利实际系为了满足自然人股东缴纳个人所得税的资金需求,不属于常规的年度分红计划;2020 年 6 月宣告分配的现金股利系根据公司发展不同阶段作出的安排。因此,公司分配的归属于 2019 年度的现金分红频率及比例主要是特殊背景因素所致,存在未来不可持续的风险。
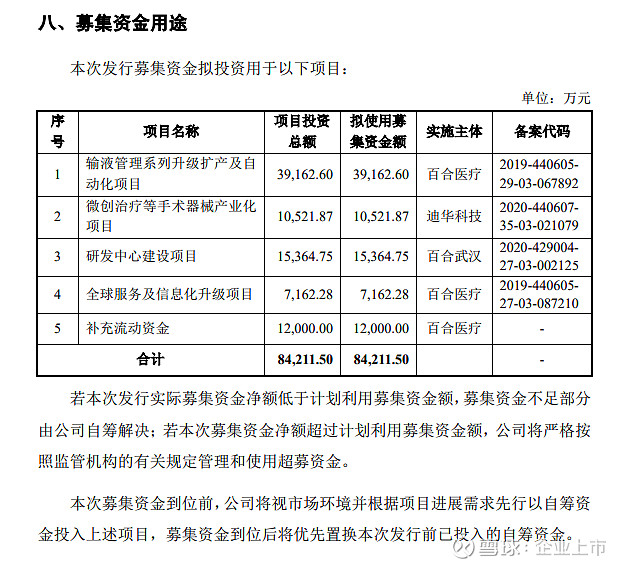
截至本招股说明书签署日,发行人控股股东、实际控制人黄凯直接控制发行人55.11%股份,通过其一致行动人李明和马立勋分别控制发行人14.13%和1.80%股份,合计控制发行人 71.04%股份。
黄凯先生,1980 年 5 月出生,中国国籍,无境外永久居留权,EMBA 学位。曾任佛山生态馆执行事务合伙人,佛山市宏邦化工原料有限公司董事长,佛山市华柏化工有限公司董事兼总经理,益安贸易监事,东骅材料执行董事兼总经理,优特医疗董事长,华晨经贸副董事长兼总经理;现任发行人董事长,同时任翎博新材董事长,天彩塑料执行董事兼总经理,神甲养殖执行董事,环湖市场执行董事兼总经理,优特医疗副董事长,青岛佳康董事,爱贝尔科技董事长兼总经理,百合武汉董事长,百合香港董事,百合(巴基斯坦)董事兼执行总裁,百合(印度)董事。
李明先生,1963 年 4 月出生,中国国籍,无境外永久居留权,本科学历。曾任河南省正阳县第二高中教师,驻马店师范高等专科学校教师,中山万利电子有限公司总经理助理,中山科成化纤有限公司销售经理,佛山特种医用导管有限责任公司销售经理,佛山市南海显亚塑料有限公司执行董事,广州市爱希有医疗器械有限公司执行董事,百合有限副总经理、总经理,青岛佳康董事长、总经理;现任发行人董事兼总经理,同时任博新生物董事,青岛佳康董事。
马立勋先生,1973 年 5 月出生,中国国籍,无境外永久居留权,高中学历。曾任佛山电缆厂销售员,佛山市中宝通信设备线缆有限公司销售主管,百合有限总经理、副总经理,博新生物董事长;现任发行人董事兼副总经理,同时任青岛佳康董事长兼总经理,爱贝尔科技董事。
8-1-5 关于广东百合医疗科技股份有限公司审核中心意见落实函回复 2020-12-25
问题 3:请发行人在“公司治理与独立性”部分,补充披露2018 年发行人在飞行检查中被发现存在 1 项严重缺陷的具体情况及后期整改情况。
【回复】:
发行人已在招股说明书“第七节 公司治理与独立性”之“五、发行人报告期内违法违规行为的情况”中补充披露如下:
“(二)发行人报告期内其他违规事项
1、产品召回事项
(1)基本情况
2018 年 8 月,贵州省药品监督管理局对发行人子公司博新生物销售的血液灌流器产品进行监督抽验,结果显示公司血液灌流器的血室容量指标不符合企业制定的标准。本次抽检的产品规格情况与行业标准规定的基本参数及企业标准的对比情况如下:

① 企业标准高于行业标准规定的基本参数
行业标准 YY0464-2009《一次性使用血液灌流器》对血室容量作出如下规定:
“4.2.1 灌流器的血室容量宜小于 200mL;5.2 灌流器的血室容量应不大于制造商的标称值”。
博新生物的企业标准对各规格产品的血室容量规定了上、下限,如 MG150的血室容量应为“80±5mL”,与行业标准规定的基本参数比较而言,范围较小且严格。本次监督抽验 MG150 的检测结果为 102mL、108mL和 MG130 的抽检结果为 86mL,虽然不符合企业制定的标称值,但符合行业标准中规定的小于 200mL的基本参数。
② 血室容量指标不影响产品安全性和有效性
根据中国医疗器械行业协会出具的说明,血室容量属于物理性能,血室容量在不大于 200mL 的情况下,对产品的安全性和有效性没有实质性影响。根据《国家药监局综合司关于印发 2019 年国家医疗器械抽检产品检验方案的通知》,一次性使用血液灌流器的检验项目为无菌、热原、密封性能和吸附吸能,并无血室容量指标。
(2)整改情况
针对上述情况,公司全体人员高度重视,组织人员展开调查分析原因并提出整改措施,全面规范基础管理工作,具体如下:
①依照《医疗器械召回管理办法》(国家食品药品监督管理总局令第 29 号)第十三条的规定,召回分级为三级(即使用该医疗器械引起危害的可能性小但仍需要召回)。依照上述规定,博新生物开展对监督抽验不合格的同批次产品的召回工作,本次召回三个批次共 799 支,已全部用于临床治疗;
②全面加强对生产人员装量要求的培训、加强生产管理巡查以确保装量保持稳定,并对成品检验增加血室容量项目,确保后续出厂的批次均符合相关指标;
③重新对血室容量与吸附剂装量的关系进行验证,完善产品生产工艺要求;同时提交了修改产品相关技术指标的注册申请文件,并于 2020 年 2 月获取国家药品监督管理局关于变更血室容量的批复文件。
因此,发行人子公司博新生物上述事项中涉及的血液灌流器血室容量虽然超出企业制定的标准但符合行业标准规定的基本参数,对产品安全性、有效性不存在实质性影响,公司已进行了全面整改,并于 2020 年 2 月获取国家药品监督管理局关于变更血室容量的批复文件,相关事项未导致质量事故。
(3)召回事项相关批次产品未发现不良事件
根据《医疗器械不良事件监测和再评价管理办法》,不良事件是指已上市的医疗器械,在正常使用情况下发生的,导致或者可能导致人体伤害的各种有害事件。不良事件的上报遵循可疑即报原则,且任何单位和个人均有权向相关部门或机构报告不良事件。
患者在实际治疗过程中,发生可疑不良事件的,主要通过医疗机构进行上报。根据 2018 年度和 2019 年度的《国家医疗器械不良事件监测年度报告》,我国医疗器械可疑不良事件每年上报约 40 万例左右,报告主体以使用单位上报为主,占比约 90%,个人报告占比在 0.1%以下。
发行人拟召回的血液灌流器产品已全部用于临床治疗,依据相关批次产品的临床使用单位的回复,相关产品安全、有效,无不良反应。此外,经查询国家医疗器械不良事件监测信息系统,未发现发行人相关批次产品存在可疑不良事件记录。
(4)召回事项对财务状况的影响
公司血液灌流器召回事项共涉及三批次产品,三批次产品合计销售 94.24万元,共计 2,989 支,已办理退货 352 支,封存 1,838 支,拟召回 799 支。其中,退货和封存产品的销售价值为 69.31 万元,存货价值 18.81 万元,公司已冲减当期营业收入并全额计提跌价准备。
该产品召回事件影响了公司血液灌流器产品的销售。2019 年度,公司血液灌流器产品销售收入较上年度下降 3,886.21 万元,降幅为 46.91%。2019 年末,公司针对血液灌流器相关原料树脂、半成品树脂及血液灌流器成品计提了充分的跌价准备,共计 1,501.58 万元,具体情况说明如下:
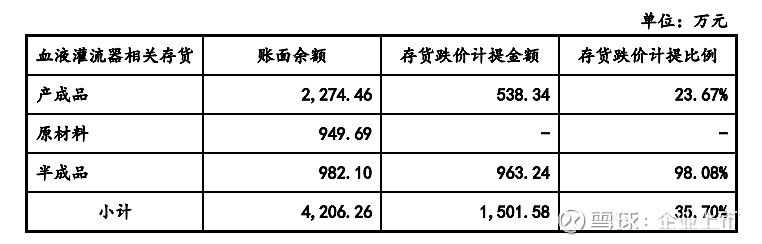
2019 年末,公司血液灌流器相关的原材料余额为 949.69 万元,库龄大部分在 1 年以内,均可正常投入生产使用,可变现净值大于账面价值,故无需计提跌价准备;2019 年末,公司血液灌流器相关的半成品余额为 982.10 万元,其中临近有效期或过期的退换货拆解回收树脂 963.24 万元,公司对该批半成品树脂进行封存,预计不再投入使用,故全额计提跌价准备;2019 年末,公司血液灌流器产成品余额为 2,274.46 万元,公司通过终端市场反馈,受血液灌流器召回事项影响,于 2019 年 5 月之前生产的小规格型号的血液灌流器滞销,预计期后较难实现销售,对其全额计提跌价准备,共计 538.34 万元。
综上,公司根据企业会计准则的要求对血液灌流器召回事项相关存货计提了充分跌价准备。
综上所述,报告期内,发行人存在的召回事项对发行人产品的安全性、有效性不存在实质性影响,发行人已对相关事项进行纠正或整改,相关事项未导致质量事故。
2、发行人报告期内国家飞行检查事项
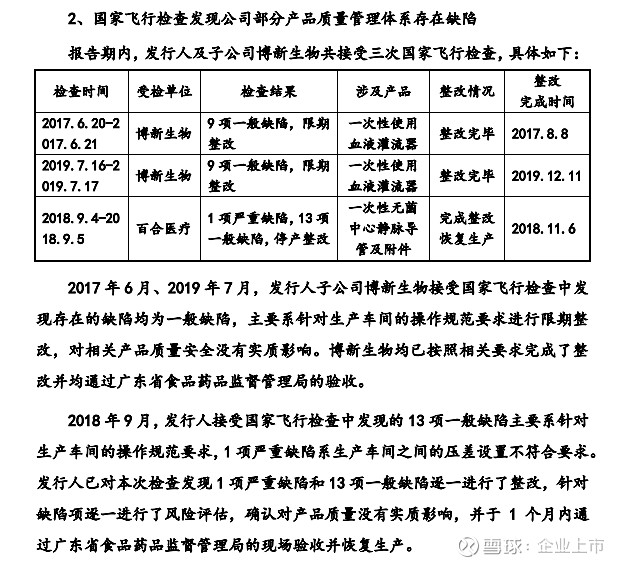
报告期内,发行人及子公司博新生物共接受三次国家飞行检查,具体如下:

(1)博新生物飞行检查相关情况
2017 年 6 月和 2019 年 7 月,发行人子公司博新生物接受国家飞行检查的产品均为一次性使用血液灌流器,检查发现存在的缺陷均为一般缺陷,主要系针对生产车间的操作规范要求进行限期整改,对相关产品质量安全没有实质影响。博新生物均已按照相关要求完成了整改并均通过广东省食品药品监督管理局的验收。
(2)百合医疗飞行检查相关情况
①2018 年 9 月飞行检查相关情况
2018 年 9 月,发行人接受国家飞行检查的产品为一次性无菌中心静脉导管及附件,检查发现存在 13项一般缺陷和 1 项严重缺陷。2018 年 10 月 12 日,广东省食品药品监督管理局出具《关于责令广东百合医疗科技股份有限公司停产整改的通知》,要求百合医疗停产整改,并组织评估产品安全风险,对可能导致安全隐患的,召回相关产品。
②存在的缺陷及整改情况
发行人对本次检查发现 1 项严重缺陷和 13 项一般缺陷逐一进行了整改,并针对缺陷项逐一进行了风险评估,确认对产品质量没有实质影响,不存在产品召回情形。发行人一般缺陷主要系针对生产车间的操作规范要求,对发行人产品质量安全没有实质影响;发行人 1 项严重缺陷及整改措施如下:

2018 年 11 月 2 日,广东省药品监督管理局对发行人整改情况进行了跟踪复查,复查结果认为:企业已针对缺陷项目进行整改,基本符合医疗器械生产质量管理规范要求。
2018 年 11 月 6 日,广东省药品监督管理局出具了《关于同意广东百合医疗科技股份有限公司恢复生产的通知》,认定发行人已完成国家局飞行检查中发现的缺陷项目的整改工作,同意发行人恢复生产。
③对相关产品销售的影响
本次飞行检查涉及的产品为一次性无菌中心静脉导管及附件。发行人存在的 13 项一般缺陷系生产体系的相关问题,不涉及产品缺陷,存在的 1 项严重缺陷系生产车间之间的压差设置不符合要求,未对产品质量产生实质性影响。发行人已积极按要求进行整改并于 1 个月内通过主管部门的现场验收和恢复生产。
报告期内,公司中心静脉导管实现的销售收入分别为 8,824.18 万元、10,486.98 万元、13,513.37 万元和 5,610.17 万元,销售收入稳步增长,该次飞行检查发现的缺陷及停产整改未对发行人相关产品的销售造成重大不利影响。
综上,报告期内,发行人及子公司博新生物经国家飞行检查后发现的缺陷主要为一般项缺陷,存在的 1 项严重缺陷系生产车间之间的压差设置不符合要求,未对产品质量产生实质性影响,且发行人已根据要求履行了相应的整改措施并通过了相关主管部门的现场验收,整改措施得到有效执行,未对发行人的生产经营和相关产品的销售产生重大不利影响。
……..”。