本期编辑 | 双

Vertex斥资9.5亿美元收购SemmaTherapeutics及其干细胞-胰岛B细胞移植疗法

SemmaTherapeutics的收购交易代表着美国福泰制药(Vertex Pharmaceuticals)最新的交易狂潮。就在今年,Vertex签署了有关基因编辑和蛋白质降解的交易协议,扩大了与CRISPR Therapeutics公司的合作,并收购了基因编辑公司Exonics。
以囊性纤维化药物研发著称的VertexPharmaceuticals正在进入糖尿病领域。9月3日,Vertex Pharmaceuticals官网宣布,正以9.5亿美元的全现金交易收购Semma Therapeutics及其基于干细胞的糖尿病疗法,该交易预计将在第四季度结束。
Douglas Melton博士于2014年成立了Semma,致力于治疗1型糖尿病。他的想法是将未分化的多能干细胞转化为能产生胰岛素的胰岛B细胞,并将其移植到患者体内。该公司于次年获得4400万美元的A轮融资,并宣布与诺华开展合作,诺华公司因其在细胞治疗方面的专长而选择与其合作
2017年,Semma继续筹集了1.14亿美元的B轮融资,并聘请了Bastiano Sanna担任首席执行官(CEO)。Sanna曾是MagentaTherapeutics的首席运营官和诺华干细胞移植项目的全球负责人,他曾在诺华公司协助监督这家大型制药公司的CAR-T细胞疗法研发。
现在,Vertex将赌注押在一全新的多能干细胞转化的胰岛B细胞移植疗法上,以期取代1型糖尿病患者传统的日常胰岛素注射和慢长护理。
“这项收购与我们投资于科学创新的战略完全一致,有望为专业市场上患有严重1型糖尿病患创造具有变革性的药物”,Vertex 的CEO Jeffrey Leiden博士说,他将在明年四月把大权移交给首席医疗官ReshmaKewalramani。
Semma的新型糖尿病疗法有两大特点:
● 将多能干细胞转化而来的胰岛B细胞直接移植到病人身上,由此产生胰岛素来控制血糖水平。然而,这种移植需要长期的免疫抑制,以控制排斥反应。
● 使用一种特殊装置输送和保护移植的胰岛B细胞不受病人免疫系统的影响。
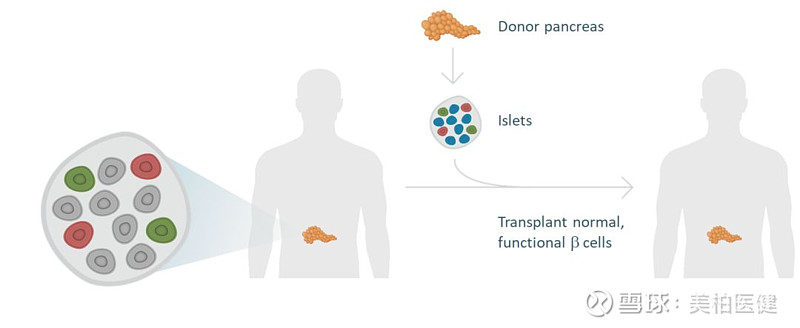
▲Semma Therapeutics的多能干细胞转化的胰岛B细胞移植疗法示意图 图源:Semma Therapeutics
“我们看到了一个改变1型糖尿病治疗模式的巨大契机,通过促进细胞本身的分化和制造出胰岛素,以及通过高度创新的细胞/设备组合”,Leiden说。
Semma的收购交易代表了Vertex最新的交易狂潮。今年6月,Vertex拨出4.2亿美元预付款,深入到肌肉营养不良领域。随后Vertex斥资1.75亿美元扩大与CRISPRTherapeutics的交易,并斥资2.45亿美元收购Exonics及其基因编辑管线。而早在今年1月,Vertex就与ArborTherapeutics达成了另一项基因编辑协议;并与Kymera Therapeutics达成了蛋白质降解合作协议,该协议耗资7000万美元预付款,里程碑付款超过10亿美元。

罗氏达菲后继者Xofluza III期试验流感感染风险降低86%
 ▲罗氏Xofluza可使感染者的家庭成员的流感感染风险降低了86%
▲罗氏Xofluza可使感染者的家庭成员的流感感染风险降低了86%
随着达菲销量的下滑,罗氏公司已转向下一代流感药物Xofluza,以接替这一老牌畅销药。Xofluza的一大重任是获得FDA对其作为流感预防用药的批准。
近日,罗氏III期Blockstone试验的数据显示,与安慰剂相比,罗氏首创的CAP依赖性核酸内切酶蛋白口服抑制剂——Xofluza,可使感染者的家庭成员的流感感染风险降低86%,该研究结果于上周日在新加坡举行的Options X 2019大会上公布。
罗氏说,接受Xofluza治疗的试验组患者只有1.9%感染了流感,而安慰剂组达到13.6%。Xofluza也取得了显著的亚组结果:Xofluza组在甲型流感亚型、有很高流感相关并发症风险的家庭接触者以及12岁以下儿童中均击败了安慰剂组。
最新的试验数据也可能为支付方提供一个令人信服的证据,罗氏全球流感和传染病产品研发主管Barry Clinch表示:“如果获得FDA批准,我们相信Xofluza在流感预防性用药领域中会受到支付方的青睐,因为流感对医疗保健系统和经济成本有重大影响”, Clinch在电子邮件中说:“医生和从公共卫生的角度来看,重要的是要有新的药理机制,以解决出现的流感对现有药物的耐药问题。”
Xofluza的这次数据并不全都利好:与安慰剂组的20.5%相比,Xofluza的副作用发生率为22.2%,但罗氏称两组安全性为“相似”。
同时,罗氏公司还公布了其Ministone -2试验的数据,在减少“儿童患者报告至少一种流感症状”发生率上,Xofluza击败了达菲。罗氏说,Xofluza组46%的患者在29天后报告了至少一种流感症状,而达菲组达到53.4%。
Xofluza还降低了患者感染的时间长度——一种称为“病毒脱落”的指标——比达菲多了两天。Xofluza组的感染期平均记录为24.2小时,而达菲为75.8小时。
Xofluza强劲的流感预防能力可能有助于罗氏弥补达菲的销量下滑(三年前达菲仿制药上市以后)。2019年上半年,达菲的销售额仅为2.77亿美元,较2018年同期下降29%。
Clinch说,除了流感预防之外,罗氏公司也在寻求Xofluza的其他适应症,包括将Xofluza作为治疗流感并发症高风险人群的单剂量口服治疗,作为对标准治疗——神经氨酸酶抑制剂以及1岁以下患者的补充。
在销售方面,Xofluza在2018年底首次获批后,其销售额还远没有达到罗氏的预期。在上半年,Xofluza的销售额仅为600万美元,排名倒数第二;在罗氏6月份获批的Polivy销售额倒数第一。
然而,Xofluza还是有希望的:在日本拥有Xofluza授权的合作伙伴盐野义制药公司(Shionogi)表示,Xofluza在2018财年的国内销售额达到2.43亿美元。
面对仿制药的冲击,在处方药转非处方药(OTC)获得FDA批准的背景下,罗氏公司在7月份与赛诺菲签署了一项独家协议,放弃对达菲的非处方药(OTC)权利。根据该协议,赛诺菲将处理与FDA关于转OTC和所有未来市场营销的谈判,并在其他市场上拥有OTC交易权的优先权。
获得非处方药的批准并不容易:像达菲这样的抗病毒药物,可能还有一个额外的问题,即消费者的广泛使用是否会增加病毒耐药的风险。但是,2012年在新西兰——第一个不用处方就能获得达菲的国家进行的一项研究发现,5年的非处方达菲治疗似乎没有刺激流感耐药性的发展,也没有引发流感免疫率的下降。

CoNCERT氘化JAK抑制剂斑秃II期试验成功,有望成为同类最优?
以氘化学药物研发平台(DeuteriumChemical Entity Platform)为特色的美国肯塔基州制药公司CoNCERTPharmaceuticals正试图打破目前只能用口服、外用和注射类固醇治疗斑秃的僵局。
9月3日,CoNCERTPharmaceuticals官网宣布,旗下CTP-543在中重度斑秃II期试验中达到了主要终点。
该研究对149名患者随机给予4mg、8mg和12mg剂量的CTP-543或安慰剂。CTP-543是芦可替尼(ruxolitinib)的氘化版本,是一种JAK选择性口服抑制剂,在美国ruxolitinib由因塞特医疗(Incyte)以商品名Jakafi销售。
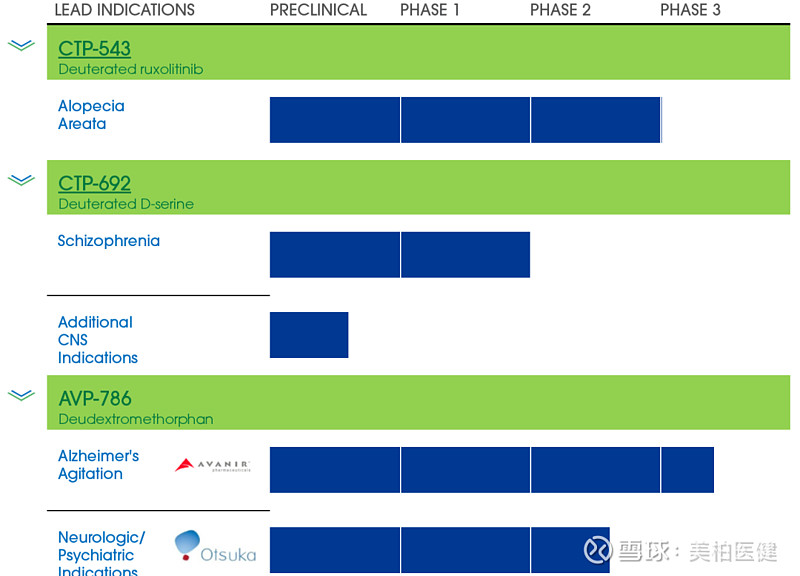
▲CoNCERT Pharmaceuticals的氘化学药物研发管线
去年11月,该公司公布了CTP-543以两种较低剂量治疗24周后的结果。CoNCERT发现,4mg的剂量“与安慰剂没有统计学上的差异”,尽管根据脱发严重程度评分工具(SALT)的测量(0%为无头皮脱发,100%为全头皮脱发),CTP-543确实使大约五分之一患者的脱发严重程度评分降低了至少50%。8mg组疗效更好,47%的患者的SALT评分降低至少50%,达到研究的主要终点。
尽管CoNCERT预计12mg的剂量会有更好的效果,但首席执行官Roger Tung当时认为,8mg的安全性和有效性足以使CTP-543在该剂量水平下继续使用。
12mg CTP-543组的SALT评分降低至少50%的比例达到58%,而安慰剂组为0%。与安慰剂组相比,8 mg 和 12 mg两个剂量组SALT评分下降至少75%或至少90%的比例均显著更高。所有患者的SALT平均得分为88%(0%为无头皮脱发,100%为全头皮脱发)。另外,78%的12mg组和58%的8mg组认为他们的病情“有很大改善”或“有非常大改善”。
“很明显,我们看到12mg的CTP-543可显著改善脱发程度,我们甚至可以说,12mg剂量组为斑秃这一疾病的疗效设置了一个新的标准,” Tung表示。
斑秃是一种自身免疫性疾病,其免疫系统攻击毛囊,导致头发呈斑块状脱落,目前还没有获批的治疗方法。根据美国的全国斑秃基金会的说法,目前的治疗方法是从其他疾病领域借来的——包括口服、局部和注射皮质类固醇,可能对某些患者有用,但对其他患者没有作用。
“皮质类固醇无法做到长期治愈”,Tung说:“病灶内注射类固醇往往更有效,但是会让病人感到非常不方便和痛苦。因为病人每次注射只能覆盖头皮的一小部分,所以有大面积脱发的患者不得不接受多次注射。每月重复多次头皮注射是非常折磨人的,几乎没有人能长期忍受这种痛苦的疗法”
外用类固醇也有自己的局限性,它们往往不太有效,会引起皮肤敏感或皮肤变薄。
而CTP-543则是一种相对方便的口服药物,每天服用两次。CoNCERT对CTP-543的疗效进行了24周/6个月的随访,但是CoNCERT还没有收集足够的数据来决定一个完整的治疗周期应该持续多久。
CoNCERT已经开始了一项更长期的开放标签扩展试验,并且12mg剂量组的斑秃患者可以入组。
“我们认为,六个月将是界定CTP-543和其他具有类似机制的化合物功效的短期目标”,Tung说:“当我们从第12周到第16周到第20周到第24周的时候,我们看到的是疗效的持续攀升,超过了目前研究的时间范围。”

虽然每天两次口服CTP-543和每个月几十次的类固醇注射相比真的是小菜一碟,但CoNCERT还开展了两项开放标签的II期试验,探讨每日口服一次的合适剂量。其中一项试验对比16mg/d与8mg bid的疗效,预计在年底前会出结果。第二项试验将比较24mg/d与12mg bid的疗效,届时将入组大量受试者。
有了这些数据的支持,CoNCERT预计在2020年初与FDA会面,以确定CTP-543的具体注册计划。CoNCERT计划明年晚些时候启动CTP-543的III期试验。

文章版权归【美柏医健】所有
欢迎转发,转载请参照“转载须知”
投稿或应聘,请将稿件和简历发送到
tara.tian@mybiogate.com
近期热文推荐

最新活动推荐

点击阅读原文,注册报名China Focus@BWB