
这个研究是日本武田制药,同时武田制药也是世界是几大血液制品企业。据说最近几年武田加大了血液制品的投资。
文章来自网络,系个人爱好。不作为投资建议。本文对照天坛生物皮下注射夜20%静丙具有积极意义。
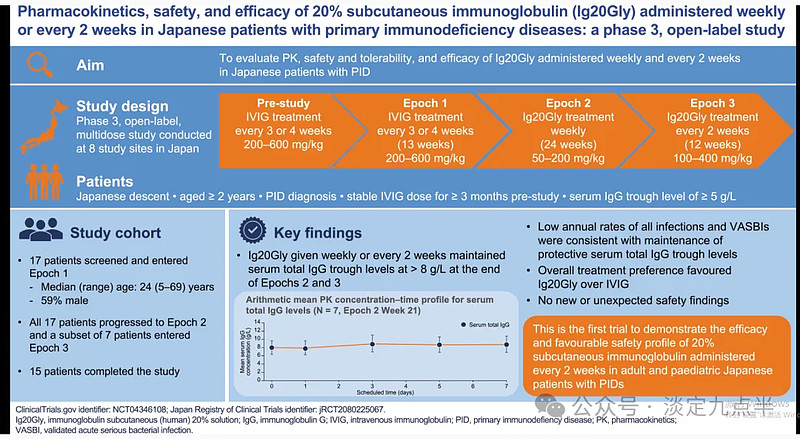
这项 3 期、开放标签、多剂量研究 (NCT04346108) 评估了免疫球蛋白皮下(人)20% 溶液 (Ig20Gly) 每周和每 2 周给药的药代动力学、安全性、耐受性和有效性,日本原发性免疫缺陷病(PID)患者。
该研究在日本的八个研究地点进行,并招募了 ≥2 岁的 PID 患者,在研究前 ≥3 个月使用稳定的静脉注射免疫球蛋白剂量进行治疗。
患者每 3 或 4 周以研究前剂量 (200-600 mg/kg) 静脉注射免疫球蛋白,持续 13 周(第 1 期),皮下注射 Ig20Gly (50-200 mg/kg),每周一次,持续 24 周(第 2 期),Ig20Gly (100-400 mg/kg),每 2 周一次,持续 12 周(第 3 期)。
主要终点是第 2 期和第 3 期的血清总免疫球蛋白 G (IgG) 谷水平。
总体而言,17 名患者入组(中位 [范围] 年龄:24 [5-69] 岁;59% 为男性)并参加了第 1 期和第 2 期;七名患者进入第 3 纪元。
血清总 IgG 谷水平维持在 >8 g/l:第 95 期和第 2 期结束时的几何平均值(3% 置信区间)分别为 8.56 (8.03-9.12) g/l 和 8.39 (7.89-8.91) g/l。相关治疗中出现的不良事件严重程度均为轻度;第 2 期和第 3 期最常见的治疗中出现的不良事件(不包括感染)是注射部位肿胀 (24%) 和注射部位红斑 (18%)。
这是第一项证明每 20 周注射 2% 皮下注射免疫球蛋白对成人和儿童日本 PID 患者的疗效和良好安全性的试验。
原发性免疫缺陷病(primary immunodeficiency diseases, PIDs)也称为先天性免疫缺陷,是一组导致继发于适应性和/或先天性免疫系统潜在缺陷的复发性感染易感性增加的疾病。
2018年日本一项针对1307名受试者的全国性调查显示,PID/先天性免疫缺陷的患病率估计为每2万人中有2.100例患者受访者报告存在抗体缺陷。
对于无法产生和/或维持有效抗体反应的PID患者,主要治疗方法是免疫球蛋白替代疗法(immunoglobulin replacement therapy, IgRT),该疗法可通过静脉或皮下途径给药。
皮下免疫球蛋白(subpicaneous immunoglobulin, SCIG)不需要静脉通路,可在家中自行给药,并且已被证明在预防PID患者感染方面与静脉注射免疫球蛋白(intravenous immunoglobulin, IVIG)一样有效,全身不良反应较少。然而,SCIG输注的常规给药量比IVIG小,因此需要比IVIG更频繁的给药和更多的输注部位。
免疫球蛋白皮下(人)20%溶液(Ig20Gly;库维特鲁;Baxalta US Inc.是位于美国马萨诸塞州列克星敦的武田集团公司的成员,是一家在37个国家获批用于治疗PID的SCIG。在美国,Ig20Gly被批准作为IgRT用于治疗2岁及以上成人和儿童患者的PIDs[9],在欧洲被批准用于治疗成人、儿童和青少年(0-18岁)中抗体产生受损和某些继发性免疫缺陷综合征的PIDs[10]。
Ig20Gly是一种高浓度的免疫球蛋白G(IgG)制剂,与浓度较低的SCIG产品相比,可以使用较小的总输注量和更高的速率给药[6,11,12]。
直到最近,日本其他可用于治疗 PID 的 SCIG 20% 制剂仅限于每周输注一次;直到最近(2年2023月),每13周一次给药才被批准。使用Ig2Gly,可以选择从每天到每9周定期输注[10,2],在欧洲(NCT3)[01412385]和北美(NCT12)进行的两项关键性01218438/11期临床试验中,在成人和儿童免疫球蛋白经验的PID患者中证明了疗效、安全性和耐受性[20]].
这些关键研究的结果在授权后的真实世界研究中得到支持,这些研究强调了Ig14Gly在儿童和成人PID患者中的灵活性和耐受性[17–20]。
本文报告的研究旨在评估 Ig2Gly 每周和每 20 周给药一次的日本 PID 患者的药代动力学 (PK)、安全性和耐受性以及疗效。Ig20Gly是第一个使用甘氨酸作为稳定剂和缓冲剂在日本患者中研究的<>%SCIG制剂。
这是一项 3 期、开放标签、多剂量研究(ClinicalTrials.gov 标识符:NCT04346108;日本临床试验注册中心(Japan Registry of Clinical Trials)在日本的八个研究地点进行,注册号:jRCT2080225067)。
该研究由三个时期组成(图1)。符合条件的患者最初进入第 1 期,接受研究前剂量约为 200-600 mg/kg 体重的标准护理 IVIG 输注,每 3 周或每 4 周一次,持续 13 周。在第 1 期结束时,符合条件的患者进入第 2 期,并将治疗改为每周皮下输注 Ig20Gly 50-200 mg/kg 体重,持续 24 周(两个 12 周的治疗期)。
如果需要,在第 1 集的第 12-2 周进行剂量调整,以维持 ≥5 g/l 的目标血清总 IgG 谷水平。
在第 1-12 周还进行了输液训练。疗效评估在第 13 集的第 24-2 周进行。
在第 2 期结束时,最多 3 名符合条件的患者进入第 20 期,每 2 周接受一次 Ig12Gly,持续 2 周,剂量水平约为第 100 期的两倍(400-<> mg/kg 体重)。
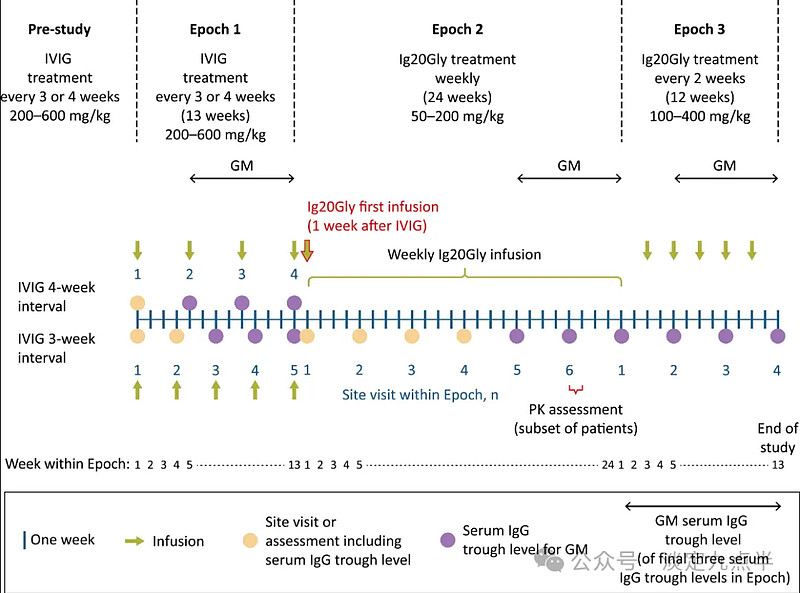
研究设计原理图。GM, 几何平均值;Ig20Gly,免疫球蛋白皮下(人)20%溶液;IgG,免疫球蛋白G;IVIG,静脉注射免疫球蛋白;PK,药代动力学。
如果患者是日本血统且在筛选时年龄在 2 岁或以上,有涉及抗体形成并需要免疫球蛋白替代的 PID 形式的书面诊断,在筛选前至少 3 个月接受过稳定剂量的 IVIG,筛选时血清 IgG 谷水平≥ 5 g/l,则有资格纳入, 筛选前 3 个月内未发生严重细菌感染,并提供书面知情同意书。
该研究的主要终点是每周给予 Ig20Gly(第 2 期,第 13-24 周)和每 20 周给予 Ig2Gly 后(第 3 期)的血清总 IgG 谷水平。对于第 2 期(第 13-24 周),PK 评估旨在在最后一个月内对 5-7 名 12 岁及以上的患者进行每周 Ig20Gly。PK 系列采样从第 2 集第 21 周(± 1 周)开始。输注前样本(即输注前 1 小时内上一次输注的谷水平)定义为 PK 第 0 天。
在第 1、3、5 和 7 天(从第 6 天输注开始时间开始± 0 小时)进行连续采样时间点。为了评估 Ig2Gly 稳定后血清总 IgG 水平是否在整个第 3 期和第 20 期保持稳定,选择了每个时期结束时最后三个血清 IgG 谷值的几何平均值进行比较。根据采样计划,在 Epochs 1 和 3 中仅选择了最后三个 IgG 谷值。
次要终点包括疗效、安全性和健康相关生活质量(health-related quality of life, HRQoL)指标。次要疗效终点包括血清总 IgG 的 PK 参数分析(第 2 期),以及每 3 周或每 4 周给予一次 IVIG 后血清总 IgG 谷水平分析(第 1 期)。
还评估了安全性终点,包括治疗中出现的不良事件 (TEAE) 的发生率、与输注相关的耐受性事件(IVIG 或 Ig20Gly)、年感染率(包括经证实的急性严重细菌感染 [VASBIs])和抗生素使用天数。感染被定义为任何不良事件 (AE),首选术语来自《监管活动医学词典》第 24.0 版系统器官类别“感染和感染”。
使用以下问卷评估HRQoL结局:儿科生活质量量表(Pediatric Quality of Life Inventory, Peds-QL)[18]、36项短期健康调查(SF-36)[19]和5维3水平EuroQol(EQ-5D-3L)[20]。使用生活质量指数问卷(LQI)[21]和9项药物治疗满意度问卷(TSQM-9)测量治疗满意度。还评估了治疗偏好(使用最后一次患者就诊时的治疗偏好问卷测量)和医疗资源利用率(包括住院、住院时间、急性护理就诊以及因感染而缺勤/上学的天数)。
本研究计划纳入共 16 名患者,其中 12 名患者预计完成第 2 期,保守退出率为 25%(基于先前的研究)。样本量估计是基于患有 PID 的日本人口规模较小。
登记组包括所有已分配登记号的筛查患者,并用于分析患者人口统计学和基线临床特征。基线定义为第 1 期访问 1。全治疗组包括所有接受至少一剂研究药物(IVIG 或 Ig20Gly)的入组患者,并用于所有疗效、安全性、耐受性、HRQoL、医疗资源利用和治疗偏好结果分析。
PK分析集包括所有接受至少一剂研究药物(IVIG或Ig20Gly)的入组患者,至少具有一种可评估的血清总IgG浓度值,并且没有影响血清IgG浓度分析结果的主要方案偏差或事件。PK数据(血清总IgG谷水平和PK谱)的分析基于PK分析集。
所有分析均采用描述性统计。这些包括血清总 IgG 谷水平的几何平均值和相应的双侧 95% 置信区间 (CI);置信区间仅用于描述性目的。没有对治疗进行正式的统计比较。
总共有17名患者在日本的1个中心接受了筛查,他们都有资格进入第17纪元。所有 2 名患者均进展至第 3 期,其中 15 名患者进入第 2 期;总体而言,3 名患者完成了研究(即完成了第 2 期或第 2 期)(图 1)。未完成研究的两名患者在第 <> 期撤回了同意(父母/监护人和患者各一名);两次退出都不是由于AE造成的。患者人口统计学和基线特征见表<>。
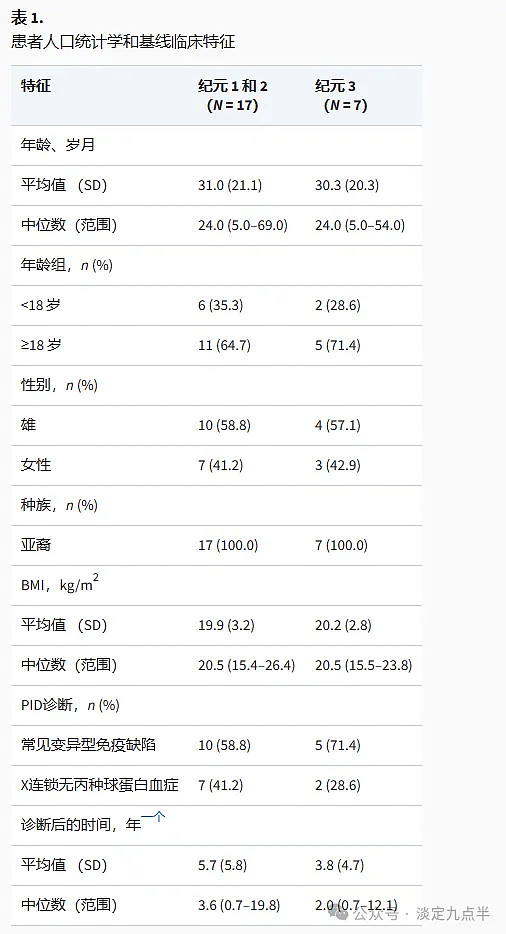
所有符合进入 Epoch 1 的患者都进展到 Epoch 2,因此 Epoch 1 和 Epoch 2 的患者数量相同。
一个第 14 纪元和第 1 纪元的 N = 2;<>例患者的确切诊断日期未知。
BMI,体重指数;PID,原发性免疫缺陷病;SD, 标准差。
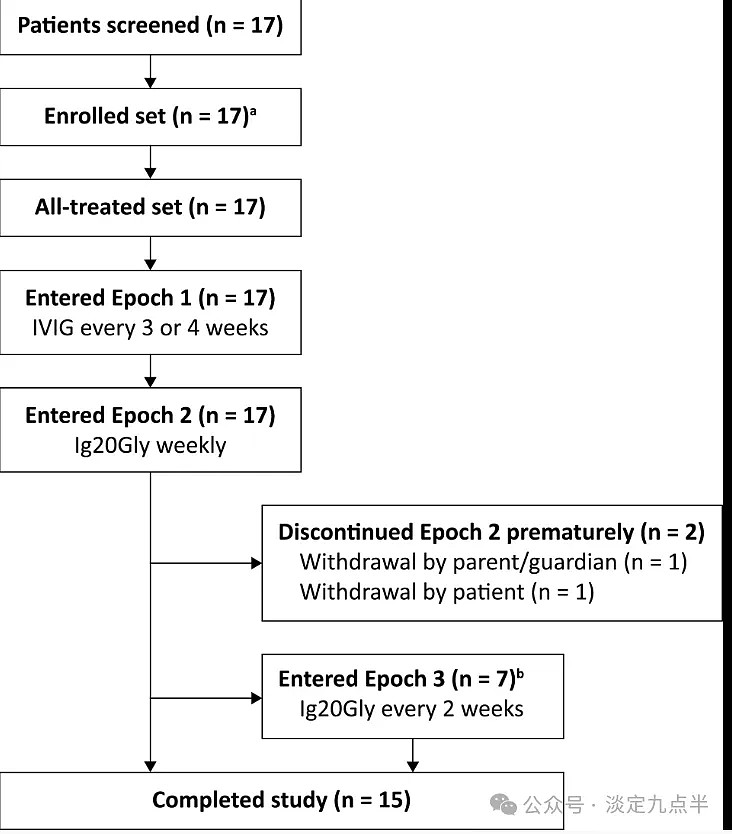
患者处置。一个三名患者在第一次筛查中被淘汰,但成功重新筛查并接受了研究剂量。b第 3 纪元计划用于多达 20 名符合条件的患者。Ig20Gly,免疫球蛋白皮下(人)<>%溶液;IVIG,静脉注射免疫球蛋白。
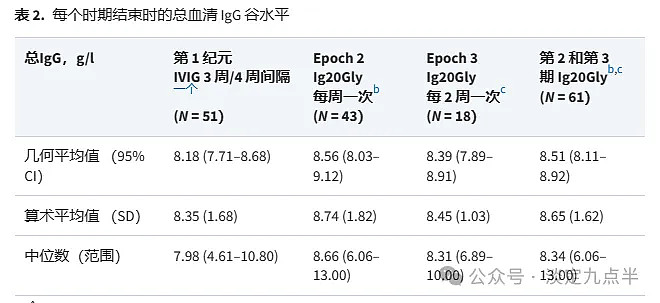
在每周给予 Ig2Gly 后,第 20 期末血清总 IgG 谷水平的几何平均值为 8.56 g/l(95% CI:8.03-9.12 g/l,表 2)。
在第 3 期结束时,每 20 周给予一次 Ig2Gly 后,血清总 IgG 谷水平的几何平均值与第 2 期相似:8.39 g/l(95% CI:7.89-8.91 g/l,表 2)。
使用算术平均值和每个时期结束时血清总 IgG 谷水平的中位数观察到类似的结果(表 2)。
在第 1 期末的次要终点分析中,3 周给药间隔的几何平均值略低于 4 周给药间隔的几何平均值:分别为 7.52 g/l(95% CI:6.42-8.82 g/l)和 8.47 g/l(95% CI:8.01-8.95)。
一个数据表示 7 周治疗间隔第 10、13 和 3 周(n = 5 名患者)以及 5 周治疗间隔第 9、13 和 4 周(n = 12 名患者)的总 IgG 测量值。
b数据代表了第 17、21、25 周和 EOS/ET 在研究第 203-261 天内的总 IgG 测量值。c数据代表第 5、9 和 13 周 (EOS/ET) 的总 IgG 测量值。CI, 置信区间;EOS,研究结束;ET, 提前终止;Ig20Gly,免疫球蛋白皮下(人)20%溶液;IgG,免疫球蛋白G;IVIG,静脉注射免疫球蛋白;SD, 标准差。
在第 2 期期间,血清总 IgG 水平的算术平均 PK 浓度-时间曲线在第 21 周的整个给药间隔内保持稳定(图 3)。
第 2 周第 21 期总 IgG 的 PK 参数总结在附表S1.在 95 周(1 小时)给药间隔 (AUC168-tau) 和直到最后一个时间点 (AUC0-last) 内,总 IgG 的浓度-时间曲线 (AUC) 下面积的几何平均值 (0% CI),由 Ig20Gly 剂量/体重归一化,在 58.9 (48.7-71.3) g * 天/升时相同。
最大浓度(Cmax)的几何平均值(95%CI)为9.08(7.46-11.1)g/l,表观清除率(CL/F)为1.93(1.71-2.19)ml/kg/天。达到最大浓度(Tmax)的中位(范围)时间为71.08(22.82-168.23)小时。
算术平均序列血清总 IgG 浓度第 2 期第 21 周。IgG,免疫球蛋白G。
Ig20Gly 治疗期间(第 2 期和第 3 期)的 VASBI 年发生率为每位患者每年 0.11 次事件(99% 置信上限:0.38)。在第 2 期的一名患者中观察到 2 例 VASBI(细菌性肺炎)(第 0 期的年发生率:13.1)。VASBI 通过药物治疗(包括抗生素)消退,无需住院治疗。在 Epoch 3 或 Epoch <> 中没有报告 VASBI。
Ig20Gly治疗期间(第2期和第3期)所有感染的年发生率为每例患者2.04(95%CI:1.04-3.56)。第 19 期 11 例患者中有 2 例感染(第 2 期的年发生率:2.48 [95% CI:1.34–4.13]),第 3 期未观察到感染。
在第 2 期感染的患者中,大多数感染的严重程度较轻(9 例);2例患者出现中度感染。第 2 期最常见的感染是鼻窦炎(3 例患者发生 2 起事件),其次是结膜炎和胃肠炎(2 例患者各发生 2 起)。
第 2 期的所有感染在研究期间均得到解决,但结膜炎的发病率(持续时间为 ~7.5 个月)除外,结膜炎在研究药物首次给药之前就已存在,因此研究者认为与 Ig20Gly 无关。该患者在进入研究之前有结膜炎病史。
在第 1 纪元中,接受 IVIG 治疗的患者的所有感染的年发生率为每名患者 1.65 次(95% CI:0.73-3.15)。第 1 期 <> 例患者中有 <> 例感染,最常见的是鼻咽炎(<> 例患者发生 <> 起)。
在对第 2 纪元的一名患者进行研究期间记录了一次住院治疗。该事件的发生是为了方便患者,而不是因为疾病或 AE。Ig20Gly治疗期间(第2期和第3期)的年人均急性护理就诊率为2.04(95%CI:0.78-4.24)。
第 18 期记录了 2 次急诊就诊(年率:2.35),第 1 期记录了 3 次急诊就诊(年率:0.61)。在研究期间的任何时候都没有急诊室就诊记录。
第2期和第3期使用抗生素的年化天数为5.38天(95%CI:2.10-11.02),第5期为87.95天(2%CI:32.11-93.2),第3期为07.95天(0%CI:37.10-74.3)。
在第 2 期和第 3 期中,总共记录了 38 天(第 22 期为 2 天,第 16 期为 3 天),其中患者因疾病/感染而无法上班/上学或进行正常的日常活动,发生率为每人年 4.09 天(95% CI:2.02-7.23)(第 2 期发生率:2.87;第 3 纪元率:9.82)。值得注意的是,一名患者在第二期最后一次就诊后住院8天被计为无法参加缺勤/缺课或第三期无法进行正常日常活动的天数。
在接受IVIG的患者的第1期中,急性护理就诊的年人均率为1.18(95%CI:0.38-2.68;记录了5次急性护理就诊)。第 1 期使用抗生素的年化天数为 4.01 天(95% CI:1.46-8.54),总共记录了 11 天患者无法上班/上学或进行正常的日常活动,比率为 2.60 天(95% CI:1.02-5.30)天/人年。
Ig20Gly的中位剂量在第2期和第3期稳定:110.0mg/kg/周,持续168.0天(范围:85.0-252.0天),108.7mg/kg/周,持续85.0天(范围:85.0-85.0天)。在第 2 期和第 3 期中,每次输注的输注位点数中位数为 1.2(范围:1.0-2.0)。
第 1 期施用的 IVIG 中位剂量为 127.7 mg/kg/周,持续 91.0 天(范围:90.0-92.0 天)。有关治疗给药参数的更多详细信息,请参见附表S2.按计划完成的输注中位百分比为 100.0%(范围:94.4-100.0%)。
由于输液系统(针头)渗漏,第 2 期只有一次输液中断,因此与耐受性无关。没有输注速率降低或停止输注的情况。
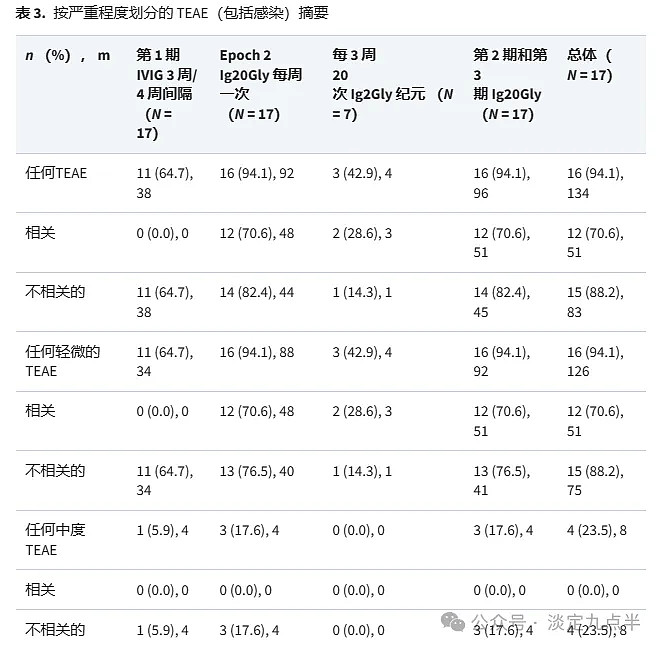
在所有时期,大多数TEAE,包括与药物相关的TEAE,都是轻度的,在研究期间没有观察到严重的TEAE(表3)。
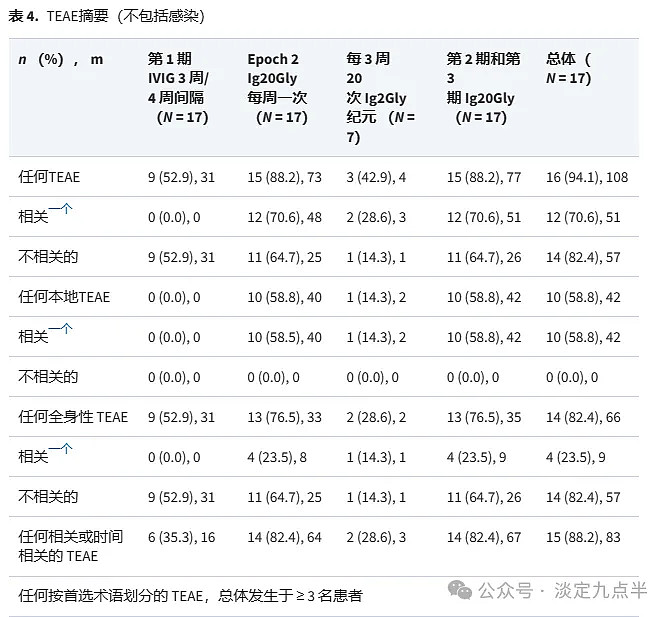
在所有时期(不包括感染)报告的 108 例 TEAE 中,第 77 期报告了 2 起事件,3 例 (15.88%) 接受 Ig2Gly 治疗的患者报告了第 20 期(第 2 期:73 例患者中有 15 起事件;第 3 期:4 名患者发生 3 起事件);其中,51例患者(12.70%)的6起事件被认为与研究药物有关(表4)。在第 1 期中,31 例患者报告了 9 例事件,其中 16 例被认为与 IVIG 治疗相关或时间相关。
没有报告严重或严重的TEAE。每个研究时期的持续时间如下:第1期(13周)、第2期(24周)和第3期(12周)。
Ig20Gly,免疫球蛋白皮下(人)20%溶液;IVIG,静脉注射免疫球蛋白;TEAE,治疗中出现的不良事件。
n 是经历该事件的患者人数;m 是事件数。TEAE 根据 MedDRA 24.0 版首选术语进行分类。每个研究时期的持续时间如下:第1期(13周)、第2期(24周)和第3期(12周)。
一个所有与药物相关的事件的严重程度均为轻度。
Ig20Gly,免疫球蛋白皮下(人)20%溶液;IVIG,静脉注射免疫球蛋白;MedDRA,监管活动医学词典;PPY,每患者年;TEAE,治疗中出现的不良事件。
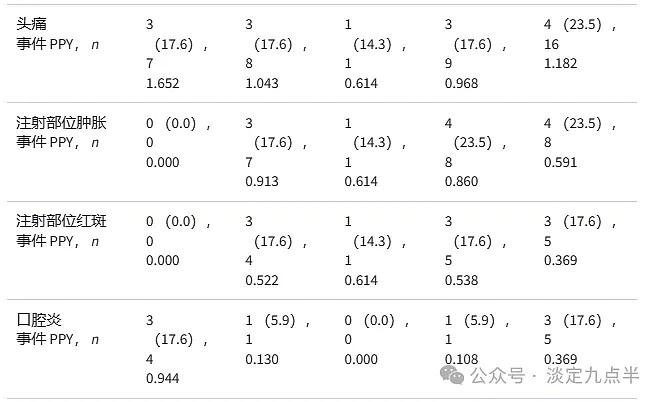
在第 2 和第 3 纪元中,55% 的 TEAE(不包括感染)是本地的(42 个中的 77 个)。Ig20Gly治疗期间最常见的TEAE是头痛(17例患者6例[0.968%];每例患者年23.5例)和注射部位肿胀(0例患者860例[2.4%];每例患者年1.17例),几乎所有事件发生在第6期(表1)。
在第 652 期(IVIG 治疗)中,所有 TEAE 均为全身性,其中最常见的是头痛(17 例患者 6 次事件 [0.944%];每例患者 20.<> 次)和口腔炎(<> 例患者 <> 次事件 [<>.<>%];每例患者 <>.<> 次事件)。在整个研究过程中,包括在Ig<>Gly治疗期间,没有发生死亡、严重TEAE或导致研究药物停药或停药的TEAE。
在比较基线和研究结束时,从 HRQoL 和治疗满意度问卷中获得的中位分数相似,分数在可能分数范围的上半部分。结果总结为附表3和表4.
在研究结束时,大多数患者(14 人中有 17 人)表示更喜欢 Ig20Gly 而不是 IVIG。在Ig20Gly治疗中,与自我管理能力和每月给药/治疗花费的时间相关的治疗方面是评价最高的方面(≥80%的受访者评价为“我喜欢它”或“我非常喜欢它”)(图2)。
在第 3 期结束时,十分之七的受访者表示有兴趣继续进行 Ig4Gly 治疗;在第 2 期结束时,所有受访者 (n = 20) 都表示他们希望继续。
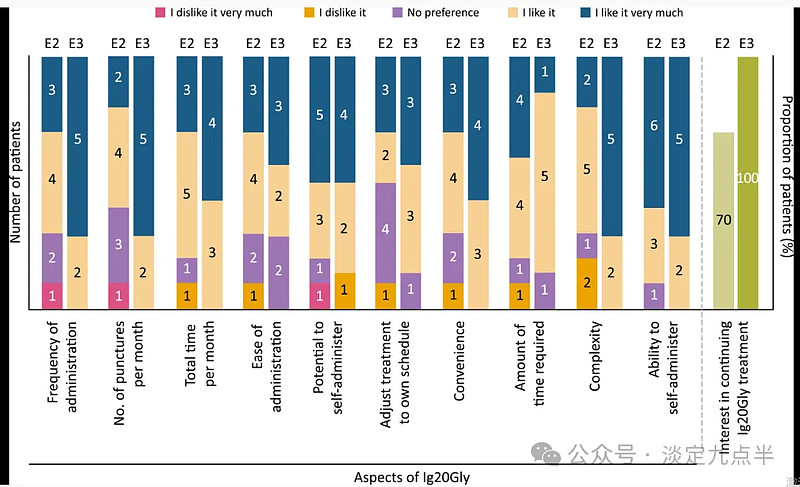
患者对第 20 期和第 2 期末 Ig3Gly 给药方面的偏好和满意度。E, 纪元;Ig20Gly,免疫球蛋白皮下(人)20%溶液。
本研究旨在评估Ig20Gly在日本PID患者中的药代动力学、安全性、耐受性和有效性,其结果与欧洲和北美的两项Ig20Gly关键性2/3期研究一致[11,12]。
当每周或每2周输注一次Ig20Gly时,血清总IgG谷水平超过预设的最小保护谷水平(纳入本研究所需的水平)5g/l[22],与第1期IVIG输注后观察到的水平相似。此外,在第 2 集第 21 周的每周给药间隔内,总 IgG 浓度保持稳定。
与证明维持保护性血清 IgG 谷水平的结果一致,本研究中的患者 VASBI 和所有感染的年发生率较低。
在 24 周的第 2 期(年率:0.13)中仅报告了 12 例 VASBI,在 3 周的第 0 期中没有报告,导致 Ig11Gly 治疗期间的 VASBI 总体年率为 20.2(第 3 期和第 20 期合并)。
VASBI的年化率计算为高于欧洲和北美的Ig2Gly 3/0期研究(分别为02.0和01.11)[12,17]。 然而,与以前的研究相比,本研究的样本量较小(24名患者),治疗时间更短(48周)(欧洲研究:52名患者,持续74周;北美研究:64例患者,持续68-11周)[12,1]。
因此,在当前研究中与这些关键试验相比,设置可比的统计功效水平或相似的样本量是不可行的,从而限制了比较的范围。第2期(IVIG治疗)和第2期所有感染的年发生率相似,第2期的年感染率(每例患者48.11例)与两项关键研究报告的感染率一致或更低[12,3]。
每 20 周给药一次 Ig2Gly 后,第 20 期未观察到感染。在日本人群中,年感染率也与先前报道的另一种20%SCIG的临床研究IgPro20(L-脯氨酸稳定的23%人皮下免疫球蛋白)相似或略低[3]。在IgPro20的3期研究中,患者每隔4-12周接受2次IVIG输注,然后按剂量等效转为每周输注SCIG,持续98周,年化感染率为21.23例(<>例患者评估)[<>]。
与两项关键研究相比,每周和每20周给予Ig2Gly的耐受性良好,没有出现新的安全性发现[11,12]。
在这项研究中,每次输注使用的输注部位的中位数较低:每周 Ig1Gly 输注 0.20 个,每两周输注 2.0 个。在研究期间,没有发生死亡、严重或严重的 TEAE,或导致研究药物停药或停药的 TEAE。
在耐受性方面,按计划完成的输注的中位数(范围)百分比为 100% (94.4-100.0%)。
在第 2 期期间,由于输液系统渗漏,仅发生过一次输液中断,而不是由于任何耐受性发现。第2期和第3期的大多数TEAE为轻度,头痛和输液部位肿胀是最常见的TEAE(不包括感染),这与关键研究的结果一致[11,12]。 药物相关局部TEAE的发生率在Epoch 2中最高,这在从IVIG转为每周皮下Ig20Gly后并不意外,在关键研究中也观察到类似的趋势[11,12]。 然而,局部TEAE的发生率随时间推移而降低,进入第3期(Ig20Gly每2周一次),与其他观察结果一致[24]。
关于HRQoL测量和治疗满意度,研究结束时(第2期和第3期)记录的分数通常与基线时观察到的分数相似,并且处于可能分数范围的上半部分。
这些结果表明,从IVIG切换到Ig20Gly后,患者的HRQoL和治疗满意度得以保持,尽管治疗时间短,难以确定随时间的变化。总体而言,治疗偏好更倾向于 Ig20Gly 而不是 IVIG 给药。
这些结果与两项关键研究的综合数据一致,即HRQoL的中位评分和治疗满意度指标仍处于可能评分范围的上半部分,患者更喜欢Ig20Gly而不是IVIG[25]。这些结果还补充了真实世界的数据,即患者在开始治疗后20个月对Ig12Gly表示总体满意,所有受访者均表示希望继续使用Ig20Gly[15]。
这项研究有一些局限性,应该注意。首先,由于日本人群中符合条件的患者数量很少,因此该研究的样本量很小。因此,统计分析是描述性的,而不是推论性的,由于统计显著性没有得到证实,应谨慎解释。尽管如此,就本研究的目标而言,基于可行性和申办者在IgG产品方面的经验,样本量被认为足以提供对谷水平和其他终点的可靠估计。其次,Ig20Gly在日本PID患者中的长期安全性和有效性尚未得到证实。这将在正在进行的推广研究(NCT04842643)中得到解决。
SCIG 通常每周给药一次。根据PK研究,每2周给药一次SCIG以维持保护性血清IgG谷水平是可行的[26];然而,关于两周给药的数据有限。
在这项 3 期开放标签研究中,达到了主要终点:每周或每 20 周输注 Ig2Gly 可维持成人和儿童日本 PID 患者的血清总 IgG 谷保护性水平。
低年感染率与血清总 IgG 谷水平维持在保护阈值以上一致,并且两种 Ig20Gly 给药方案都耐受性良好,输注部位数量少,并且未发现新的或意外的安全性发现。
HRQoL 评估和患者报告的治疗满意度和偏好结果显示,患者赞赏每周和每两周一次的 Ig20Gly 制剂提供的治疗灵活性和便利性,总体治疗偏好更倾向于 Ig20Gly 而不是 IVIG。
本研究由武田公司Baxalta US Inc.和Baxalta Innovations GmbH以及武田药品工业株式会社赞助。英国牛津 Oxford PharmaGenesis Ltd 的 Esmie Lynn Wescott 博士和 Jessica Donaldson-Jones 博士提供了医学写作帮助,并得到了武田制药国际股份公司的支持。