2022年天坛生物驻底迎来困境反转,建设进入阶段性收获期,浆站陆续投入。2022年基础上,2023年天坛生物是一个新的起点。
2023年在营浆站79家,24年目前80家。23年采浆增长18.67%,达到2415吨。约占国内行业总采浆量的 20%。可以推算79家浆站均产浆量30.6吨,23年净利润11.1亿。吨浆利润约计46万元。这个是大概,因为下年采浆量体现在今年上半年。
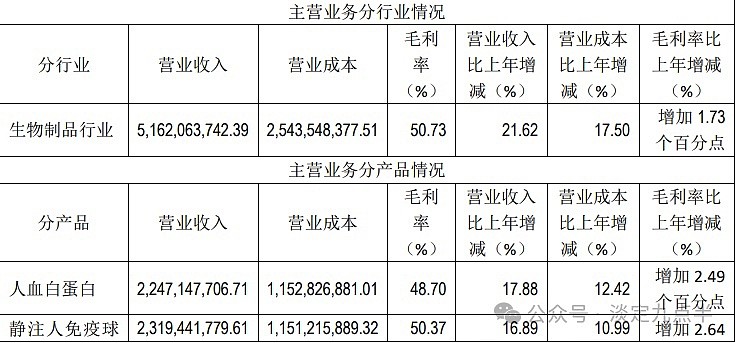
2023年营业收入增加21.57%。达到51.8亿。
2023年净利润增加25.99%。达到11.1亿
23年扣非净利润增加29.35%。达到11亿。
23年现金流增加112.575。达到23.9亿。货币资金达到45.55亿,存货25.44亿。存货都是现金流,可以这样理解。因为不愁收不到钱。
2023年净资产收益率11.11%。

2023年公司完成层析静丙上市,注射用重组人凝血因子Ⅷ的上市。体现在后续毛利率和净利率的不断爬坡阶段。
2023年,成都蓉生人纤维蛋白原和兰州血制人凝血酶原复合物处 于上市许可申请阶段;
成都蓉生皮下注射人免疫球蛋白、注射用重组人凝血因子Ⅶa 等研发课题 正在开展Ⅲ期临床试验;
成都蓉生注射用重组人凝血因子Ⅷ-Fc 融合蛋白和贵州血制人凝血酶原 复合物获得《药物临床试验批准通知书》。
报告期内,公司获得授权专利 22 项,其中发明专利 7 项,实用新型专利 15 项。
2023年,公司进一步完善管理体系,优化工程管理队伍,促进工程项目进展。
成都蓉生永 安厂区已投产运行并完成人凝血因子Ⅷ、人免疫球蛋白、破伤风人免疫球蛋白、乙型肝炎人免疫 球蛋白等产品的生产场地变更等工作;
上海血制云南项目完成工艺验证以及 MES、SCADA、DCS 系 统验收;
兰州血制兰州项目完成主车间(综合车间、分离车间)结构封顶、二次结构和部分安装;
成都蓉生重组因子车间项目、武汉血制血浆蛋白综合利用中试车间项目、贵州血制人凝血酶原复 合物中试车间改造项目完成竣工验收。
同时,公司加速血源数字化建设,已完成部分浆站云平台 项目部署和使用,助力浆站加速发展。加速提质增效。
2023年,公司积极推进血液制品项目国际合作和血液制品海外注册工作,完成静注人免疫 球蛋白(pH4)和破伤风人免疫球蛋白澳门上市备案和新产品主要出口注册资料准备;实现静注人 免疫球蛋白(pH4)、破伤风人免疫球蛋白、狂犬病人免疫球蛋白等产品出口。
2023年,公司以主业发展为导向,加强投资管理工作,持续关注所属企业投资需求,先后 完成临夏、西和、徽县、永靖 4 家浆站注册设立,
龙陵、巧家、永德、皋兰、永登和宜良 6 家浆 站增资等工作,为血源规模进一步扩大奠定基础,助力公司内生发展。
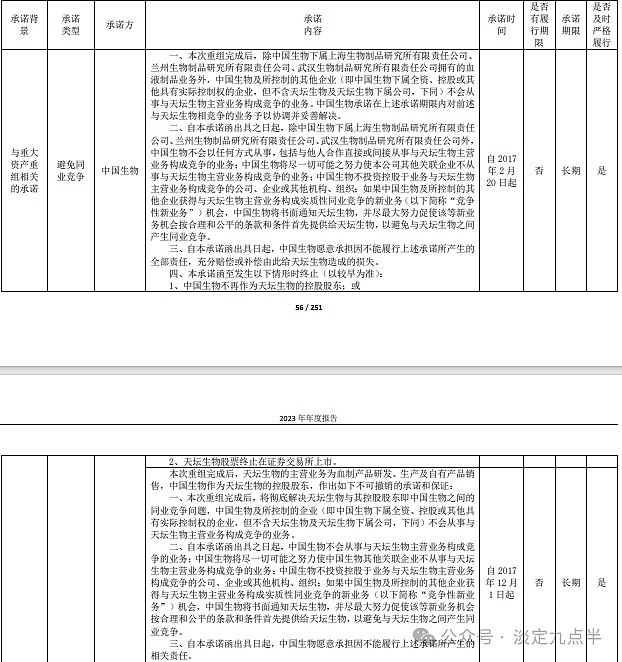
作为特殊时期的重要战略物资。

在血液制品行业发展过程中,世界范围内陆续发生血制品安全事件,各国政府逐渐加强了监 管,加之企业的兼并重组,全球主要血液制品企业从上世纪 70 年代的 102 家减少到不足 20 家(不 含中国),其中美国 5 家,欧洲 8 家,且营收排名前五位企业的市场份额占比为 80%—85%,行业 集中度明显。
我国血液制品生产始于上世纪 60 年代,至今已有近 60 年的历史。上世纪 60 年代末到 70 年 代,血浆蛋白的分离工艺开始由盐析法逐步过渡到低温乙醇法,分离技术也由离心法过渡到压滤 法。技术进步。
进入上世纪 90 年代,随着我国市场经济的发展,许多地方血站、各大军区下属血站及科研机 构也开始生产血液制品,生产厂家总数达到 70 家左右。随着国家卫生部明令淘汰冻干人血浆的生 产和禁止盐析法工艺的使用,大部分小型生产厂家被淘汰。淘汰。
1998 年,国家规定只有通过 GMP 认证 的企业才能生产经营血液制品。自 2001 年起,国家未再批准设立新的血液制品生产企业。截至目 前,国内正常经营的血液制品生产企业不足 30 家,按企业集团合并计算后户数约 17 家。垄断集中重组。全球才几家,中国还是多了点。
2017 年 12 月 20 日,国家食品药品监督管理总局发布了修订后的《生物制品批签发管理办 法》,以加强生物制品监督管理,规范生物制品批签发行为,保证生物制品安全、有效。未通过批 签发的产品,不得上市销售或者进口。
2019 年 12 月 1 日,新修订的《中华人民共和国药品管理法》开始施行,规定在一定条件下, 允许网络销售处方药,但疫苗、血液制品、麻醉药品、精神药品、医疗用毒性药品、放射性药品、 药品类易制毒化学品等国家实行特殊管理的药品不得在网络上销售;允许药品上市许可人委托其 他企业进行药品生产和经营工作,但血液制品、麻醉药品、精神药品、医疗用毒性药品、药品类 易制毒化学品不得委托生产。
2020 年 6 月 30 日,国家药品监督管理局发布《药品生产质量管理规范(2010 年修订)》血液 制品附录修订稿(2020 年第 77 号),提升了对血液制品企业生产管理负责人、质量管理负责人和 质量受权人的资质要求;要求企业定期开展实验室能力评估,确保实验结果准确、可靠和检验过 程信息记录的真实、准确、完整和可追溯;要求企业对所有投料生产的原料血浆,必须留样至相 应产品有效期届满后 1 年;要求原料血浆留样量应当满足规定病毒的核酸、病毒标志物检测及复 测等的用量要求,原料血浆留样使用的容器应当满足留样期间样品保存、信息标识等的需要。
2021 年 9 月 2 日,国家卫生健康委办公厅发布了《献血浆者须知(2021 年版)》,进一步加强 单采血浆站管理,保障献血浆者身体健康,保证原料血浆质量。
2021 年 12 月 10 日,国家卫生健康委发布了《单采血浆站基本标准(2021 年版)》,进一步加 强单采血浆站管理,提升单采血浆站质量标准及要求,确保血浆质量和献血浆者安全。
2022 年 3 月 2 日,国家卫生健康委发布了《单采血浆站质量管理规范(2022 年版)》,进一步 规范单采血浆站全面质量管理,提升单采血浆站血浆采集供应全过程质量标准及要求,保障血浆 质量和献血浆者安全。并结合血浆实验室检测相关工作要求,制定了《单采血浆站实验室质量管 理规范(2022 年版)》。
2022 年 6 月 28 日,国家卫生健康委组织制定了《单采血浆站技术操作规程(2022 年版)》, 进一步适应单采血浆站技术发展要求、规范技术操作流程、细化质量控制要求、提高原料血浆采 集技术规范化水平。我国对进口血液制品同样采取严格的管制措施,1985 年开始国家禁止除人血白蛋白以外的血 液制品的进口,
2002 年起禁止从疯牛病疫区进口人血白蛋白。为了缓解凝血因子Ⅷ供应紧张的局 面和满足血友病患者的用药需求,从 2007 年 11 月开始允许进口重组类人凝血因子产品。除此之 外,截至目前未开放其它血液制品的进口。
公司拥有完善的研发质量管理体系,持续加强新产品研发全生命周期质量管理,提升研发质量;公司对标国内外同行业先进企业,紧跟国际血液制品消费和技术发展趋势,具有明确的新品种开 发和新技术发展规划,
在重组人凝血因子类和人免疫球蛋白类产品研发领域保持国内同行业领先 地位的同时,密切保持对行业前沿创新的跟踪并进行前瞻性技术和品种的储备,
目前公司在研包 含血液制品和基因重组产品十余个;
公司创新采取集团化研发模式,通过内部技术共享合理布局 下属子公司科研品种,采用集中研发、分散注册的科研模式缩短研发时间,加速推进新产品研发 和产业化进程。
公司销售终端数量持续位居国内领先地位。公司坚定不移推进终端医院网络建设,扩大进入 终端的数量和比例,根据医院的学术影响力对医院进行分类,加强重点区域核心医院的进入和推 广工作。
目前,公司覆盖销售终端总数四万余家,已基本覆盖除港澳台地区外的各主要省市地区。
公司血液制品生产规模和设计产能持续保持国内领先地位。为实现可健康持续发展,进一步 扩大生产规模,
成都蓉生在四川省成都市天府国际生物城园区投资新建永安厂区,
上海血制在云 南省昆明市滇中新区投资新建云南项目,
兰州血制在甘肃省兰州市国家高新技术开发区投资新建 兰州项目,
上述三个血液制品生产基地设计产能均为 1200 吨,
产品包含白蛋白、球蛋白和因子类 产品,目前永安厂区已投产运行,
未来随着云南项目和兰州项目逐步投产,
公司将拥有三个单厂 投浆能力超千吨的血液制品生产基地,
并发挥协同效应,不断提升血液制品业务的经营质量和效益,打造中国领先、具有国际影响力、受到社会尊重的血液制品企业。
公司对标国际一流血液制品企业,紧跟行业相关前沿技术发展动态,持续完善研发管线布局, 建立了涵盖血液制品和重组产品较为完善的研发管线,
是目前国内血液制品行业唯一取得重组人凝血因子类产品上市许可的企业。
为保证新产品的研发进度,提升质量水平,公司成立了研发中 心统筹开展公司科研工作,配备了专业化的研发和管理团队,搭建了完善的研发质量管理体系, 对新产品开发、质量控制、注册申报和临床试验运营进行全链条标准化统筹管理。
公司围绕血友 病等罕见病、免疫缺陷、重症感染等领域形成多品种研发管线,
重点布局高浓度人免疫球蛋白、 血源性凝血因子、重组凝血因子、微蛋白制剂等新产品,并在重组人凝血因子类和人免疫球蛋白 类产品的研发领域保持国内同行业的领先地位。
公司董事会和经营层均深谙血液制品业务,多位成员是血液制品行业的资深专家,在各行业 协会及委员会担任重要职务,公司董事长杨汇川先生任中国输血协会副理事长、中国医药设备工 程协会副会长、轮值会长、第八届至第十二届国家药典委委员;
公司董事、总经理付道兴先生任 四川省输血协会第六届理事会副理事长、中华预防医学会生物制品分会第七届委员会常务委员;
公司董事、副总经理何彦林先生任中华预防医学会血液安全专委会委员、中华预防医学会生物制 品分会委员、中国输血协会常务理事、中国输血协会血液制品专业委员会主任委员。
公司及所属血制公司均配备了聚焦血液制品业务的经营管理团队,熟悉血液制品业务,管理 经验丰富,建立了比较科学有效的运营管理机制,有利于通过管理提升和技术共享等手段提升公 司的运营效率。
公司是中国最早形成血液制品工业化生产的企业之一,长期以来“蓉生”牌系列血液制品在 中国血液制品市场占有较大的市场份额,具有质量、安全性和品牌等综合优势,曾被卫生部誉为 “血液制品典范”,赢得了极高的市场美誉度;
上海血制“上生”品牌是上海市著名商标,在长江 三角洲和珠江三角洲一带具有较强品牌影响力,在全国享有盛誉,
上海血制人血白蛋白、静丙产 品被多次评为名优产品;武汉血制“武生”产品在中南地区、湖北、湖南、广东、广西等省份有 较高认可度,在全国有良好声誉;
兰州血制“兰生”品牌在西北地区、河南、广东、广西等省份 具有较高认可度;
贵州血制“卫士”牌静丙、白蛋白多次被评为名牌产品,在华东、华南和华中 等地区有较高的认知度。
公司两个高密度集成数字化工厂永安厂区和云南项目已分别完成投产和试生产,
实现生产全过程自动化、信息化、智 能化集成,质量和收率稳步提升;
血源数字化管理平台和浆站云平台完成系统测试和上线,促进 浆站在质量管理、智能设备、血源发展和信息交互不断优化,进一步提升浆站合规管理水平。
近 年来,公司重视数字化规划,持续加大对数字化项目的战略投入,进一步提升了生产自动化和管 理数字化水平,为公司高质量发展奠定基础。
销售费用 27,051.66 万元,同比增加 3.22%,主要原因为加大市场开拓带来职工薪酬、差旅 费同比有所增加。
管理费用 46,946.19 万元,同比增加 28.36%,主要为筹建期浆站费用、昆明血制部分转固折 旧、职工薪酬等同比增加。
研发费用 13,994.98 万元,同比增加 14.70%,主要为静注巨细胞病毒人免疫球蛋白项目停题, 前期资本化金额本期全部费用化。23年费用化资金1.1亿。资本化投入1.5亿!

长效重组人凝血因子8一期。
基因重组产品采用基因重组技术,不需要添加外源性血浆及其制品,产量不受原料血浆的限 制。目前市场上基因重组产品有重组人凝血因子 FⅦa、FⅧ、FⅨ和重组人血白蛋白等。
长效制剂是基因重组产品发展的重要趋势。以人凝血因子为例,当血友病患者接受预防性治 疗时,可以像正常人一样生活、学习和工作,平均生存期达到正常人水平。
由于凝血因子类产品的半衰期较短,从预防角度,要维持血友病人血浆中具有治疗作用的最低水平的因子浓度需隔天 用药(血友病 A),或每两天用药一次(血友病 B),患者用药的依从性较差;而长效制剂可以延长 产品的半衰期,提高患者的用药依从性。
基因重组产品将是行业的重要补充,但不会完全替代血液制品。
研究发现,基因重组产品更 容易产生抑制物,血源性凝血因子产品仍占到欧美主流市场 30%左右的份额;并且人免疫球蛋白 类产品本身为多种抗体的混合物,抗体多样性较高,且与人种及地域高度相关,开发广谱的重组 抗体难度较大。
因此,基因重组技术将作为行业的重要补充,并与血液制品行业一起快速发展。
上海血制云南项目:项目总投资 165,508.41 万元,占地面积 161.7 亩。截至报告期末,项目完成工艺验证以及 MES、SCADA、DCS 系统验收。报告期 实际支出 11,654.53 万元,累计支出 112,743.51 万元。
成都蓉生重组因子车间项目:项目总投资 49,614.41 万元。截至报告期末,项目完成竣工验收。报告期实际支出 6,713.18 万元,累计支出 33,700.03 万元。
兰州血制兰州项目:项目总投资 136,675.17 万元。截至报告期末,完成主车间(综合车间、分离车间)结构封顶、二次结构和部分安装。报告期实 际支出 32,302.63 万元,累计支出 49,948.74 万元。
2023 年度现金分红方案的制定情况 公司于 2024 年 3 月 27 日召开第九届董事会第九次会议,审议通过《2023 利润分配及资本公 积转增股本预案》,考虑股东利益和公司发展需要,公司拟以 2023 年年末总股本 1,647,809,538 股为基数,向全体股东每 10 股派发现金股利 1.5 元(含税),分红总金额 247,171,430.70 元(含 税),以资本公积每 10 股转增 2 股,转增股本 329,561,908 股。