
本文总结口服吸入疗法领域的基本药理学、制药学和临床方面,这些方面可能有助于科学家寻求开发新产品。
在对吸入治疗呼吸系统疾病的基本原理进行一般性评论之后,重点是大约在过去半个世纪中批准的产品。这些部分的组织反映了关键的药理学类别。
用于哮喘和慢性阻塞性肺疾病的产品包括β-2受体激动剂、毒蕈碱乙酰胆碱受体拮抗剂、糖皮质激素和巴豆酮及其组合。
然后介绍用于治疗呼吸道感染的抗病毒和抗菌吸入产品。对两种“粘液活性”产品——α道酶和甘露醇,均被批准用于囊性纤维化患者。
接下来是吸入前列环素治疗肺动脉高压的部分,以及气溶胶表面活性剂吸入递送的挑战性领域,特别是对于接受通气支持的早产儿。
还讨论了经肺全身输送用于中枢神经系统疾病和胰岛素治疗糖尿病的批准产品。分析了吸入给药的新技术,重点是那些可能比当前使用的技术产生重大改进或将扩大可通过这种给药途径治疗的药物和疾病的范围的技术。
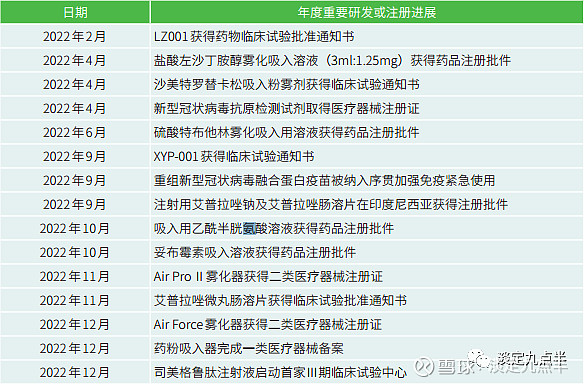
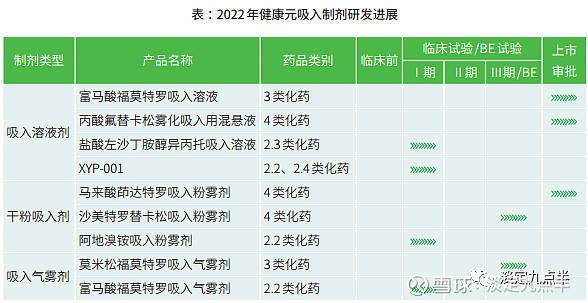
简单介绍国内领先者健康元吸入剂上市研发情况。
健康元呼吸科核心
呼吸系统疾病是我国仅次于心血管和糖尿病的第三大慢性疾病,患者人数超过 1.6 亿人。近年来,国内呼 吸疾病领域哮喘、慢阻肺等疾病的发病率持续增高。据统计,我国有近 4,570 万成人哮喘患者、1,500 万儿 童哮喘患者、1 亿 COPD 患者,然而 COPD 的知晓率远远低于《健康中国行动(2019-2030 年)》目标。
作为国内呼吸科药领跑者,健康元药业集团在呼吸科拥有丰富及优质的上市产品和研发管线。
其中,公司独家品种有
(妥布霉素吸入溶液)
(马来酸茚达特罗吸入粉雾剂已经申报临床国内无首仿)
(沙美特罗替卡松吸入粉雾剂已经申报上市国内无首仿)
(富马酸福莫特罗吸入气雾剂完成一期临床国内2.2类新药)
(盐酸左沙丁胺醇异丙托吸入溶液复方改良新药),
2022年的成就
2023年又新签了一个肺水肿 哮踹 吸入剂新药JRF106
全文引言
在过去的50年里,我们见证了现代呼吸系统疾病口服吸入治疗的出现。这些成为受影响患者必不可少且通常的主要药物治疗干预措施。虽然治疗性吸入的起源可以追溯到远古时代,但现代产品反映了半个世纪以来活性成分、配方和输送装置质量的变革性进步。本综述的重点是在此期间开发和批准的产品。
为了捕捉在此过程中积累的知识和经验的精髓,这些知识和经验导致这些疗法获得批准和普遍接受,本综述的贡献是由许多已批准产品开发的积极参与者撰写的研究论文供开发者科学家参考。
第二节提供了吸入给药的基本原理,随后在第三节中介绍了为该给药途径选择药物的典型标准、过程和方法。
吸入药物最常见的用途是哮喘和慢性阻塞性肺病(COPD)。这些疾病的主要药理学类别及其组合在第四至第八节中介绍。使用抗感染药物的呼吸道感染疗法将在第九节中讨论。
到目前为止,只有一种吸入蛋白被批准用于呼吸系统疾病 - 用于囊性纤维化的α道酶(重组人DNA酶)(第十节)。甘露醇是另一种用于囊性纤维化的“粘膜活性”药物,在第XI节中介绍。吸入前列环素是迄今为止唯一一类获批用于肺动脉高压的吸入药物(第XII节)。肺表面活性剂对呼吸机支持的早产儿的具有挑战性的治疗将在第十三节讨论。
对批准用于全身给药的口服吸入气雾剂产品(即不包括吸入气体)进行了审查(第XIV节)。由于这种疗法的原因与使用这种途径治疗呼吸系统疾病有很大不同,因此选择合适的候选药物、制剂和设备需要一种略有不同的方法。
未来的进展是必要的,以便通过吸入向更广泛的患者提供药物,并给予更多种类的治疗选择。该评价以成功经验为基础,并讨论了过去的缺点,以便就吸入给药的候选治疗方案的适用性提供一般性指导。本综述还介绍了可能使当今常用的配方和设备成为可能或改进的新技术(第XV节)。
事实上,在这篇综述中,我们经常利用本手稿所涵盖主题的大量文献,包括先前的评论。我们的主要目标是帮助决定吸入疗法的未来开发和批准,而不是对在此过程中所需的基础科学,工程和临床研究的所有要素进行详尽的审查。
例如,由于缺乏经过验证的呼吸系统疾病动物模型来研究吸入治疗的潜在候选药物的疗效,我们故意避免了这个话题,因为无法提供一般性指导。相比之下,吸入疗法的临床前毒理学检测要求通常遵循严格的监管指南。
有关于这些主题的出版物,但感兴趣的读者还应查阅与所考虑的特定类型的产品相关的当前监管指南(例如,小分子,生物制剂或尼古丁产品,目前需要略有不同的临床前毒理学测试与使用先前批准的药物的药物产品,这些药物通常具有一些简化的毒理学要求 具有新的化学实体)。
试图捕捉口服吸入疗法的许多令人兴奋的发展,例如临床前和临床试验阶段的新实验疗法,将远远超出本综述的范围。
为什么需要吸入性药物?
人类需要持续呼吸含有氧气的空气才能生存。呼吸道是人体唯一一个我们保护它免受环境不断侮辱的能力有限的器官。与被视为理所当然的清洁水是每个人必不可少的物品不同,到目前为止,空气质量的控制并没有以同样的方式看待。
人类呼吸道有一个复杂的多层系统,可以防止不受欢迎的访客:鼻咽和口咽以及分支气道充当过滤器,特别是对于较大的颗粒,并进一步由粘膜纤毛清除系统帮助去除沉积的颗粒。巨噬细胞和其他内吞细胞也能够清除和消化成功穿透早期屏障的潜在有毒进入者。当呼吸道中的保护机制超负荷,对新的挑战毫无准备或以某种方式受到损害时,呼吸道疾病可能会随之而来。
呼吸道具有高度发达的免疫系统,与淋巴管和血液循环相连。它还具有去除有毒物质的代谢能力。然而,主要通过吸入传播的SARS-CoV-2病毒的快速传播是最近最明显的例子之一,说明我们的呼吸道是多么脆弱。由于多种原因,呼吸系统疾病在受影响个体的绝对数量以及总体疾病负担中所占的比例都在上升,包括人口老龄化、空气污染以及特别是呼吸道感染的国际旅行便利性(国际呼吸学会论坛,2017 年)。
由于人体肺部仅占身体的相对较低的质量(成人通常为1公斤),因此通过口服或静脉内给药治疗呼吸系统疾病可能不是很有效,并且可能需要全身剂量,除非血液和肺组织之间存在非常有利的分配,否则在脱靶位置引起副作用。事实上,由于内皮和上皮屏障对大分子的渗透性差,在气道腔内达到足够浓度的大分子(如蛋白质)可能不可能通过吸入以外的任何其他途径。
一般来说,吸入药物可以快速和“无创”地输送到呼吸道,并且可能在那里产生有益的治疗效果,剂量导致对身体其他部位的低暴露,以尽量减少全身不良反应。事实上,在后续章节中介绍的许多知识已经积累了关于吸入给药药物的“理想”特性的知识。
因此,吸入治疗呼吸系统疾病作为首选给药途径用于以下一个或多个原因:
1)治疗剂不能在肺中达到足够的浓度。这方面的一个例子是蛋白质药物重组人脱氧核糖核酸酶(多糖酶α)用作治疗囊性纤维化的吸入剂(第十节)。
2)当以达到肺中治疗浓度的剂量给药时,治疗剂具有显着的全身毒性。例如氨基糖苷类抗生素(第九节),其中有效的吸入剂量明显低于必须全身给予但会导致长期给药的严重全身副作用的等效剂量。
3)该药物口服生物利用度差,因此需要注射以在肺部发挥其作用。吸入氨基糖苷类(第九节)、克罗米酮类(第八节)和肺表面活性剂(第十三节)就是这样的例子。
4)需要快速起效,例如使用短效支气管扩张剂(第四节)。
可能还有另一个原因 - 如果在肺中实现治疗效果的全身递送需要经济上不可行的剂量,例如对于大分子(例如,肽,蛋白质,RNA和DNA疗法),这些大分子通常在血液和肺室之间显示较差的运输效率。
当然,在开始开发吸入产品(第三部分)之前,需要仔细考虑,特别是相对于大多数人首选的口服摄入途径,或方便的长效注射剂型,对某些患者来说可能是一种更具吸引力的替代方案。
如本综述以下各节所述,口服吸入产品的开发存在技术和生物学限制(第三节)。一些挑战正是因为“外来”颗粒进入的先天障碍及其降落在呼吸道后的处置。
其他与呼吸道中某些类型分子的刺激和长期毒性的非特异性和特定原因有关。例如,咳嗽是一种常见的防御机制,也是吸入药物的常见副作用。
吸入产品比口服或透皮剂型使用起来更复杂。因此,在选择吸入途径而不是其他替代方案之前,需要采取明智的方法。不同类型的设备有不同的使用说明,这可能会令人困惑,特别是对于使用多种不同吸入设备的患者。
几十年来,不依从正确使用吸入装置(包括正确的呼吸方式)一直是一个挑战,总体不依从性约为50%。另一方面,这也是开发新吸入系统的绝佳机会,通过创新的配方和设备(第XV节),包括具有电子设备和网络连接的配方和设备,包括具有电子设备和网络连接的配方和设备,使它们减少对人的灵活性的依赖。
这里特别值得注意的是故意使用吸入途径来施用药物以获得全身效应(第十六节)。在这里,吸入途径的选择需要有更高水平的审查,因为竞争格局通常要大得多,如果肺毒性风险超过无创递送的益处或比口服途径更好的生物利用度,呼吸道和身体其他部位之间的浓度比成为一个劣势。然而,历史上已经取得了不可否认的成功,最引人注目的是吸入麻醉剂的使用。
本综述中关于批准用于各种呼吸系统疾病的口服吸入产品的章节作为治疗方法的例子,其中时间的测试证明它们是有价值的药物。
鉴于世界各地呼吸系统疾病的巨大且不断增长的负担,当吸入管理对目标患者群体最有意义时,从未像现在这样需要开发新的或改进的吸入疗法。
口服吸入药品治疗呼吸系统疾病的关键属性
A:
与全身给药的药物相比,吸入药物产品可能对治疗呼吸系统疾病具有显着益处。
由于局部活性吸入药物的理想药物和药物产品属性在许多方面与口服药物产品不同,因此当药物分子专门设计用于吸入途径时,这些益处才能最好地实现(例如,波恩和佩里,2021 年)。
然而,有几个药物被成功地“重新用于”吸入以提高治疗呼吸系统疾病的疗效和安全性的例子(例如,见吸入抗感染药,第九节)。还有一些药物(通常是生物分子)的例子,其中低口服生物利用度需要吸入给药(例如,第八节和第十节)。
本节重点介绍用于治疗局部呼吸系统疾病的口服吸入药品的理想药物和药品属性。重点是那些所需特性不同于“理想”口服摄入药物的特性,或者这些特性的表征需要特定的技术或考虑因素的属性。
此外,还简要讨论了优化吸入药物和药品的策略以及表征关键药物和药品属性的技术。在此背景下,特别强调新兴技术,例如用于表征吸入药物产品性能的临床相关测试方法,以及使用计算工具来帮助优化药物和药物产品性能。
B:
候选药物靶标谱的定义可被视为通往新吸入药物的第一步。
实际目标以及在某种程度上实现目标特性的策略不仅必然取决于首先选择吸入的具体原因(第二节),而且还在很大程度上取决于治疗目标、药物类别和预期患者群体。
在现阶段,考虑增加目标,解决现有药物输送系统造成的任何限制也是明智的。这些限制可能与防潮不足、需要与关键赋形剂和包装材料相容有关(de Boer 和 Thalberg 2021a,b,c)。
正如 Bonn 和 Perry (2021) 所概述的那样,设计用于局部治疗的吸入化合物旨在最大限度地提高局部暴露,同时最大限度地减少全身暴露。
为了实现这一目标,吸入药物最好具有以下属性:1)保留在肺中以优化局部暴露并提供合理的给药方案,2)高效能以限制对高治疗剂量的需求,以及3)低口服生物利用度以减少全身暴露(表1)。
这些特性和实现它们的原理通常与口服给药药物的特征直接相反(Lipinski等人,2001)。例如,新型吸入药物[例如,维兰特罗(Procopiou等人,2010)和糠酸氟替卡松(Biggadike等人,2008)]被故意设计为代谢责任,严重降低口服生物利用度,以限制吞咽剂量的全身暴露。因此,吸入药物与Lipinski等人(2001)提出的口服药物相比,具有略微不同和分布更广泛的物理化学性质空间。

表1中列出的最重要的关键属性,也可能是建立新型吸入药物最具挑战性的是肺潴留。
如表1所示,肺潴留可以通过多种机制实现。其中一些,主要是缓慢溶解和强烈的组织相互作用,倾向于降低游离药物浓度,有利于高效药物。新型β2 受体激动剂具有,例如 EC50纳摩尔范围内的值(Procopiou 等人,2010 年)。
低渗透性也会增强低溶解度和组织相互作用的影响。例如,Shaw等人(2016)推测,低通透性与碱性胺引起的组织相互作用相结合是一系列血小板衍生生长因子受体抑制剂肺潴留的关键因素。
有趣的是,低渗透性也导致大分子的停留时间很长,例如蛋白质,抗体以及基于DNA和RNA的药物(Adjei和Gupta,1997)。此外,通过适当选择形成非共价离子对的反离子增加极性表面积,渗透性可能会降低(Dutton等人,2020)。
最终,优化肺潴留的策略的选择与可用的化学型和靶标的位置密切相关。例如,低通透性将药物保留在管腔中,因此可能有利于抗菌剂等药物,而它可能对糖皮质激素受体等细胞内靶标有害。
在先导物优化期间,用于筛选靶标亲和力、代谢和毒性的候选药物化合物的体外工具类似于应用于全身活性药物的工具。然而,旨在评估局部疗效和PK以及局部安全性的临床前动物模型的不同之处在于它们通常需要局部给药药物。因此,气道中的局部浓度不仅取决于给药的总(身体负荷)剂量,还取决于药物的分布。
正如最近的一篇综述(Sécher 等人,2020 年)中所讨论的那样,没有动物模型可以完美地模仿人类疾病、生理学、解剖学,甚至任何相关的临床药物管理技术。这可能导致药物沉积特征的差异以及溶出率、粘液纤毛清除率和渗透率的物种差异(Sécher 等人,2020 年)。例如,虽然吸入可能使人类肺部区域具有临床相关性最高的药物分布,但只有一小部分[在大鼠中通常为10%(Phillips,2017)]吸入剂量到达肺部。
其余的沉积在大鼠鼻子区域,将从鼻子吸收或吞咽,因此可用于胃肠道吸收到血液循环中。直接向动物肺部给药可避免此问题(例如,通过滴入气管),但可能会产生与临床相关性较低的肺部分布模式相关的其他困难(Phillips,2017)。
此外,一些技术,例如气管内滴注,需要对动物进行镇静,这可能会改变肺中吸收和非吸收清除过程的功能(例如,Wollmer等人,1990)。当然,这限制了它们的预测性,并表明必须仔细考虑疾病模型和物种以及给药技术的选择。
难溶性药物的处置通常对药物的状态(结晶,无定形或溶解),其比表面积(粒径)和剂量与溶解度比[剂量数(Amidon等人,1995)]敏感。因此,例如,啮齿动物在肺部剂量大大超过等效人类剂量的呼吸道中的高局部固体药物浓度可能会导致临床剂量下人类中不存在的伪影,其中药物可能在肺部有足够的液体溶解。
综上所述,这些挑战需要仔细设计先导物优化和临床前安全性评估计划以及用于将临床前数据成功转化为临床环境的测试模型。
最后,成功的吸入治疗不仅要求药物具有耐受性、安全性和有效性,而且还要求它与合适的输送系统兼容。这通常在选择用于临床开发的候选药物之前进行评估。在这个阶段,重要的是要考虑目标患者群体(例如,他们的吸气流速和肺容量),预测的治疗剂量,商业限制和机会以及可用的设备和配方平台(例如,知识产权和障碍和机会以及内部能力)。
例如,在干粉型吸入装置中给药的药物应优选与可用的制剂和工艺相容(例如,粒径减小)。这可能包括考虑剂量限制以及影响固体药物化学和物理稳定性的因素(例如,赋形剂兼容性、熔融/玻璃化转变温度、湿度的影响)(Shetty 等人,2020 年)。
总之,设计用于吸入典型治疗的药物与设计用于全身治疗的药物的关键药物属性靶点不同。通过优化控制高肺潴留、最佳靶点相互作用和低口服生物利用度的药物和制剂属性,获得高效力和效果持续时间以及局部安全性和耐受性。
局部给药后,在体外和动物模型中对这些特性进行临床前评估。因此,将临床前结果转化为临床环境必须考虑临床前和临床吸入装置和配方之间的差异。
理想情况下,临床前测试计划中使用的配方应与临床计划中使用的配方相似。然而,对于更复杂的配方,这通常是不可能的,因为现阶段可用的物质量有限。然后,应制定科学合理的桥接策略,以确保在发育过程中使用不同配方获得的数据对人类发育有效。
此外,应仔细考虑候选药物与预期商业吸入装置之间的相容性,并且由于吸入装置的性能可能取决于制剂的详细特性,因此鼓励尽早决定装置-制剂组合。
C. 关键药品属性和开发过程中需要考虑的要点
一旦根据适当的药理活性选择了合适的候选药物分子,以适合吸入的形式制备,并且发现在动物中是可耐受和安全的,临床开发阶段就开始了。
显然,它需要在这个阶段适合向人类吸入输送。临床项目目前通常是一个漫长的过程,从评估患者的治疗效果、剂量反应和给药方案来评估人类的药物耐受性开始,到患者的大型安全性研究。在此过程中,必须开发和测试临床上合适的测试产品,最终产生最终的商业产品。
后者还涉及旨在了解患者使用和患者对预期产品使用的依从性的测试和研究(FDA,2016)。因此,必须确定患者的具体目标人群(例如,患有重度哮喘的成年患者)。
口服吸入产品与口服摄入产品(如片剂)的总体监管策略的一个关键区别是,目前没有普遍同意的方法在吸入产品开发的不同阶段使用的配方和设备之间架起桥梁。
它们与其他剂型的共同点是,吸入产品具有控制患者剂量数量和质量的属性和规格限制,包括其在交付过程中的化学和物理特性以及产品的保质期。
然而,如表2所示,吸入产品在剂量和性能属性的评估方面具有特定的关键要求。所有吸入器产品的共同点是它们产生的气溶胶至少在某种程度上能够到达肺部,从而在治疗靶点可用。
决定治疗相关剂量的肺剂量和剂量沉积模式取决于气溶胶的空气动力学粒径分布 (APSD) 和患者吸入曲线。APSD密切取决于配方,吸入装置以及大多数产品受试者的吸入操作之间的相互作用。
因此,控制剂量不仅包括对给药剂量(身体负荷剂量)的评估,还包括对治疗可用剂量的表征和控制。后者在吸入方面是独一无二的,在实践中由APSD规范控制(在标准化条件下由级联撞击器测量)。因此,如上所述,即使维持身体负担剂量,任何产品成分(设备和配方)的改变都可能改变治疗剂量。
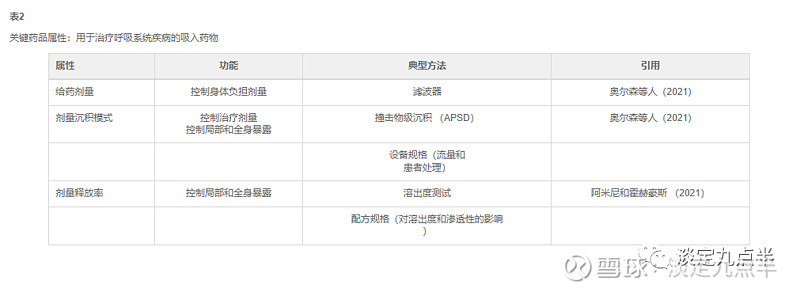
此外,正如 Amini 和 Hochhaus (2021) 最近的一篇综述所概述的那样,越来越多的证据表明,吸入难溶性药物(例如一些糖皮质激素)后的局部和全身暴露不仅取决于治疗剂量,还取决于活性药物的溶出速率。评估吸入气溶胶溶出速率的方法尚未标准化,必须开发适合目的的方法。
为商业产品选择合适的吸入平台是一项复杂的工作,需要平衡临床考虑因素(患者特征和需求)、商业方面(例如成本、开发风险/时间和营销考虑因素)、技术可用性(知识产权和内部能力)、区域监管要求,当然还有药品特性(例如,剂量大小和稳定性)。
吸入产品输送技术大致可分为干粉吸入器 (DPI)、加压计量吸入器 (pMDI) 和雾化或软雾水性制剂(de Boer 和 Thalberg 2021a,b,c)。
呼吸驱动DPI广泛用于治疗呼吸系统疾病。DPI的发展部分是作为基于氯氟烃(CFC)和氢氟烷烃(HFA)推进剂的pMDI的用户友好型替代品,并克服了协调pMDI驱动和灵感方面的一些困难。三种主要的DPI系统是基于胶囊的预计量单剂量装置,多单位剂量吸入器(工厂计量)和多剂量吸入器,其中患者激活一种内置机制,从粉末储库中计量出一定剂量的粉末制剂(Usmani,2019)。
Aerolizer(例如,Breezehaler,Novartis)和RS-01 Monodose,Plastiape的低电阻Cyclohaler(Plastiape),是原始基于胶囊的Cyclohaler(Pharmachemie)的几种改进。最初的Diskhaler或“双盘”Ellipta吸入器装置(Glaxo)是广泛使用的工厂填充多剂量吸入器以及后来开发的Diskhaler的许多仿制药。Turbuhaler(阿斯利康)是1980年代中期第一个广泛使用的多剂量储罐吸入器装置,随后开发了其他几种此类装置,每种装置都有或多或少独特的技术解决方案(例如,EasyHaler,Orion)。
计量吸入器 (MDI)(例如,Ventoline Evohaler、葛兰素史克),虽然在技术上与 1956 年首次投放市场相同,但似乎仍被视为哮喘和 COPD 等主要呼吸系统疾病的一线治疗(报告 Linker/美通社,2020 年)。体积小,使用方便是影响这些设备广泛使用以及相对较低的成本和药物广泛可用的因素。然而,传统的pMDIs被认为在将药物输送到肺部方面效率相对较低,部分原因是患者的错误。
基本上,这些缺点仍然存在,尽管对这类装置进行了许多修改,从改进阀门机构及其材料到涂覆罐内部以及使推进剂适应当前的环境要求。引入吹嘴扩展,例如垫片和带阀门的保持室,例如AEROCHAMBER PLUS FLOW-VU 室(Trudell Medical),以消除按压-呼吸顺序程序的不协调,包括它们在儿科人群中的使用。
此外,呼气驱动吸入器,例如Autohaler(3M Pharmaceuticals)吸入装置,出于同样的原因被引入,但具有与传统pMDI一样便携的优点。在AutoHaler之后,已经进行了各种技术创新,旨在提高患者在按压-呼吸过程中的依从性,要么控制吸入的流速,要么仅在MDI被按下时允许吸入的空气流过触发机制。
喷射雾化器是由全球使用的压缩空气驱动的最常见的大容量气溶胶水发生器类型,在目前销售的设备中,大多数是用由同轴管组成的喷射喷嘴构成的。其中一些设备是呼吸增强雾化器(BAN),例如PARI LC PLUS(PARI GmbH);这些在呼气期间减少气溶胶输出,并在吸气时增加气溶胶输出。从外管,溶液或悬浮液通过中央压缩空气喷嘴产生的负压从储液罐中吸入,用于随后的雾化。呼吸驱动雾化器(BAN)是呼吸驱动雾化器(BAN),例如AeroEclipse,Trudell Medical International(Suggett等人,2014)。
后来出现了被称为软雾吸入器(SMI)的低速喷雾剂。这些装置代表一类多剂量吸入器装置,含有类似于雾化器中的液体制剂。使用了各种原理,如超声波、振动网格和其他几种新颖的方法。其中许多设备能够实现非常高的肺沉积。2004年在欧洲推出了一种便携式软雾吸入器(Respimat,勃林格殷格翰),用于治疗哮喘和慢性阻塞性肺病,以取代相同药物的CFC pMDI或DPI产品(Newman,2006年)。
在这三类中,在药物的加工和配方方式以及为预期用途选择的设备设计方面存在重大选择(de Boer 和 Thalberg 2021a,b,c)。为了平衡开发风险,一些公司确实更喜欢使用简单的现成交付系统和易于理解的配方技术,前提是它们合理地满足医疗需求和商业驱动因素。相反,技术配方和设备创新是由必要性驱动的(例如,改善患者对精确区域肺部给药的需求,例如吸入胰岛素或竞争性商业压力)。
展望新的治疗领域和新型药物类别(例如生物分子),技术创新可能变得更加重要,以满足其开发的非技术驱动因素。然而,考虑到大量已获批准并成功商业化的口服吸入药物产品,吸入途径的新药可能会使用现有的配方技术和设备,同时牢记上述非技术开发驱动因素的重要性。
D. 支持药物产品开发的机制计算模型
应用统计定量结构 - 活性关系模型来了解肺处置的分子驱动因素已经建立(参见,Edwards等人,2016)。然而,定量结构-活性关系模型不太适用于理解产品性能,因为这必须结合药物分子属性、药物材料特性(溶解度)和药物产品属性(如剂量沉积和溶出速率)以及受试者生理学(例如,年龄和疾病状态)的信息。因此,应用基于生理学的药代动力学(PBPK)模型可以更好地了解临床开发过程中支持转化科学的产品性能。
近十年来,支持和降低口服吸入药物临床开发的计算模型取得了重大进展(Bäckman等人,2018)。在很大程度上,这也要归功于最近开发的体外和离体方法,以提高为模型提供信息所需的属性的可预测性。
例如,今天,可以通过添加现实的口喉复制品的传统质量控制方法并结合真实的呼吸剖面来测量临床相关的输送剂量的空气动力学粒径分布(Olsson 等人,2013 年,2021 年)。 同样,已经开发了测量假定沉积在肺部的递送剂量部分的溶出动力学的方法(Price等人,2018 年,Bäckman 和 Olsson,2020 年)。
使用分离的灌注肺和其他离体方法,已经实现了对通透性和与肺组织结合的改进估计(Bäckström等人,2016;埃里克森等人,2018 年;贝克斯特伦和弗里登,2021 年;恩洛-斯科特等人,2021 年)。与此同时,专注于可测量产品属性与生物学之间机制关系的计算模型继续先进(Himstedt 等人,2021 年)。
与回归统计模型相比,这种PBPK模型具有优势,即模型的参数反映了物理特性,这些物理特性通过从独立知识中得出的机制关系与局部和系统暴露定量相关。理想情况下,将来此类模型将不包含拟合参数,尽管不应低估呼吸道的复杂性,包括受试者间变异和疾病影响。
口服吸入药物的PBPK建模是一门相对年轻的学科,发表的应用很少。大多数文献都集中在单一药物或药物类别上,并且具有半经验性质(即,并非所有过程都以机械方式描述)(参见 Himstedt 等人,2021 年及其中的参考文献)。
在公开可用的更普遍适用的模型中,Mimetikos Preludium PBPK模型(Emmace Consulting AB,瑞典隆德)(Olsson和Bäckman,2018)专门针对口服和鼻腔吸入药物。它是半机械的,因为它提供了所有肺PK过程的完全机械描述,而系统性倾向则由经验区室PK模型表示。
GastroPlus肺腔室吸收和运输模块(Simulations Plus,Lancaster CA)是另一种用于口服吸入的商用通用PBPK模型。系统性倾向可以建模为经验PK隔室或完全机械模型。
沉积模型是现已过时的ICRP66模型,但是可以手动指定各个肺部区域的沉积分数,例如,从MPPD软件[Applied Research Associates,Inc.(ARA),Albuquerque,NM]估计(Miller等人,2016)。不幸的是,带有PK-Sim和MoBi(德国勒沃库森拜耳公司开放系统药理学套件)的非常全面的开源PBPK套件并未专门包括吸入给药模块。但是,MoBi软件允许用户实现此类模块(Eriksson等人,2020)。
此外,例如,一些制药公司拥有内部PBPK软件。阿斯利康的Lung-Sim(Tehler等人,2018年),辉瑞公司的PulmoSim和默克公司的“肺平台”(Cabal等人,2016年)。
为简单起见,通知PBPK模型所需的属性可以分为三类(例如,Bäckman和Olsson,2018):
1) 批次和产品特定属性(例如,递送剂量、空气动力学粒径分布、溶出动力学、吸入流量曲线和推注剂量曲线)。属性应被视为特定于批次还是特定于产品取决于批次间差异对产品性能的影响。
2)药物特异性属性,取决于溶液中药物的分子特性(例如,渗透性,组织结合,系统药代动力学)。
3)特定人群的属性(即,例如,性别,年龄和疾病如何修改前两个类别的属性)。
从PK的角度来看,对治疗影响最大的产品性能属性是肺剂量和释放速率。初始肺剂量可以通过肺沉积模型从递送剂量和空气动力学粒度分布得出(Miller等人,2016;奥尔森和贝克曼,2018年;霍夫曼,2020 年)。
初始肺剂量通过吸收性和非吸收性(例如粘液纤毛)清除机制之间的竞争而消除。释放速率可以从实验溶出曲线中得出,并根据诺伊斯-惠特尼类型函数建模,以推导出可用于PBPK模型的参数,例如可用于溶出的初始比表面积的分布(Bäckman和Olsson,2020)。请注意,有效的治疗肺剂量和释放速率可能受到导致和包括血浆清除的每种途径的影响,并且这些途径的动力学是相互依赖的,导致系统在控制参数方面本质上是非线性的,但当一个过程占主导地位时可能显示线性。
对特定人群属性的影响探讨较少。Bäckman和Olsson(2016)使用PBPK模型来了解哮喘患者(与健康受试者相比)丙酸氟替卡松全身暴露减少的根本原因(Brutsche等人,2000;哈里森和塔特斯菲尔德,2003)并发现这可以解释为由于气道收缩引起的中心沉积较高而导致哮喘患者的非吸收性清除率增加。尽管文献中没有观察到使用PBPK建模来理解与年龄相关的差异(例如,儿童与成人)的例子,但不存在技术限制,因为PBPK模型适用于任何指定的肺生理学和形态测量。
在口服吸入药物的开发中有几个领域可以从PBPK模型的应用中受益。例如,要判断测试和参考产品之间的生物等效性(BE)(请注意,测试可以是创新者开发,也可以是通用产品),通常需要PK-BE研究,这是一项昂贵的努力,在最终成功之前容易失败(例如,Lähelmä等人,2015)。使用相关的PBPK模型,研究人员可能能够评估成功的可能性并采取适当的行动(继续进行临床研究或继续开发机械推导的假设)。最终,经过验证的PBPK模型的结果将来可能足以声明PK-BE或不声明PK-BE。另一个例子是,当目标不是参考产品而是所需的产品性能配置文件时。
在这里,相关的PBPK模型可以通过灵敏度和假设分析提供有关设备和配方变化对产品性能影响的宝贵见解。此外,相关的PBPK模型可以促进临床研究的规划,例如,通过预测在什么剂量水平下,渗透性和溶出度有限吸收之间会发生潜在的非线性转变。最后一个例子是,PBPK模型可以通过为调查提供结构化框架来促进对PK研究中意外发现的解释。
我们只强调两个成功应用基于生理的建模的例子。第一个例子显示了丙酸氟替卡松对Advair Diskus不同强度的溶出动力学的细微差异如何转化为全身PK的差异,表明系统性PK能够反映上游局部过程(Bäckman和Olsson,2020)。第二个例子显示了肺上皮下沙丁胺醇的局部游离浓度如何预测吸入和口服给药后药效学反应(支气管扩张)的程度和时间过程,证明了PBPK模型预测肺组织中游离药物浓度的有效性(Boger和Fridén,2019)。
综述
与设计用于全身治疗的药物相比,设计用于吸入典型治疗的药物的关键药物属性靶点不同。通过优化控制高肺潴留、最佳靶标相互作用和低口服生物利用度的药物和制剂属性,获得高效效果持续时间以及局部安全性和耐受性。
将临床前结果转化为临床环境必须考虑临床前和临床吸入装置和配方之间的差异以及物种之间的生理和解剖学差异。此外,应仔细考虑候选药物与预期商业吸入装置之间的相容性,并且由于吸入装置的性能可能取决于制剂的详细特性,因此鼓励尽早决定装置-制剂组合。
新兴的基于计算机的机制PBPK模型显示出将药物属性(例如,渗透性和组织相互作用),产品属性(例如,剂量,剂量沉积和溶出)和人群特异性属性(例如,年龄,疾病)的影响综合成对体外 - 体内关系的合格理解的潜力,可以支持转化科学和产品设计,从而降低临床开发过程的风险。
以下信息请注意!
公众号文章系个人投资个人爱好,文章不作为需求推荐使用或者投资者作为建议。如有错误请谅解。如有侵犯版权请私信联系处理。谢谢。