作者:白小喵 咸达数据
摘要:
本周有5个1.1类化药进入审评阶段,此外还有2个进口单抗首次在国内申报临床;
6个1.1类化药获批临床,最近国内企业1.1类化药获批临床不少,研发实力增加的同时,希望这些1.1类药物真的能真正批产,用于患者。
导读:
1.浙江海正药业申报1.1类化药DTRMWXHS-12胶囊;
2.湖南有色凯铂生物药业申报1.1类化药美他非尼片;
3.贵州恒顺药物研发有限公司首家3.1类申报甲磺酸沙芬酰胺片;
4.强生制药首次在国内进口申报人源抗CD38单抗(Daratumumab)注射液;
5.武田制药首次在国内进口申报注射用Vedolizumab。
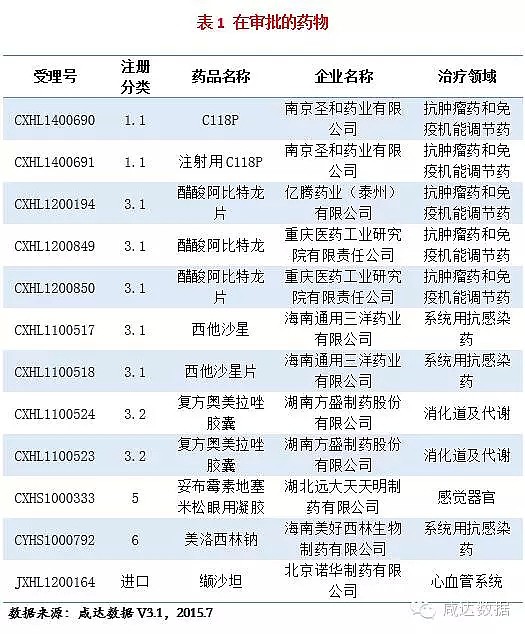
6. 南京圣和药业有限公司1.1类化药注射用C118P获批临床;
7. 百济神州(北京)生物科技有限公司1.1类化药BGB-283胶囊获批临床;
8. 成都苑东药业有限公司1.1类化药优格列汀片获批临床;
9. 广州必贝特医药技术有限公司1.1类化药注射用双替尼他获批临床;
10. 浙江华海药业股份有限公司1.1类化药盐酸羟哌吡酮片获批临床。
在审评
本周(2015.7.19-2015.7.25)有117个药品(按受理号计)进入在审评状态,110个化药,其中5个1.1类,60个3.1类,4个3.2类,2个3.3类,3个5类,25个6类,9个进口。此外,还有5个治疗用生物制品,1个预防用生物制品,1个中药。
重点如下:
1. DTRMWXHS-12胶囊:本品由浙江导明医药科技有限公司申报,而该公司由浙江海正出资7340万人民币成立,占股73.4%,总经理何伟博士以五项一类新药研究项目(YP17酶抑制剂、mTOR激酶抑制剂、雄性激素受体拮抗剂、JAK抑制剂等)在全球的无形资产作价入股,占26.6%。目前有两项中国专利公开,分别是JAK抑制剂和ALK抑制剂,用于治疗免疫相关疾病和肿瘤。不过,小编暂未查到DTRMWXHS-12胶囊的具体靶点和适应症,猜测是披露信息中的一种。
2. 美他非尼片:本品由广州南鑫药业有限公司申报,该公司已被湖南有色凯铂生物药业有限公司收购。美他非尼猜测是在索拉非尼的基础上做了一定的结构改造和修饰,同样也是VEGFR和RAF抑制剂。
3. 甲磺酸沙芬酰胺片:本品由Newron公司和赞邦公司联合开发,用于治疗特发性帕金森氏症,2015年2月获EMA批准,目前还未获FDA批准上市。甲磺酸沙芬酰胺是一种高选择性以及可以的单胺氧化酶-B(MAO-B)抑制剂,能引起纹状体内细胞外的多巴胺的水平,从而起到抗帕金森的作用。此外,其还能通过抑制电压门控Na+通道,调控兴奋性递质谷氨酸的释放。目前国内由贵州恒顺药物研发有限公司首家申报,这家公司最近快速申报了很多3.1类化药,包括5月份申报的曲格列汀,6月份申报的富马酸维诺拉赞,以及本周申报伊格列净L-脯氨酸和磷酸特地唑胺。
4. Daratumumab注射液:本品是强生开发的一款肿瘤学产品(强生与Genmab于2012年签署11亿美元协议,获得了daratumumab的独家权利),FDA于2013年5月授予daratumumab治疗多发性骨髓瘤的突破性药物资格。daratumumab是一种人源化抗CD38单克隆抗体,具有广谱杀伤活性,靶向结合多发性骨髓瘤细胞表面高度表达的跨膜胞外酶CD38分子,可通过多种机制诱导肿瘤细胞的快速死亡。目前已启动向FDA滚动申报daratumumab治疗多发性骨髓瘤生物制品许可申请。目前也已向中国提交临床申请。
5. 注射用Vedolizumab:本品由武田制药开发,用于治疗中重度克罗恩病和溃疡性结肠炎(UC),该药物是一种可注射的单克隆抗体,适用于那些对一种或者多种常规治疗(例如糖皮质激素,免疫调节剂,肿瘤坏死因子抑制剂)不应答的患者。本品是一种整合素受体拮抗剂,为Natalizumab(那他珠单抗,是一种有类似作用机制的药物,可能会增加进行性多灶性白质脑病,脑感染的风险,目前已撤市)提供了一种替代治疗,对于不能耐受标准治疗的患者提供另一种选择方案。目前,本品也已由武田制药向CFDA提交临床申请。
在审批
本周(2015.7.19-2015.7.25)有12个药品(按受理号计,下同)进入在审批状态,均为化药。重点药物:
1. 注射用C118P:本品由南京圣和药业有限公司申报,2014年8月进入CDE审评序列,为重大专项品种以及特殊审批品种,未经过发补,目前已获批临床。本品是一种新型微管蛋白聚合抑制剂,与已上市的微管蛋白抑制剂(如长春新碱、紫杉醇等)以及作用于血管的分子靶向药物(如索拉菲尼、舒尼替尼等)相比,具有独特的抗肿瘤机制,目前具有类似结构和机制的药物CA4P在国外处于III期临床研究阶段。
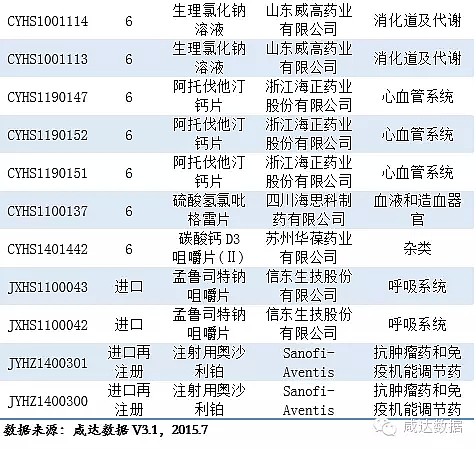
在审批的药物信息见附表1。
审批完毕
本周审批完毕的药物共56个,其中54个化药,2个中药。重点药物:
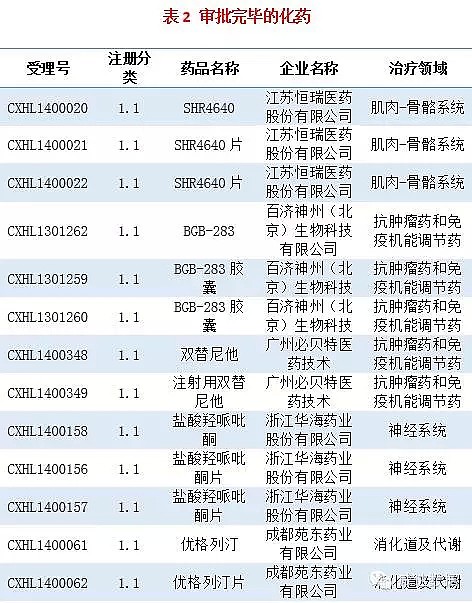
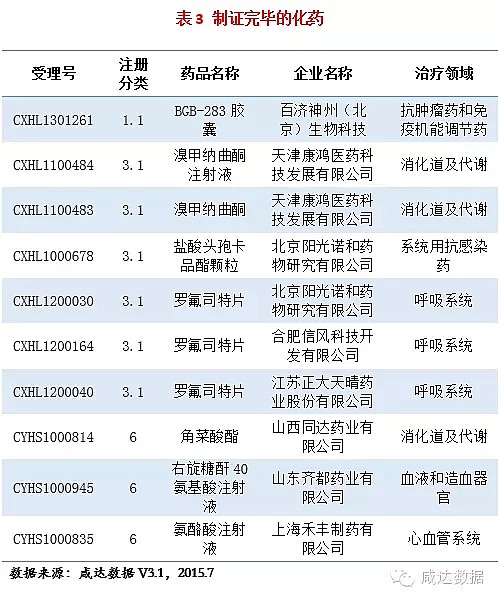
1. BGB-283胶囊:本品由百济神州申报,2014年5月进入CDE审评序列,为重大专项品种以及特殊审批品种,未经过发补,目前已获批临床。本品是一种BRAF和EGFR双重抑制剂,用于治疗肿瘤。
2. 优格列汀片:本品由成都苑东药业申报,2014年2月进入CDE审评序列,为特殊审批品种,未经过发补,目前已获批临床。本品是一种DPP-4抑制剂,用于治疗2型糖尿病。目前国内1.1类DPP-4已经很多,而恒瑞的恒格列汀已经申报生产,这么多列汀类,竞争也真是激烈啊。
3. 注射用双替尼他:本品由广州必贝特医药技术有限公司申报,2014年4月进入CDE审评序列,为特殊审批品种,未经过发补,目前已获批临床。本品是一种抗肿瘤药物,具体靶点未知。
4. 盐酸羟哌吡酮片:本品由浙江华海药业申报,2014年3月进入CDE审评序列,为重大专项品种以及特殊审批品种,2015年4月发补一次,目前已获批临床。本品是一种5-HT1A受体激动剂/5-HT重摄取抑制剂,用于治疗抑郁。
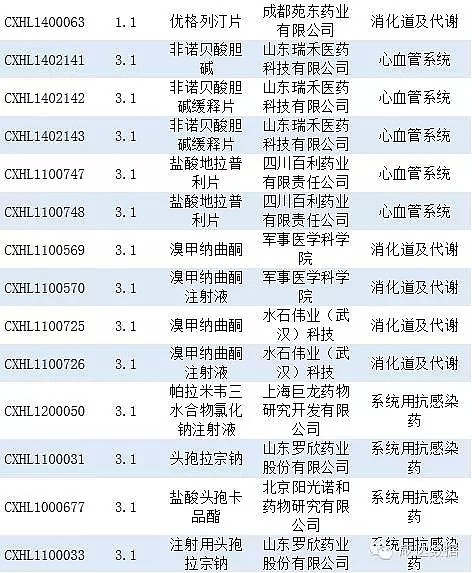
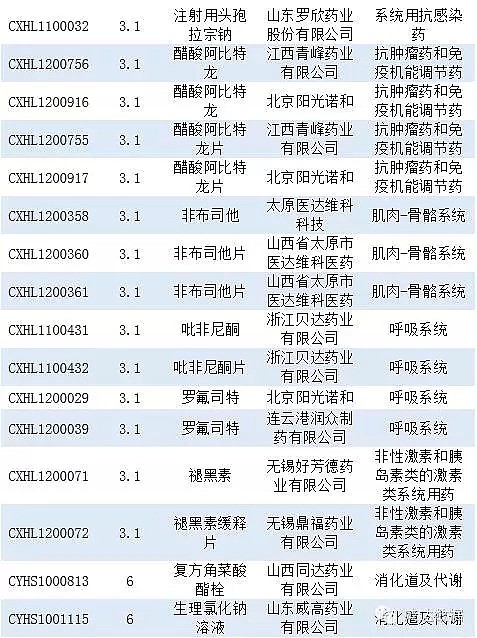
审批完毕的化药信息见附表2。
制证完毕
本周审批完毕的药物共12个,其中10个化药,2个中药。制证完毕的化药见附表3。
附:
咸达原创
专注 • 专业
【转载务必注明来源与作者】
联系和关注我们
咸达数据网址:网页链接
试用或购买数据库请咨询QQ:97361509