精彩内容
根据咸达数据,本周(2018.8.6-8.12)阿斯利康PARP抑制剂奥拉帕利片终于审评完毕,即将进口国内。豪森药业和正大丰海制药各有1个类新药审批完毕。歌礼药业又一个1类抗丙肝药盐酸拉维达韦片提交上市。本周又一波药品申报一致性评价。
| 看点一
阿斯利康5.1类进口药品奥拉帕利片的上市申请已审评完毕,应该是获批进口啦。本品2017年12月承办,纳入优先审评审批药品名单公示中,并进入2018年第一批35个自查核查项目清单。
奥拉帕利片是全球首个上市的PARP抑制剂,2014年12月获FDA批准上市,用于治疗铂敏感复发卵巢癌。PARP全称是多聚腺苷二磷酸核糖聚合酶,参与DNA断链修复。当癌症患者体内负责双链DNA修复的BRCA蛋白发生突变时,PARP就在DNA修复中起到了不可替代的作用。此时,倘若再抑制PARP,肿瘤内的DNA错误就会越积越多,最终导致肿瘤的死亡。因此,PARP抑制剂能作为精准医疗的手段之一,为癌症患者带来新的治疗方案。
| 看点二
辉瑞5.1类进口药品Palbociclib胶囊已制证完毕,获批进口,国内上市通用名哌柏西利,商品名爱博新。本次获批进口是由临床申请直接获批的,受理号JXHL1700151、JXHL1700152、JXHL1700153,应该是临床资料一并提交,直接批准进口了。《接受药品境外临床试验数据的技术指导原则》落地之后,进口品种尤其是临床急需的品种,上市会越来越快的。
Palbociclib是全球首个细胞周期蛋白依赖性激酶(CDK)4/6抑制剂,用于治疗激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性的局部晚期或转移性乳腺癌,应与芳香化酶抑制剂联合使用作为绝经后女性患者的初始内分泌治疗。
| 看点三
豪森药业1类新药HS-10340胶囊和江苏正大丰海制药1类新药FHND9041胶囊的临床申请均审批完毕,推测均获准进入临床。
这两个品种均于2018年6月承办,未经历发补,2个月就审批完毕,跟默认许可的时间差不多。小编暂未查到二者的适应症,等待开展临床。
| 看点四
歌礼药业提交第二个抗丙肝药物的上市申请,即NS5A抑制剂拉维达韦片。本品代号ASC16片,英文名Ravidasvir,2015年4月申报临床,2016年5月获批。
截至目前,歌礼研发管线中共有三个不同靶点的治疗丙肝的直接抗病毒药物(DAA),分别为NS3/4A抑制剂、NS5A抑制剂及NS5B抑制剂,研发管线如下:
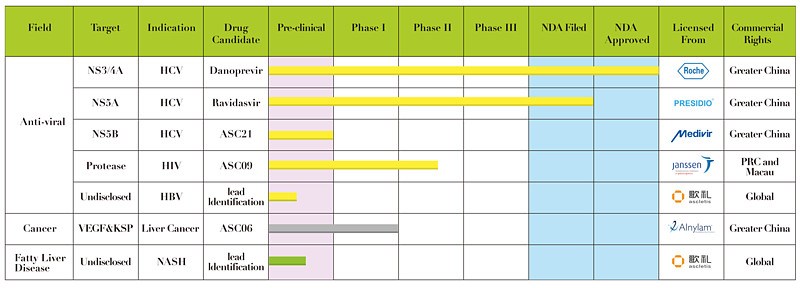
拉维达韦是歌礼从美国Presidio公司引进的一款抗丙肝1类新药,并作为未来泛基因型DAA被WHO纳入2018年7月最新版的丙肝治疗指南。2014年9月,歌礼与Presidio签订一份独家许可协议,歌礼获得大中华区开发、生产和商业化拉维达韦唯一及独家权利。
II/III期临床试验已表明,拉维达韦联合达诺瑞韦及利巴韦林(RDV/DNV)治疗方案安全且耐受性较好,并未出现治疗相关的严重不良反应。除贫血及高尿酸血症外,RDV/DNV治疗组与安慰剂对照组出现的不良反应相似。拉维达韦有望成为同类最佳的针对丙肝NS5A靶点的泛基因型DAA。
| 看点五
本周提交一致性评价的品种:
