1、免疫治疗:肿瘤治疗的未来
2、CAR-T&TCR-T:免疫治疗的最有利武器
3、关注CAR-T&TCR-T临床进展,把握市场关键驱动因素
2.CAR-T&TCR-T:免疫治疗的最有利武器
2.1CAR-T:最先进的细胞治疗技术
嵌合抗原受体技术的概念:CAR技术是将人为设计的针对某种肿瘤相关抗原或者肿瘤特异性抗原单链抗体-CAR通过基因工程方法引入T细胞表面,重新定向T细胞的免疫反应,使T细胞能够以非HLA分子限制性的方式识别肿瘤细胞,发挥杀伤作用。
2.1.1.CAR-T技术介绍
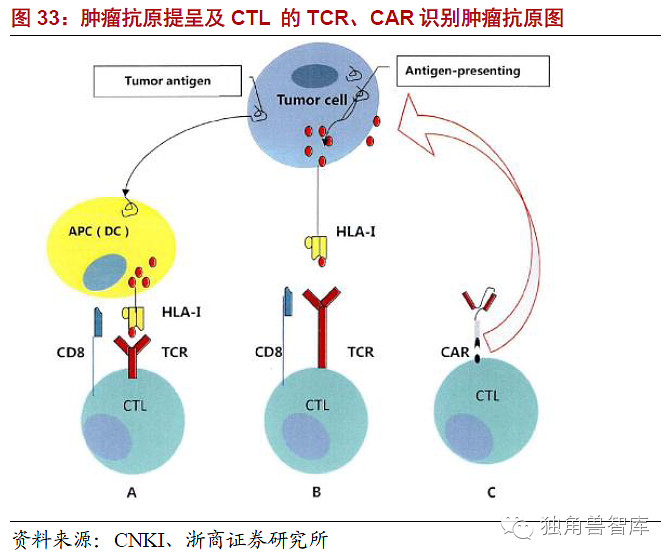
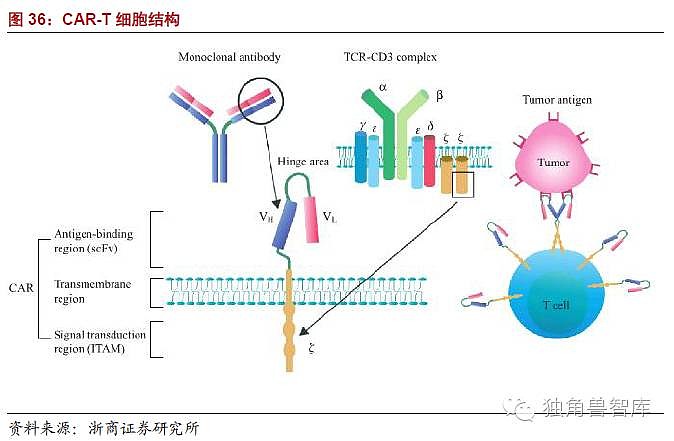
嵌合抗原受体(chimericantigenreceptor,CAR)技术技术的原理:机体的免疫系统对肿瘤细胞有着重要的免疫监视和杀伤作用,其中发挥抗肿瘤效应的主要是细胞免疫,而主要的效应细胞是的细胞毒性淋巴细胞(Cytotoxict-lymphocytes,CTL),肿瘤抗原作为内源性抗原可以由肿瘤细胞自身的HLA-I类分子直接提呈给CD8+CTL,也可以由其他抗原提呈细胞(antigenpresentingcell,APC)主要是树突状细胞(dendriticcell,DC)提呈给CD8+CTL(图29)。CD8+CTL细胞活化需要双信号,第一信号由识别抗原多肽分子(HLA)复合物产生,这个识别过程具有双特异性,即胞外可变域特异性识别肿瘤抗原表位,同时CD8+分子特异性识别自身HLA-1分子的多态性部位,只有双特异性识别才能为CTL活化提供完整的第一信号,而T细胞活化必须要求CD8+分子特异性识别自身HLA-1分子就是产生自身HLA-1分子限制的原因。而肿瘤细胞的HLA-1分子表达通常是下调的,这是肿瘤逃逸的重要机制之一,正是由自身HLA-1分子的限制以及免疫抑制的肿瘤微环境的影响,生理性TCR很难有效活化发挥抗肿瘤作用(图31)。这使得CTL及相关的细胞免疫治疗的抗肿瘤作用受到了很大的限制,所以如能找到突破自身HLA-1分子限制的方法,将会为肿瘤细胞免疫治疗做出巨大的贡献。为了克服自身HLA-1分子的限制,人们开始设想能不能设计一种肿瘤抗原受体,只识别肿瘤抗原不需要识别HLA-1分子就能活化CTL,如果能使CTL细胞表达这样的肿瘤抗原受体就能使其突破HLA-1类分子的限制,绕过DC直接发挥杀伤肿瘤细胞的作用,这就是CAR产生的思路。基于这个思路人们研究设计出了这种肿瘤抗原特异性的CAR,其结构类似于TCR,由胞外特异性肿瘤抗原识别区、铰链、跨膜区以及胞内信号传导域四部分组成。胞外异性肿瘤抗原识别区也称单链可变区融合了针对肿瘤抗原特异性抗体的抗原识别区的重链和轻链,能够以非分子限制的模式直接识别肿瘤相关或者特异性抗原,并通过胞内信号域传导信号、活化效应T细胞。胞内信号域来自免疫球蛋白受体的链;而跨膜区可来源于同一分子或为型跨膜蛋白。
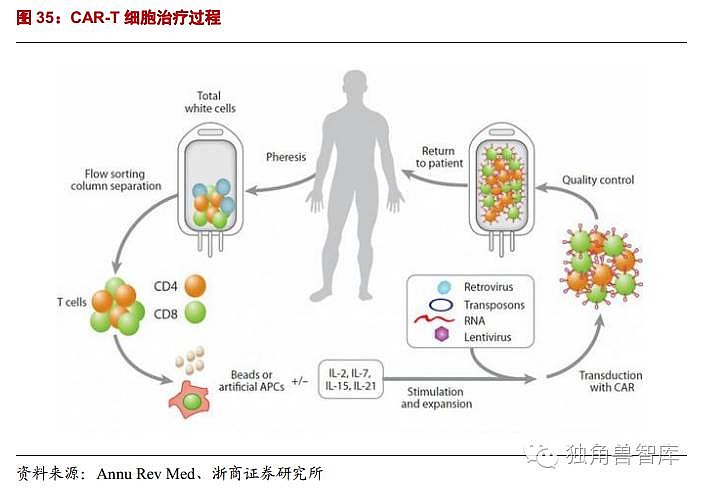
总结:CAR技术的原理就是通过基因工程技术将胞外特异性肿瘤抗原识别区、铰链、跨膜区以及胞内信号传导域四部分拼接后,通过逆转录病毒或慢病毒载体、转座子或转座酶系统或直接转染到效应细胞,并使表达抗原特异性的效应细胞,经体外扩增达到治疗剂量后再过继输注给患者的一种细胞免疫治疗策略。CAR-T细胞又称嵌合抗原受体T细胞,通过基因工程的方法,将能够识别和结合特异性肿瘤抗原的单链抗体与T细胞内的信号分子进行融合,通过病毒载体或转座子系统等转染T细胞,使T细胞表面表达嵌合抗原受体,从而特异性识别和结合肿瘤细胞表面的抗原并裂解肿瘤细胞。
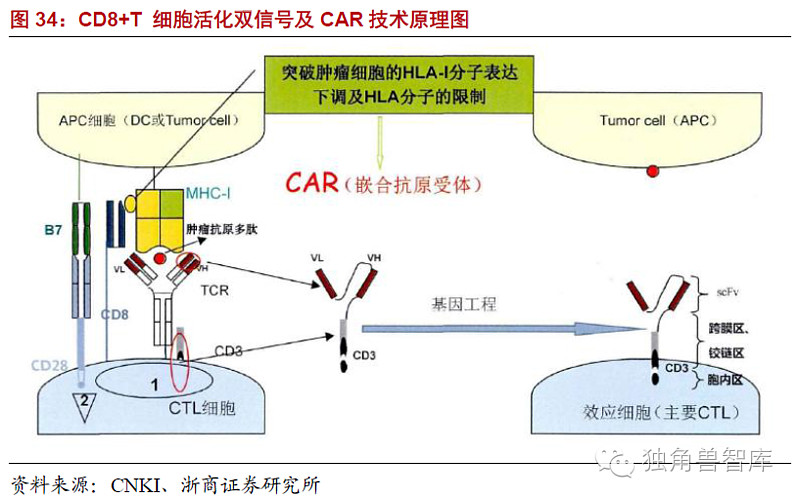
嵌合抗原受体(CAR)-T细胞技术的优点:基于CAR的诞生过程,不难看出这项免疫治疗策略拥有很多独特的优势。1、单链的CAR能与靶抗原高亲和性结合而不受中枢耐受的影响以非HLA分子限制的模式识别肿瘤抗原,这使得T细胞尤其是CTL绕过DC并克服了肿瘤细胞HLA分子表达下调的免疫逃逸机制直接杀伤肿瘤细胞,并且能够攻击低免疫原性的肿瘤。2、TCR只能识别蛋白抗原,而由于大部分的来源于单克隆抗体,可以设计特异性的以针对生物化学性质不同的肿瘤特异性标记,包括蛋白来源的多肽分子,或者非蛋白质分子如脂类和碳水化合物。扩大了选择的范围,增强了应用型。3、活化后的CAR-T细胞以及其他类型的效应细胞能够分泌很多细胞因子来对抗免疫抑制的肿瘤微环境,提高T细胞的抗肿瘤效应。4、自体或异体的细胞均具有一定的扩增能力,能够在体外迅速扩增至治疗剂量,并在体内能够维持治疗剂量,甚至产生针对特定肿瘤抗原记忆型的T细胞,增强了其临床可行性。5、相同的CAR可用于不同HLA-单倍体的病人,有利于技术的临床应用。
2.1.2CAR-T技术的发展过程
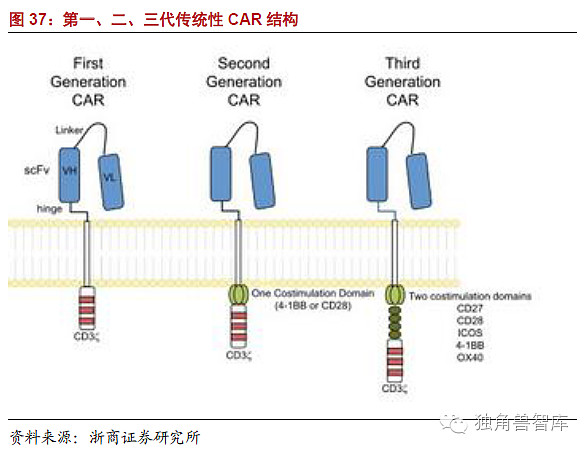
细胞内信号结构域对于T细胞的激活和诱导效应功能至关重要,早期研究表明CAR表达的稳定性依赖于所用的信号结构域。最早Eshhar等人设计的胞内信号域只嵌合的TCR/CD3的ζ链即所谓的第一代CAR,也是CAR的基本结构。随着对于T细胞活化信号通路的不断研究深入,逐渐产生了向CAR的胞内段添加一个协同刺激分子的第二代CAR和添加两个以上协同刺激分子的第三代CAR。随着胞内信号域的不断完善,CAR的活化效应细胞、活化后的扩增以及抗肿瘤的能力也在不断进步。
第一代CAR:体内研究表明,第一代CAR能够为细胞提供活化的第一信号,激活T细胞和最初的细胞毒性反应,发挥抗肿瘤作用,甚至引起效应T细胞分泌白介素-2。但是临床试验均证明第一代CAR修饰的T细胞在体内扩增能力很有限,并且扩增后的细胞大部分呈阴性生长,临床试验还证实第一代CAR-T细胞在体内最多维持63天,在肿瘤部位没有观察到第一代的CAR-T。这种T细胞的不完全活化,主要是由于缺乏T细胞活化以及维持必须的第二信号-协同刺激信号引起的。虽然第一代CAR的功能并不完善,但在信号分子研究方面也取得一定成果:在研究中发现,胞内嵌合CD3ζCAR修饰的T淋巴细胞与胞内嵌合FcεRIγ受体修饰的T淋巴细胞相比,显示出优势的活化和杀伤肿瘤细胞的作用,这可能与CD3ζ含有三个免疫受体酪氨酸激活基序(immunoreceptortyrosine-basedactivationmotifITAM),而FcεRIγ链只有一个ITAM有关;虽然胞内嵌合CD3ζCAR的作用更强,但是其表达率FcεRIγ较胞内结构域的CAR低。
我们知道T细胞活化不仅需要MHC分子与TCR相互作用作为第一信号,还需要共刺激分子作为第二信号,如果T细胞只有第一信号刺激而没有第二信号刺激,那么T细胞将不能有效激活,还可能引起T细胞失能和凋亡。肿瘤细胞表面常常缺少共刺激分子,这可能就是第一代CAR活化、增殖和持续能力有限的重要原因。
第二代、三代CAR:为T细胞提供第二信号,第二代和第三代CAR出现了。体内、体外测试均证实与第一代CAR相比,第二代CAR修饰T细胞具有较强的扩增、维持以及肿瘤组织趋化能力。尽管一些前临床实验证明,第三代CAR较第二代CAR的作用强,但是缺乏大量临床试验的支持,并且一些报道也指出了第三代CAR的缺陷:首先很容易通过低亲和力“脱革”样的结合产生强烈的刺激信号,诱导致命性的细胞因子释放;其次降低了刺激阈值可能在没有肿瘤抗原刺激的情况下激活过继输注的效应细胞;最后引起信号的泄漏会阻碍其临床应用。摩根等人在使用第三代CAR修饰的T细胞治疗一例结肠癌患者时,在输注后出现CAR-T细胞的肺部浸润引起呼吸功能紊乱,患者于输注后的第五天死于呼吸衰竭。所以目前大部分临床研究倾向于使用第二代CAR。可供选择的协调刺激信号有CD28,CD137,CD134,和诱导共刺激分子(induciblecostimulatoICOS)。其中研究最多的是CD28和CD137分子,CD28在调节淋巴细胞增殖和存活方面有着重要作用,也对效应功能和记忆细胞的建立起着关键作用,而肿瘤坏死因子家族受体-CD137为维持T细胞应答提供信号,对T细胞生存和产生记忆细胞发挥着关键作用。比较嵌合不同协调刺激分子的第二代CAR发现CD28与其他协调刺激分子相比能够显著地引起IL-2的分泌;CD137增加效应细胞存活的能力较强,而ICOS引起革细胞溶解的能力最强;CD3联合4-1BB(淋巴细胞激活诱导的受体)比CD3联合CD28的组合有更强的促进T细胞活化和扩增的作用。
2.1.3CAR-T研发格局分析
在CAR-T疗法的开发上,美国遥遥领先,中国紧随其后,欧洲和日本大幅落后。截止目前,正在开展的CAR-T临床试验共87项,美国54项,中国23项,欧洲8项,日本和澳大利亚各1项。美国是CAR-T技术的起源地,也是全球医药科技的龙头,各大医药巨头对该新兴领域垂涎三尺不足为奇。中国此次也把握住了这一时代潮流,以惊人的23项临床试验位居全球第二,将医药研发实力更强的欧洲和日本甩在身后。
诺华、Juno和Kite在CAR-T疗法的开发上处于领先地位,CAR-T技术各具特色,并且已在多项临床试验中率先获得了大量的数据,引领着CAR-T的潮流。另外还有多家小型生物医药公司也分别在各自的领域取得了一定突破,比如Cellectis(使用异体T细胞)、CBMG等。具体信息见:3.2国外研发CAR-T&TCR-T公司及项目进展。
尽管国内部分CAR-T技术还相对落后,研发也较为粗放,但研发广度和深度均处于世界前列。目前国内CAR-T研究较为领先的机构及团队包括解放军301医院韩为东教授(9项)、西南医院钱程教授(2项)、博生吉医药科技有限公司杨林教授(2项)、仁济医院李宗海教授(2项)等。具体信息见:3.5国内公司投资分析。
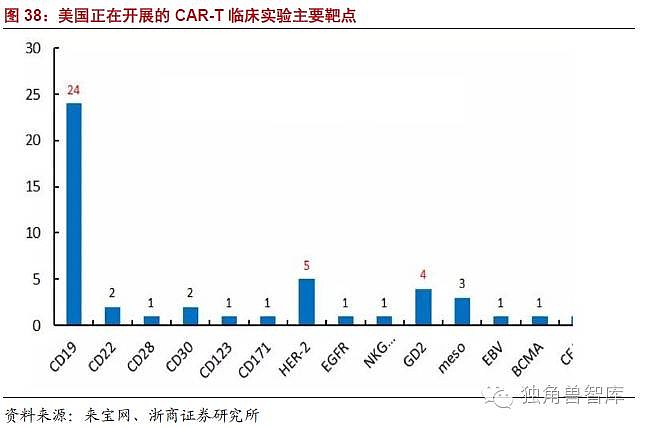
目前,全球的科研人员更倾向于CAR-T在血液瘤(白血病)方面的治疗研究,当然这一现状的主要原因,还是由于CAR-T在治疗实体瘤方面存在的明显弱势。在现有的CAR-T临床实验中,最常见的靶点仍然是CD19,全球共有59项临床实验选择CD19作为靶点,这与CAR-T临床偏好血液肿瘤的情况一致。其余研究较多的靶点有Her2(7项)、GD2(7项)、CEA(6项)、mesothelin(5项)。
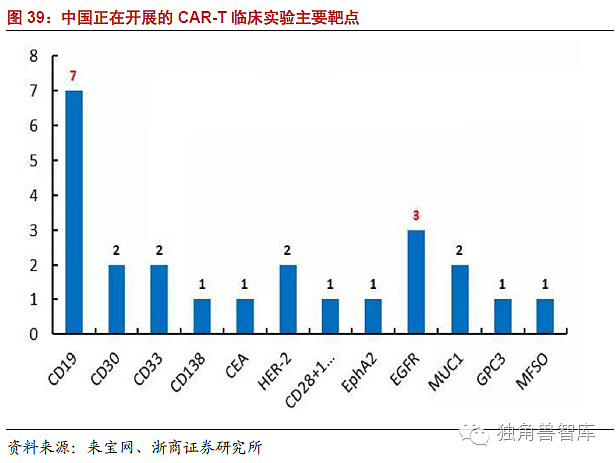
比较中美两国CAR-T临床试验的靶点可发现,血液肿瘤仍然是CAR-T临床研究的重点突破口,其中又以CD19的研究最为广泛和深入(31项)。另外,针对HER-2、GD2、EGFR等实体瘤靶点的研究也比较多。
2.1.4CAR-T技术最新研究进展
CAR-T技术的原理就是通过基因工程技术将胞外特异性肿瘤抗原识别区、铰链、跨膜区以及胞内信号传导域四部分拼接后,通过逆转录病毒或慢病毒载体、转座子或转座酶系统或直接转染到效应细胞,并使表达抗原特异性的,经体外扩增达到治疗剂量后再过继输注给患者的一种细胞免疫治疗策略。CAR-T治疗过程,包括细胞分离、细胞制备、细胞鉴定、细胞增殖、细胞回输这几个主要部分。CAR-T技术的最新研究,渗透到了其中每个步骤。
CAR-T的有效性的提高:
1、生理性CAR
尽管大部分的胞外来源于选择的靶点为肿瘤抗原,但是也有一些研究选用生理性的受体及配体,因为肿瘤细胞高表达一些特殊的受体或配体如非HLA-I类分子配体的杀伤活化受体(NKG2D)的配体、血管内皮生长因子受体(VEGFR)、整合素结合肽,人类表皮生长因子受体、白介素-13突变蛋白等,那么针对这些受体或配体可以设计胞外嵌合有特异性配体或受体的CAR,也可以称为生理性的CAR。
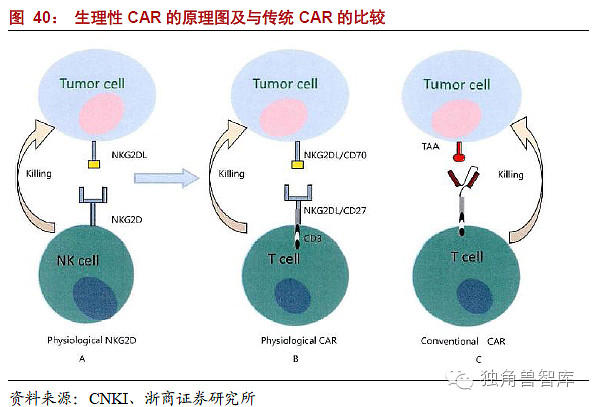
这种生理性具有的优势是:其本身为人源性的,降低了的免疫原性,避免了宿主的免疫反应;受体与配体之间亲和力高。图38以NKG2D为例展示了生理性CAR的起源,并对比了传统的CAR。图38中A显示NK细胞通过NKG2D直接识别肿瘤细胞表面的配体并杀伤肿瘤细胞,正常机体NK细胞识别组织细胞表面的HLA-I类分子,NK细胞表面的抑制性受体占优势,NK细胞不杀伤正常的组织细胞,肿瘤细胞表面HLA-I类分子表达下调,此时NK细胞表面的识别非HLA-I类分子配体的杀伤活化受体包括NKG2D发挥主要作用杀伤肿瘤细胞。B根据NKG2D识别配体的模式,将其嵌合至CAR的胞外区域,通过基因工程的方法表达于T细胞或者其他杀伤细胞表面,经修饰的细胞即能通过近似生理性的受体识别配体的方式识别肿瘤细胞并通过CAR的胞内信号活化效应细胞发挥抗肿瘤作用;C显示了传统性的识别模式。
2、新靶点的选择:为了解决在实体瘤治疗上效果较差的问题
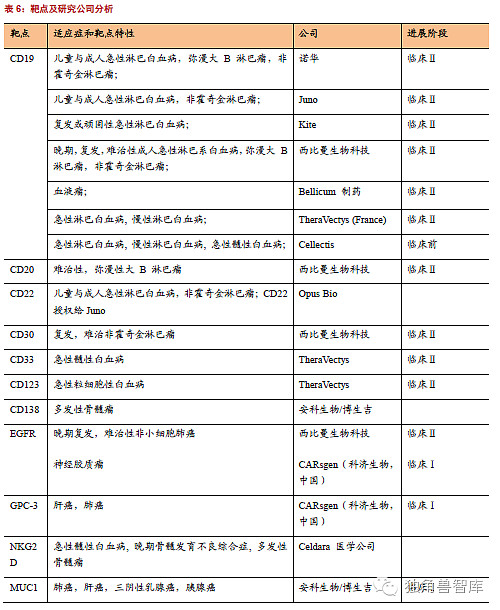
CAR-T治疗血液性癌症的前景普遍看好,因为血液性肿瘤的靶点好(CD19、CD30、CD33),这些药靶已经在抗体制药上取得了成功。在CAR-TCD19治疗急性淋巴细胞白血病的领域,无疑宾西法尼亚大学Car-T细胞先驱CarlJune领导的团队居领先地位,而Car-T细胞治疗实体肿瘤依然还在摸索阶段。
这是由于在实体肿瘤慢性发展过程中,能够在体内构成一个肿瘤微环境(TME,TumorMicroenvironment)。里面有浸润性的调节性T细胞(Treg细胞)、肿瘤相关巨噬细胞、PD-1高表达以及抑制性细胞因子(比如白介素10、TGFb),从而将肿瘤保护得非常严密。静脉回输CAR-T细胞后,T细胞很难归巢到肿瘤位臵,因此治疗效果较差。第四代CAR-T技术中,会整合表达一个白介素12因子(IL12)的基因。白介素12是很重要的因子,但不能直接给药,会产生严重反应。但在CAR-T上,让白介素12在靶向位臵局部表达,可以改善免疫治疗的微环境。把附近的NK细胞召唤过来激活,并把浸润的T细胞功能唤醒,协助CAR-T细胞杀灭肿瘤细胞。另外,实体肿瘤里面有靶点阴性的细胞,因此把靶点阳性的细胞杀完,阴性的也会长起来。而把浸润的T细胞唤醒,可以杀灭靶点阴性的肿瘤细胞。
在实体肿瘤的药靶上,Her2和EGFR是比较公认的选择,因为抗体药和小分子药均在这几个分子靶标上取得了成功。其他靶标有CEA、Mesothelin、GD2等。利用靶向GD2(diasialoganglioside,双唾液酸神经节苷脂)和L1CAM(L1celladhesionmolecule,L1细胞黏附分子)的CAR-T细胞治疗神经母细胞瘤,靶向CAIX(carboxylanhydraseIX,羧基碳酸酐酶IX)CAR-T细胞治疗转移性肾癌,靶向Her2的CAR-T治疗结直肠癌,靶向CEA(carcinoembryonicantigen,癌胚抗原)的CAR-T治疗结直肠癌和乳腺癌,靶向EGFRvIII(epidermalgrowthfactorreceptorvariantIII,突变型表皮生长因子受体III)的CAR-T治疗神经母细胞瘤,靶向PMSA(prostatespecificmembraneantigen,前列腺特异性膜抗原)的CAR-T治疗前列腺癌。然而,相对于血液瘤,实体瘤的临床研究进展缓慢,没有取得突破性的成果。由于实体瘤没有特异性的肿瘤抗原,CAR-T细胞难以向实体瘤迁移和实体瘤内肿瘤微环境中存在着大量的免疫抑制因子和免疫抑制细胞,因此靶向实体瘤比血液瘤更具难度和挑战性。目前又有研究选取MUC1,作为免疫治疗靶点,用来治疗实体瘤。肿瘤细胞通常不可避免地高表达MUC1,细胞被黏蛋白包被。大量的MUC1-N在肿瘤细胞表面能够影响与肿瘤相关的细胞与细胞间和细胞与胞外基质的相互作用。MUC1的3个特点使其成为一个吸引人的免疫治疗的靶点:1.在许多肿瘤细胞中表达上调,尤其是乳腺癌和卵巢癌;2.正常的MUC1表达在上皮细胞腔面,而在肿瘤细胞中失去了这种极性;3.在肿瘤细胞中由于糖基转移酶表达下调,MUC1的糖基化异常。CAR-T细胞治疗实体瘤还有许多的坎,比如药靶,比如CAR-T细胞进入肿瘤的量等。
3、CAR-T技术中效应细胞的选择更广泛
最初CAR-T临床应用,效应细胞来自通过白细胞分离法分离患者外周血得到的非选择性、多克隆T细胞,再将CAR的基因插入其中得到。现在普遍认为外周血T细胞由不同分化、记忆型CD4、CD8阳性的细胞子集组成,这些子集的功能、转录谱及表观遗传学程序不同,从而在过继治疗中可能产生不同的效果。所以选择较强的抗肿瘤并且对正常的组织损伤小的细胞亚群有助于提高治疗效果。目前临床试验中选择的效应细胞多为CD3+T细胞,其包括CD4+、CD8+的T细胞及其他亚群,对于不同亚群嵌合CAR后在治疗中作用的研究正在进行中,由于异质性和多克隆选择的多变性可以影响癌症免疫疗法的有效性和安全性。由于外周血中细胞表型的分布受到年龄,病原体的暴露以及之前化疗的影响,所以使用非选择性人群的基因转染会导致缺乏统一的细胞亚群组成,对受者个体的效应及毒性都产生影响。选择的不同的细胞亚群用于治疗主要的缺点是由于分离T细胞需要额外的时间和金钱。非选择性的细胞用于恶性肿瘤敏感的免疫治疗,要求必须含有一些足够发挥抗肿瘤效应的亚群。然而不同的细胞组成给确定计量效应关系造成了困难。
双特异性淋巴细胞:病毒特异性T细胞有两大优势,首先能够通过生理性的TCR识别病毒为T细胞提高更强的协调剌激信号,从而增强了T细胞的扩增,以维持T细胞其治疗剂量。其次造血干细胞移植后输注供者T细胞是一种有效的抑制移植后复发的治疗,但是异体T细胞会引起GVHD效应,而自体的T细胞由于患者自身使用药物、疾病进展等因素很难获得治疗剂量并且缺乏同种异体反应降低了GVL效应。而试验也证明病毒特异性的CAR修饰的T细胞(自体),能够通过生理性的TCR获得足够的活化,维持有效的治疗剂量,并增强过继输注T细胞的GVL效应同时避免了GVHD效应。
胞因子诱导的杀伤细胞:CIK细胞是在体外将人外周血中单个核细胞与多种细胞因子共同进行培养后获得的具有多种特殊生物免疫学效应的细胞。这种细胞的细胞表面同时表达了CD3和CD56分子两种膜蛋白,也将其称做NK细胞样的淋巴细胞,CIK细胞具有以下特点:首先体内、外试验证明其能够以非MHC限制的方式识别并杀死多种类型的肿瘤细胞;对肿瘤细胞具有强大的杀伤能力,并且引起GVHD效应的倾向较小;CIK细胞高表达一些粘附分子和趋化因子,所以其对骨髓、淋巴结以及脾脏的趋化作用强,那么可以推测该细胞对于血液系统肿瘤会有更强的趋化作用,应用于治疗血液系统肿瘤可能更有效基于临床应用的立场,CIK细胞具有很大的潜力,因为其容易培养制得,能够通过相对简单的方法控制其复制和扩增,使用较低成本和较简单的操作就能在短时间内在体外培养出大量的应用治疗的CIK细胞,很多围绕其毒性以及临床效应的期试验已经在多个机构进行,意在更好的服务于临床。
自然杀伤细胞:NK细胞是机体重要的天然免疫细胞,占外周血淋巴细胞10%的左右,与抗肿瘤、抗病毒感染和免疫调节有关,主要通过分泌一些细胞因子及本身的细胞毒作用发挥疗效,在天然免疫和获得性免疫中起着重要的作用。细胞的特点是以非MHC限制模式识别和杀伤肿瘤细胞,对抗体无依赖性,故而将其称为自然杀伤细胞。NK细胞杀伤肿瘤细胞的一个重要的途径是在肿瘤特异性的IgG抗体存在的条件下,NK细胞可以通过表面IgGFc受体(FcγRIII介导,识别杀伤与IgG抗体特异性结合的肿瘤範细胞,这种IgG抗体介导的NK细胞杀伤靶细胞的作用也称作抗体依赖性细胞介导的细胞毒作用。
4、保持细胞低分化
因为细胞不同于传统药物,不同的培养工艺往往对细胞的活力和功能具有较大影响。CAR-T与TCR-T细胞转染需要在T细胞早期分化阶段。科学家发现,随着分化程度加深,免疫细胞表面标记和胞内转录因子表达均会发生变化,复制能力逐渐变弱。分化早期T细胞增殖能力强、体内持续时间长,相应的肿瘤杀伤效果也较好。因此,探索更好的培养工艺以维持细胞的低分化状态就显得十分重要。目前国际著名生物试剂供应商life开发了CD3/CD28的磁珠来维持上免疫细胞的“年轻态”,也被carlH.June等研究团队和临床实验认可。国内细胞治疗行业处于萌发生长期,事实上,放眼全球也是这样的一个状态,国内近500家细胞治疗公司和医院采用的培养方案良莠不齐,对这一产业的规范和标准化势在必行。对于新研发的培养工艺,一定要进行多中心协同实验,以期得到客观公正的评价。
安全性问题:
1、胞外区域的抗体人源化
目前临床试验中构建CAR的胞外scFv大多数来源于单克隆抗体,并且多为鼠源性单抗,在具有免疫活性的宿主体内,鼠源性单抗部分可能诱导宿主的人抗鼠的免疫反应,这就阻碍了CAR与靶抗原之间的相互作用,从而抑制了CAR-T细胞的功能。虽然在输注过CAR-效应细胞患者的循环中还没有发现这种抗CAR的抗体,但也证明这可能是一个复杂的免疫反应过程,由于其可能影响到CAR-T细胞的活化、扩增,所以很多相关研究建议使用人源性单抗。随着转基因小鼠和菌体展示文库等技术的发展,抗体的发展经历了非人源抗体、人鼠嵌合抗体、人源化抗体、全人源单抗,并目有实验己经将人源化单抗引入CAR的构建,并命名为CAR抗体,引入人源抗体将进一步扩CAR大疗法的应用范围。
2、分子开关
在CAR-T细胞的开发过程中,安全性问题几乎让这疗法胎死腹中。早期的安全性有超敏反应,这种反应若不能及时应对则是致命的。FDA一度也因此中止了CAR-T细胞的临床实验。超敏反应和细胞因子风暴症“Cytokinesreleasestorm”是CAR-T细胞疗法的二个安全性问题。在第一位经由Car-TCD-19疗法治疗成功的儿童身上,一度IL-6的血液浓度1000倍于正常值,病人高烧不退,幸好CarlJune知道有一个抗Interleukin-6抗体,用过之后高烧控制,否则这个实验恐怕又会被FDA喊停。靶向Her-2的CAR-T细胞治疗Her-2阳性肉瘤的临床实验虽然样本量较小,病人总数只有17例,但所有受试者基本安全。CAR-T细胞存留期超过六周,虽然有效性还远不到可以评估的地步,但是安全性结果还是鼓舞人心的。万事开头难,过了安全性这一关,后面的路就能继续走下去。
加州大学旧金山分校的WendellLim教授,在《科学》杂志上发表的文章显示,可以设计特别的药物来调控CAR-T细胞的杀伤活性。通过控制激活时间和药物剂量,来减轻心脏和肺的副作用,调节免疫反应的水平,从而精确管理副作用,满足不同病人的个性化需求。
3、临床级别病毒包装问题
在CAR-T与TCR-T的制备工艺中,必须依靠载体将目标基因导入到细胞中并持续表达。在这一过程中,有逆转录病毒载体,慢病毒载体,腺病毒载体,非病毒转座子载体,直接mRNA电转等方式。逆转录病毒载体只能感染分裂的细胞,感染效率难以突破。腺病毒载体具有较高的免疫原性,有安全性问题。1999年曾经出现过腺病毒基因疗法引起强烈免疫反应病人死亡的案例。所以这两种载体目前很少有人用于开发CAR-T与TCR-T项目。非病毒转座子载体子和裸DNA载体价格便宜,较为简单,同样效率较低,直接mRNA电转进入只是暂时表达,安全性提升,但是无法持续表达。慢病毒是反转录病毒中唯一能感染非复制状态的一类,效率提高。所以,目前大多数研究机构和企业都采用慢病毒载体。目前,病毒载体制备这一环节还不够规范,需要整个行业逐步建立行业规范。
高额的成本和治疗费的解决:
根据预算,诺华的CAR-T的生产成本在5万美金,20-30万美元治疗收费。Juno的CAR-T的生产成本在4.5万美金,30万美元治疗收费。之前的免疫过继治疗,就是由于高额的治疗成本,使得公司无以为继,例如Dendreon。那么针对CAR-T,怎么样降低生产成本成为一个关键问题。
1、异体CAR-T疗法
目前主流的CAR-T技术是自体CAR-T,优点是:效果好、没有GVHD、没有免疫排斥。缺点是:不同患者之间的差异极大、价格昂贵、制备复杂、市场推广障碍重重。针对以上原因,Cellectis公司在研发和推广异体CAR-T细胞。2015年11月6日,Cellectis的异体CAR-T疗法向前迈出重要一步。一例11个月大难治性白血病女婴使用基于Talent基因编辑技术的UCART19疗法2个月后获得完全缓解,Cellectis股价当天上涨超过20%。2015年12月7日ASH2015年会上,Cellectis详细展示了这一治疗过程。该女婴在化疗后接受了单次UCART19回输,剂量为4.5*106/kg,过程中未发现显著的毒性,也未出现细胞因子风暴,并已经保持3个月完全缓解。除了疗效,Cellectis成功完成UCART19在GMP条件下的3个批次生产的消息也让该公司的股票大涨。当然,Cellectis的竞争力还体现在它的价格上。据估计,诺华的CAR-T疗法受技术、制备、质控等因素的影响,单次治疗的收费将高达25-40万美元。而Cellectis的异体CAR-T疗法预测一个供体可以提供高达500名患者的治疗,因此成本将降低到只有Novartis的1/5左右,单例治疗价格可能下降到5-10万美金,生产效率也会大幅提升。
2、基因编辑技术的突破性进展
所谓CAR-T细胞治疗,是指从病人身上分离出免疫T细胞,然后用基因编辑技术,给T细胞加入一个能识别特定肿瘤细胞的元素,令T细胞具有杀死该种肿瘤细胞的嵌合抗体。基因编辑主要包括ZFN、TALEN和CRISPR技术,其中CRISPR具有操作简单、脱靶率低、成本低廉、无种属特异性、细胞毒性小的特点,已成为基因编辑最热门的研究方向。基因编辑CRISPR的英文全称为Clusteredregularlyinterspacedshortpalindromicrepeats,即“规律成簇间隔短回文重复”,实际上是一种来源于细菌的基因编辑器。而且,研究人员发现,它几乎是一种超级基因武器,可用来精确的删除、添加、激活或抑制目标基因,并能涉及很多生物,如人、鼠、斑马鱼、细菌、果蝇、酵母、线虫以及农作物等等。核苷酸序列进行删除和插入等操作,使人们可以依照自己的意愿改写遗传密码。2012年才首次报道CRISPR可用于基因编辑,但目前已经得到了学术界广泛认可。2015年,CRISPR荣获生命科学突破奖,具备冲击诺贝尔奖的潜力。几家CRISPR技术研发公司纷纷获得了风险投资机构的数亿美元投资,诺华、Juno、Kite等肿瘤免疫治疗龙头企业也纷纷与其签订合作协议,重点改进CART和TCRT免疫疗法的有效性和安全性。最大的一笔合作是Juno斥资7.37亿美元(含6.9亿美元里程碑奖金)与Editasmedicine进行合作开发。成本:Addgene质粒成本为$65(当地价格),iCas9细胞首次构建需要$ 600,SKI购买需要400美元。
CAR-T细胞治疗的时效性
1、物流问题
目前国内外较大的细胞治疗公司基本都在建立自己的冷链运输体系,以此来保证细胞的活性。显然,这一策略是无奈之举,因为放眼全球基本找不到合适的物流或快递公司来安全迅速的运送细胞给客户。因此,细胞治疗产业急需相应的物流公司来承担此项业务。事实上,在美国去年的举办的“CAR-TSUMMIT2015会议”上,已经看到了这一行业的先行者。UPS,已经将眼光投向了生物和医疗制品的后勤输送领域中,并为此专门成立了健康管理事业部。在UPS看来,快递进入医疗行业具有巨大的市场前景。UPS的负责人RobinHooker先生认为后勤运输是CAR-T产业化的关键因素之一,其影响力可能高达50%,直接影响到临床的应答和疗效。他指出UPS只有2年的时间来应对挑战,2017年之后,美国的CAR-T治疗人数将会以指数增长方式爆发,到2020年,将会有高达30万的患者接受CAR-T治疗。如果在2017年之前,UPS无法建立起CAR-T后勤运输系统,那么这个巨大的市场商机就可能丧失了!我们相信类似的情形一定也会在中国发生,CAR-T面向的患者也许也像美国一样,呈现指数级的增长。细胞治疗产业需要的后勤保障的关键因素:从临床到制备场所之间、从制备间到患者病房的血液和细胞制品的包装与运输对细胞产品的质量有重要影响力,包括低温、包装、时间三个因素。他们针对类似CAR-T细胞这种高端医疗产品,会推出专用货柜,上面有实时追踪系统,不仅随时定位货品的位臵,更重要的是会实时监控温度变化并记录在系统里。所以,基于对细胞治疗产业的巨大成果和信心,我们呼吁国内的快递公司也加入到这一产业,最大限度的降低成本,以及保证产品质量安全可靠,为客户谋福利。
2、T细胞生长速度的提高
目前的实验治疗方法,为了病人准备T细胞,需要数周的时间,而且也很难衡量工程细胞的效果。一种新的技术,用来修改T细胞受体(TCRs)和嵌合抗原受体(CARs),用一个名为Strep-tagII的新合成的蛋白标记,来提高T细胞的生长速度,以及抗肿瘤细胞的效力。在此之前,实验室培养此类细胞需要14-20天,有时候癌症快速生长,延迟数周是十分危险的。这项技术可以在3-5天准备细胞。而且通过向T细胞受体的胞外域插入Strep标签,可以将抗癌CAR-T细胞的选择纯度提高到95%,如果没有Strep标签,CAR-T细胞的纯度就是可变的,通常小于50%。
总结:CAR-T和TCR-T疗法任重道远,技术层面和产业化层面两大战场都必须解决,方能让这样的神坛技术真正惠及众生。技术层面,重点是靶点寻找、抗体研发、CAR分子结构优化、CAR-T细胞体内活性维持与增殖;而产业化层面,异体CAR-T技术、细胞制备自动化技术、冷链运输技术是解决产业化的三大法宝。
2.2TCR-T:治疗实体瘤效果更好的方法
过继性细胞免疫治疗肿瘤是指在体外扩增肿瘤特异性的细胞,然后回输入病人体内特异性的识别并杀伤肿瘤细胞。科学家们在恶性黑色素瘤肿瘤组织中分离出肿瘤浸润淋巴细胞,在体外扩增并回输到病人体内,得到了良好的治疗效果。但是研究发现,在大部分实体瘤组织中很难获得TILs,因此只有少数的病人可以从这种方法中获益。1989年,Gross等首先在淋巴细胞表面表达了利用基因工程合成的受体。利用基因工程的方法使细胞过表达针对肿瘤相关抗原(Tumorassociatedantigen,TAA)的受体,体外扩增后再输入病人体内杀伤肿瘤细胞,成为的新的研究热点。
2.2.1TCR-T技术介绍
TCR(Tcellreceptor)是T细胞表面特异性识别抗原和介导免疫应答的分子。TCR主要识别由组织相容复合物分子提呈的抗原分子多肽。众所周知,大多数肿瘤相关抗原(TAA)是自身抗原,由于胸腺的选择机制和耐受机制,机体针对这些抗原产生的T淋巴细胞的大多数T细胞受体(TCR)的亲和力都比较低,从而限制了其肿瘤识别及杀伤效果。将克隆的高亲和力识别TAA的TCR(或嵌合受体)通过转基因技术转给T淋巴细胞,可以使重定向的原来无肿瘤识别能力的T细胞在体外和体内有效地识别并杀伤肿瘤细胞。
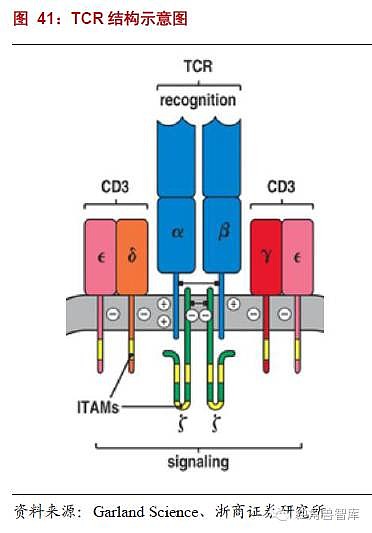
TCR为所有T细胞表面的特征性标志,以非共价键与CD3结合,形成TCR-CD3复合物。TCR的作用是识别抗原。TCR是由两条不同肽链构成的异二聚体,由α、β两条肽链组成,每条肽链又可分为可变区(V区),恒定区(C区),跨膜区和胞质区等几部分;其特点是胞质区很短。TCR分子属于免疫球蛋白超家族,其抗原特异性存在于V区。TCR分为两类:TCR1和TCR2;TCR1由γ和δ两条链组成,TCR2由α和β两条链组成。外周血中,90%-95%的T细胞表达TCR2;而且任一T细胞只表达TCR2和TCR1之一。
TCR-T是表达有同一TCR分子,因而能够识别同一特定抗原的一群T细胞,通过基因工程技术修饰的表达TCR的T细胞。
TCR-T技术优势:传统的免疫过继治疗,只是增加了效应细胞的数量,对于效应细胞的特异性并没有提高,而且效应细胞即使能和肿瘤细胞结合,其亲和力也比较低。TCR-T技术,直接改造T细胞的结合肿瘤抗原的“探头”-TCR,加强了T细胞针对肿瘤细胞的特异性识别过程,而且提高了T淋巴细胞对于肿瘤细胞的亲和力,使得原来无肿瘤识别能力的T细胞在体外和体内有效地识别并杀伤肿瘤细胞。总之,TCR-T细胞疗法,一边增加了T淋巴细胞的数量,一边提高了T淋巴细胞对于肿瘤细胞的杀伤性,“两手抓两手都要硬”,从而达到了很好的肿瘤治疗效果。
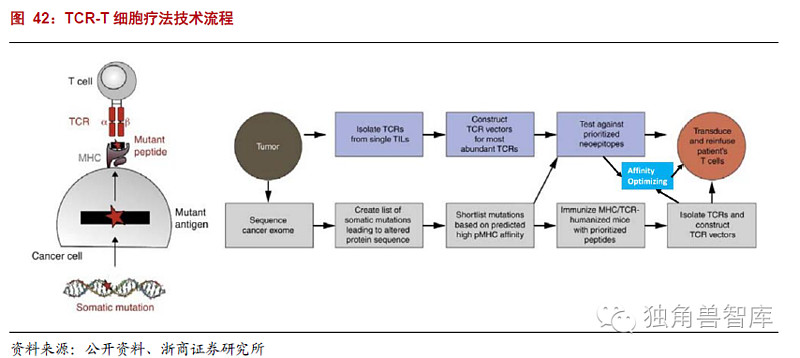
2.2.2TCR-T技术发展过程
最早开展TCR基因治疗始于2006年进行的一项临床试验,受试者为15例对IL-2治疗无反应的黑色素瘤患者。Rosenberg等利用逆转录病毒载体将特异性的TCR基因转导至黑色素瘤患者自体PBL中,并将其回输入患者体内,回输后2个月所有患者外周血中仍能检测到基因修饰的细胞,且占外周血细胞库的10%以上。在2例获得完全缓解的患者体内,一年后其外周血中仍能检测到高水平的TCR基因修饰T细胞,且这些T细胞仍保留较高的抗原反应性。3年后Rosenberg等又进行了一项内容相近的临床试验,同样釆用逆转录病毒载体,使其分别携带MART-1、gp100特异的高亲和力TCR基因,并将其转导至36名转移性黑色素瘤患者PBL中,接受此项TCR基因修饰T细胞过继输注的患者,临床缓解率分别达到30%与10%,但是由于黑色素抗原也存在于人的耳,眼,皮肤等组织中,高亲和力的TCR基因修饰的细胞也识别这些组织中的抗原并对这些组织造成了破坏。
除了黑色素瘤,近来也有学者尝试将TCR基因治疗拓展至结直肠癌,滑膜细胞癌,神经母细胞瘤,淋巴瘤等肿瘤的治疗上。Parkhurst等将癌胚抗原(carcinoembryonicantigen,CEA)特异性TCR基因修饰的T细胞过继回输给结直肠癌患者,输入后1个月,所有患者血清中CEA的含量均降低,并有3例肿瘤患者获得了完全缓解,但是由于CEA也表达于正常肠上皮细胞,所有接受过继回输的病人均发生了严重的急性结肠炎。
2.2.3TCR-T技术开发:创新突破高壁垒
TCR-T技术相对于CAR-T技术而言,要求更高的技术水平来突破高壁垒。
TCR-T细胞技术开发的难点包括:1、好的靶点的选择;2、寻找特异性的TCR;3、TCR最佳亲和力筛选;4、安全性评价;5、时间和成本的问题。这些问题成为TCR-T细胞疗法的壁垒,同时这些问题的解决成为评价TCR-T项目是否成功的关键点。
1、靶点选择
肿瘤免疫疗法的最大挑战之一,是新的安全目标抗原的鉴定发现。新的安全的靶点的选择,是癌症免疫治疗里最大的挑战。然而,细胞表面抗原仅占约10%的潜在目标,胞内抗原占据90%。因此开发胞内抗原就显得非常重要。癌症会存在大量体细胞突变,但是其中只有大约1%的变异可以产生变异性蛋白。变异蛋白中只有一部分可以产生潜在的T细胞表位。变异性蛋白只有一部分与癌症病程相关。因此,好的靶点的选择,是成功的开始。
未来肿瘤特意抗原的选择应局限于那些仅表达于肿瘤组织或不重要器官上的抗原,以减少因向自身抗原或同源抗原而带来的副反应。例如:睾丸癌(cancertestis,CT)抗原可表达于多种上皮细胞癌组织,比如黑色素瘤,膀胱癌,肝癌,肺癌等组织中,但同时也表达于正常成人的睾丸组织,不过辜丸细胞不表达人类白细胞抗原(humanleukocyteantigen,HLA)分子,所以转导的TCR不会对其造成损伤,鉴于CT的这一特性,目前正被越来越多的肿瘤研究者认可和采用。有文献报道,CT抗原NY-ESO-1表达于80%的滑膜细胞肉瘤患者和25%的黑色素瘤患者肿瘤组织中,因此Robbins等将NY-ESO-1表位特异的具有中等亲和力的TCR转导患者自体T细胞后分别过继给6例滑膜细胞肉瘤患者和11例黑色素瘤患者,其中4例滑膜细胞肉瘤患者和5例黑色素瘤患者取得了明显的疗效,并有2例黑色素瘤患者在年后发生了完全缓解,更重要的是,所有患者均未发生明显的不良反应。
2、安全性问题
两例患者接受了靶向MAGE-A3的TCR-T细胞治疗。在这2个案例中,均是因为正常组织表达这些靶点,导致急性不可逆的心肺毒性。所有的靶向毒性均是由于改造的T细胞无法区别表达靶向抗原的正常细胞和肿瘤细胞所致。高亲和力TCR改造的T细胞引起的毒性可能与亲和力成熟过程有关,因为“非肿瘤靶向”的高亲和力TCR的产生在生理条件下将受到限制。在设计TCR的过程中,小心筛选高亲和力的TCRs,并研究其对靶蛋白之外的其他抗原表位的识别显得十分必要。
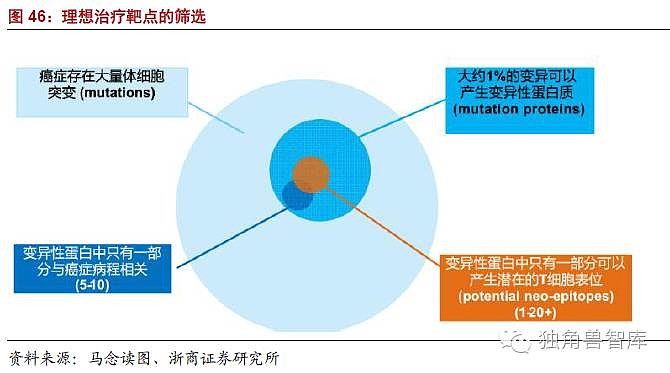
TCR-T的开发就是运用了胞内抗原,TCR-T产品开发最重要的是获得能够识别肿瘤抗原肽的TCR。最近研究表明,TCRs对于非突变的肿瘤多肽/I类复合物的亲和力要比TCR对于外来抗原的亲和力低。提高TCRs的亲和力,可以提高CD8+T细胞的活性。然而,TCRs亲和力的增强,也会增强与结构类似的自身多肽的反应,并且引起脱靶毒性,引起严重的副反应。因此,仔细选择肿瘤多肽抗原,体外多肽特异性测试对于开发有效和安全的TCR-T免疫过继治疗有重要的意义。TCR对于MHCI类多肽的亲和力,影响到CD8+和CD4+细胞的活性。CD8+细胞在低亲和力的情况下更敏感,在高亲和力范围内,结构相似的同源肽能够与T细胞产生交叉反应,从而产生安全性问题。
总结:TCR的亲和力过高过低都不行,亲和力过高则会出现交叉反应,产生临床事故,亲和力过低则没有效果。因此,可以通过敲除内源性TCR的方法达到目的,并且在TCR亲和力筛选过程中,做更多的验证性工作。
3、靶点发现和TCR亲和力筛选
噬菌体展示技术:噬菌体展示技术(phagedisplaytechnology)是将外源蛋白或多肽的DNA序列插入到噬菌体外壳蛋白结构基因的适当位臵,使外源基因随外壳蛋白的表达而表达,同时,外源蛋白随噬菌体的重新组装而展示到噬菌体表面的生物技术。到目前为止,人们已开发出了单链丝状噬菌体展示系统、λ噬菌体展示系统、T4噬菌体展示系统等数种噬菌体展示系统。噬菌体表面展示在抗原表位分析、抗体筛选、抗体酶和蛋白酶抑制剂研究等方面得到广泛成功的应用。
酵母展示系统:酵母细胞表达体系具备较为完善的蛋白质翻译后修饰和分泌的机制。以酵母为基础的细胞表面展示技术已成功应用于蛋白质识别、蛋白质的固定化和定向进化研究,成为了蛋白质工程研究的重要工具。根据与酵母细胞壁的外源目的蛋白融合部位的不同,酿酒酵母表面展示系统主要分为凝集素系统和絮凝素系统2大系统。噬菌体表面展示利用原核表达系统不能展示需糖基化、二硫键异构化等翻译后修饰才表现功能活性的复杂真核蛋白。后来发展的酵母表面展示系统则弥补了噬菌体展示技术不足,能使复杂真核蛋白得到展示,同时又保留了噬菌体表面展示技术的便于筛选扩增等优点。
核糖体展示技术:核糖体展示技术(RibosomeDisplayTechnology,RDT)是在多聚核糖体展示技术的基础上改进而来的一种利用功能性蛋白相互作用进行筛选的新技术,它将正确折叠的蛋白及其mRNA同时结合在核糖体上,形成mRNA-核糖体-蛋白质三聚体,使目的蛋白的基因型和表型联系起来,可用于抗体及蛋白质文库选择、蛋白质体外改造等。运用此技术已经筛选到一些与靶分子特异结合的高亲和力蛋白质,包括抗体、多肽、酶等,是蛋白质筛选的重要工具。核糖体展示技术完全在体外进行,与噬菌体或酵母菌展示技术相比具有建库简单、库容量大、分子多样性强、筛选方法简便、无需选择压力,还可通过引入突变和重组技术来提高靶标蛋白的亲和力等,是一种筛选大型文库和获取分子进化强有力的方法。如何进一步地提高该系统的稳定性;特别是如何防止mRNA的降解和形成稳固的蛋白质-核糖体-mRNA三聚体无疑是该技术的关键问题,如何提高大分子蛋白质在核糖体上的展示也是未来研究需要关注的问题。
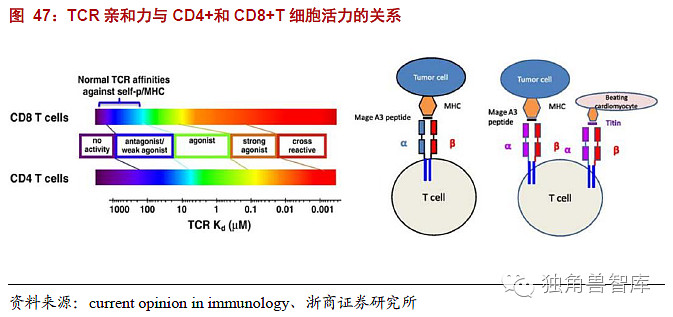
immTACs技术:目前世界上具备获得高亲和力TCR的公司只有Immunocore公司。ImmTACs使用了工程改造的TCR为基础的靶向系统。TCR识别细胞内抗原,处理并递呈到细胞表面,形成peptide-HLA复合物(pHLA)。通过噬菌体展示技术可以显著提高TCR的亲和力,比抗原抗体结合的亲和还要高9倍左右,因此更安全、有效。随着技术的转移和扩散,TCR-T的技术问题应该很快就会突破,并开始普及。
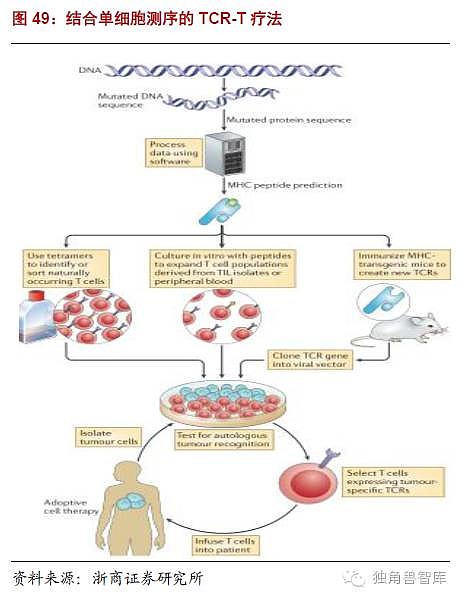
单细胞测序技术——个性化治疗的第一步:单细胞测序方法即singlecellsequencing(SNS),能准确定量一个单细胞核中基因拷贝数目。由于癌细胞中基因组部分被删除,或者扩增,从而引起关键基因的缺失,或者表达过量,干扰正常细胞生长,因此利用这种方法就能分析基因拷贝数目,从而诊断和治疗癌症。从疾病预后判断到病情监测,单细胞测序技术都将为肿瘤研究人员提供大量的信息。我们都知道,肿瘤细胞的突变速率非常快,且肿瘤组织是一种高度异质性的组织。确定肿瘤组织中存在哪些细胞亚群(或者叫克隆)具备转移能力,哪些克隆对化疗药物是敏感的,这些信息对于临床工作都非常有帮助。尤其针对隐藏在人体循环系统里的循环肿瘤细胞(circulatingtumorcell,CTC)进行全基因组或者转录组测序最有帮助,因为这些CTC细胞就是导致肿瘤转移的元凶,有关它们的信息对于疾病的诊断、监测和治疗都至关重要。结合单细胞测序技术,未来的TCR-T疗法的发展方向或许是个体化治疗。可以通过单细胞测序技术,了解个体肿瘤的信息,从而进行TCR定制服务。
小兽兽独角兽智库是一个新兴行业的产业研究、投资平台,平台有大量的投资机构和行业大牛,如果您关注新兴行业,请加小兽个人微信:itouzi5