
相关链接:
说说体外诊断试剂标准品、校准品、质控品那些事(一)
体外诊断试剂校准品、质控品研究技术指导原则
ISO 17511—IVD人的红宝书
ISO 17511第1版是2003年发布的,我们国家也等同转化为了国家标准GB/T 21415-2008。ISO 17511自发布以来,对IVD和检验医学的发展产生了重要影响,极大促进了IVD和检验医学的质量提升。近年来,随着计量学研究不断推进,以及临床检验量值溯源实践经验的积累,国际标准化组织临床实验室检验和体外诊断检验系统标准化技术委员会(ISO/TC 212)于2012年启动了对ISO 17511的修订工作,历时8年时间的精雕细琢,第2版于2020年4月24日正式发布了,这是我们IVD行业的重要事件,值得庆贺。
全国医用临床检验实验室和体外诊断系统标准化技术委员会(SAC/TC136)是ISO/TC 212在中国的对口组织,一直密切关注ISO 17511修订进展。我曾经是SAC/TC 136的委员,受TC 136指派,有幸参加了几次国际会议。在这里,结合自己对计量溯源性的理解和体会,就ISO17511主要变化和重要之处向大家做个介绍。
ISO 17511修订背景
ISO 17511第1版发布至今已近20年时间,在这期间,国际计量学和临床检验量值溯源研究取得重大进展,主要体现在:
①《国际计量学词汇-基础通用概念和相关术语》(International vocabulary of metrology-Basic and general concepts and associated terms(VIM))、《测量不确定度表示指南》(Evaluation of measurement data- Guide to the expression of uncertainty in measurement(GUM)) 等文件相继修订发布,这些文件是计量学研究的基础性、指南性文件;
②2002年6月国际计量局(International Bureau of Weights and Measures, BIPM)、国际临床化学与检验医学联合会(International Federationof Clinical Chemistry and Laboratory Medicine, IFCC)和国际实验室认可合作组织(International Laboratory Accreditation Cooperation, ILAC)合作成立检验医学溯源联合委员会(Joint Committee for Traceability in Laboratory Medicine,JCTLM)。JCTLM自成立以来,认可、发布了一批参考测量程序、参考物质和参考测量实验室,参考测量系统的建立完善对临床检验量值溯源实质性开展工作提供了必要条件;
③自2003年开始,由国际临床化学与检验医学联合会(IFCC)主办、德国临床化学和实验医学协会(DGKL)承办的国际医学参考实验室比对(IFCC-RELA)活动的开展,为实验室运行的参考测量程序的质量状况提供了评价平台;④近年来,国际学术机构提出“检验结果一致化”的新概念和相应技术途径,对临床检验标准化的理念进行了进一步拓宽和延伸。
基于上述情形下,ISO/TC 212第2工作组2012年3月在比利时吉尔市召开的工作组会议上,首次提出对ISO 17511进行修订。会后,ISO/TC 212成立了项目组,组长由ISO/TC 212第2工作组的召集人Neil Greenberg博士担任。在随后长达8年时间里,ISO/TC 212每年都会召开1到2次的会议进行修订,国际上众多该领域的权威专家都参与了该项工作。经过国际标准的投票程序,新版终于于2020年1月5号获批并于4月出版。
2、新旧两个版本的比较
03版ISO 17511有8章、21页、5个溯源模式,20版有6章、50页、6个溯源模式,从篇幅上看20版大大增加了。总体上来说20版比03版更详细,更具体,更针对IVD的特点和特殊性,更具有指导实践意义。归纳起来,新版有以下几点重要变化:
—扩展了标准的标题和适用范围,从校准物和正确度质控物的计量溯源性要求扩展到患者样本测量的计量溯源性要求;
—将ISO 18153酶催化浓度的计量溯源性相关内容整合到ISO 17511中;
—强调计量溯源性中的二级校准物、制造商工作校准物互换性的重要性;
—关注测量不确定度的重要性,校准等级中的每一步要控制测量不确定度,要评估终端用户校准物的测量不确定度;
—对那些没有参考测量程序也没有参考物质的检验项目,定义 “一致化”校准传递方案,并建立相关要求。
3、新版需重点关注的地方
关于这部分,是仁者见仁、智者见智,每个人关注的地方会不一样。我觉得重点的地方,是我以前理解不够深而这次通过学习新版觉得收获大的地方,下面我分章节介绍。
“范围”中增加了本标准适用于人样品中被测量的溯源性。另外,还明确提出本标准也适用于某些定性测量程序,即测量结果以数值为基础,通过预先设定的阈值进行分类。此外,针对目前越来越多的实验室自建项目(LDT),其溯源性也应该符合该标准要求,正是由于这种情况,20版里将产品校准物(product calibrator)换成了终端用户校准物(end-user calibrator)。
“术语和定义”章共有51个术语。本章节的修订原则是:能直接引用VIM就直接引用,或在VIM定义基础之上增加“注释”,以利于检验专业人员的理解;VIM没有的,给出新的或行业习惯用的术语及定义;删除没有必要列出的术语。重点关注:①用“分析选择性”取代“分析特异性”;②增加“高等级参考物质(higher order reference material)”、“高等级参考测量程序(higher order reference measurement procedure)”等术语,简单地说高等级参考物质应符合ISO 15194的要求,高等级参考测量程序应符合ISO 15193的要求;增加了“equivalence of measured values”和“international harmonisation protocol”。
第4章“建立计量学溯源性的通用要求和原则”,与03版相比,本章改动非常大,03版仅给出了溯源的一般原则,比较宏观和宽泛,20版相当于重新编写了。修订后的此章由9小节组成,涉及到文件化、定义被测量、校准物最大可允许测量不确定度、校准等级、参考物质和校准物、测量程序、测量不确定度评定、溯源确认、溯源职责。检验医学溯源会遇到的种种问题:被测量定义不充分;对特定化合物的超纯物质,识别其物质量单位时的技术问题;样品中分析物较复杂、不均一;临床实验室所用的测量方法对校准物和人样品中分析物具有不一样的选择性;人样品中的分析物具有与校准物不同的微观不均一性;人样品的基体不同于校准物;测量样品时被测量发生物理或化学修饰。以上种种情况是干扰建立计量学溯源链的技术原因,大多数与被测量定义相关,这也揭示了标准正文中对溯源模式进行修订的原因。9小节的具体内容,本文不再展开,等后续有机会再向大家介绍。
第5章“校准等级模式”,本章与03版也有较大差别。03版有5种校准等级模式,而修改稿中为6种模式,分别为①具有一级参考测量程序和一级校准物、能在计量上溯源到SI单位的情况;②无一级参考物质,但有参考测量程序,被测量由参考测量程序定义,能溯源到SI单位的情况;③具有一级参考物质,具有参考测量程序,被测量由参考测量程序定义,能溯源到SI单位的情况;④具有国际约定且符合ISO 1594规定的校准物(非一级),无参考测量程序,不能溯源到SI;⑤国际一致化方案所支持的计量学溯源性,既没有国际约定参考物质,也没有国际约定参考测量程序,不能溯源到SI;⑥被测量溯源到制造商内部定义的校准物。第1种、第4种、第6种模式与2003版相似,第2种、第3种模式变化较大,第5种模式即一致化方案是新增加的。
第6章“溯源性信息”对制造商提出了更明确的要求,产品校准品的溯源性细节和不确定度等相关信息要在技术文件中列出。
新版ISO 17511,是修订更是突破
新版ISO 17511有6种溯源模式(model calibration hierarchies for metrological traceablity)。
1、模式1 完整的校准等级和向SI的计量学溯源
这一类的测量项目有可用的一级参考测量程序和一级参考物质,具有良好决定的组分,如一些电解质、代谢物、甾体激素和一些甲状腺激素,在医学实验室提供的常规结果中,这些项目占较大部分。
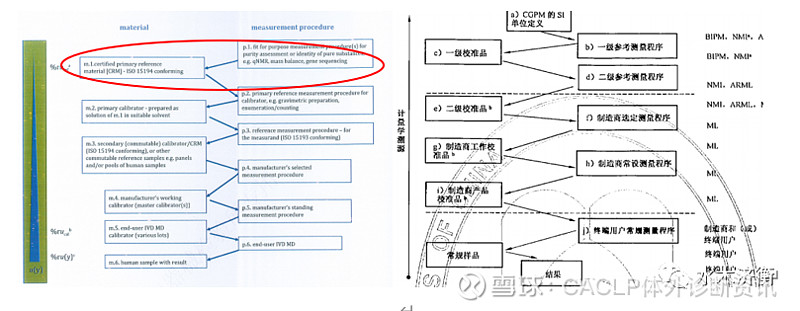
图1 新版ISO 17511模式1与03版的对照
新版模式1(见图1左)与03版模式1(见图1右)无本质区别。我个人认为新版增加了一些内容,首先,如图1左红框标出的,增加了p1和m1,这是03版没有的。增加的这一校准等级序列是与我们的实际工作相符合的,在溯源过程中,大家获得的是有证一级参考物质(m1),这些有证一级参考物质一般是纯物质,通常是国家计量部门研制的,通过定量核磁法(qNMR)、质量平衡法等方法(p1)对纯度定值。将m1通过重量法、计数法等方法(p2)配制获得一级校准物(m2)。m2校准一级参考测量程序(p3),下面与03版ISO 17511相同。m1到m2的这一步增加了不确定度,所以这也是新版ISO 17511细化溯源链的原因。其次,新版增加了一些项目,例如血细胞计数(03版中是第三种模式)、核酸拷贝数浓度、CD4细胞计数,也被纳入了可以溯源的类别中,基因测序法、流式细胞术(FCM)法、数字聚合酶链反应(dPCR)法、显微镜镜检法都被列入了参考测量程序,这些变化都是与技术的进步分不开的。
2、模式2 被测量由参考测量程序定义,无一级参考物质,能溯源到SI单位
这一类的测量项目是指酶催化活性浓度的溯源。在03版中,直接引用了模式1,其实是不太恰当的。我一再强调,新版ISO 17511是实践的总结、是技术的发展。大家看新版模式2(见图2),特别符合我们的实际工作情况。
在模式2,我们要注意两点,第一点是m1、m2、p2不适用,p1直接到了p3;第二点是标准中也提到某些凝血因子(例如VIII)的溯源也属于这种情况,而03版中是第3种模式。
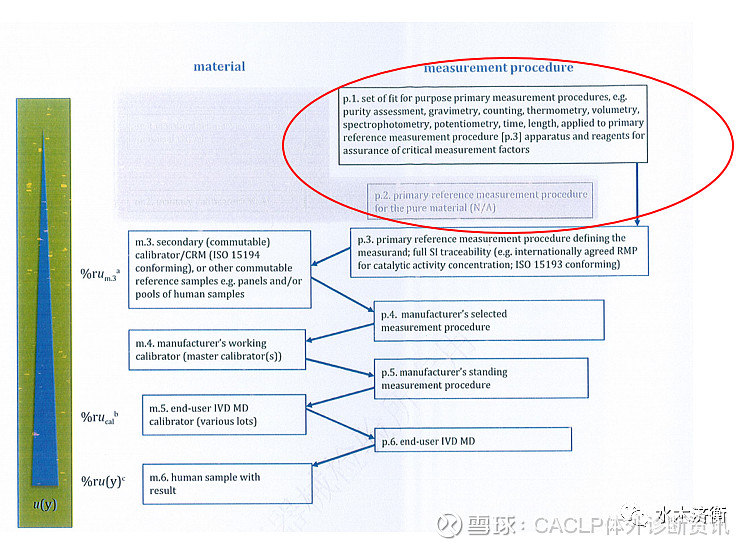
图2 新版ISO 17511模式2
3、模式3 被测量由参考测量程序定义,该参考测量程序由特定的一级校准物校准,能溯源到SI单位
这种情况是指参考测量程序检测的量,这个量不是预期要测量的量的整个分子结构,而是被测量的一个组分(例如一个肽段、一个抗原表位),由于参考测量程序对分子结构、抗原表位具有分析选择性(以前叫分析特异性),因此被测量是由这个参考测量程序定义的。这一类项目包括糖化血红蛋白(HbA1c)。
在模式3,我们要关注几点,首先,模式3与03版的模式2差别很大,03版模式2也是举例HbA1c的溯源模式,但是按照当时的技术水平,是属于有国际约定参考测量程序(非一级)和国际约定校准品,不能溯源到SI单位。10多年过去了,IFCC发展了高效液相色谱串联质谱、高效液相色谱串联毛细管电泳的参考测量程序,制备了HbA1c和HbA0的标准物质,建立国际参考实验室网络,这些工作推动了HbA1c计量溯源的发展。第2点要关注的是,猛一看溯源图似乎与模式1一样,但实际是有差别的,看图3红框标示部分,模式3被测量是由p3定义的,HbA1c被酶切成肽段,高效液相色谱串联质谱、高效液相色谱串联毛细管电泳参考测量程序选择性地测量HB糖化的N末端残基。 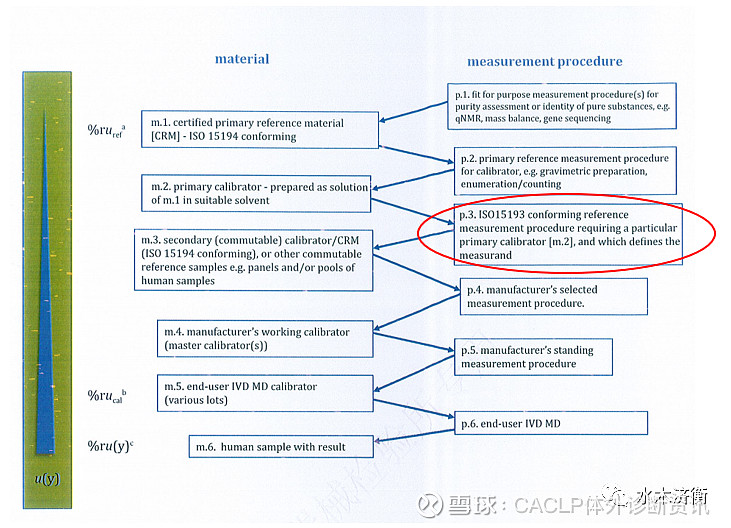
图3 新版ISO 17511模式3
4、模式4 被测量由国际赋值方案所定义,该方案给国际约定校准物(符合ISO 15194)赋值,不能溯源到SI单位
从模式4开始,不能溯源到SI单位。符合该种情况的是使用WHO国际标准物质的测量项目,如蛋白类激素、某些抗体和肿瘤标记物。
这种模式m1、m2、p1、p2都不适用。新版模式4(图4左)与03版模式4(图4右)相似,我不再详细介绍。
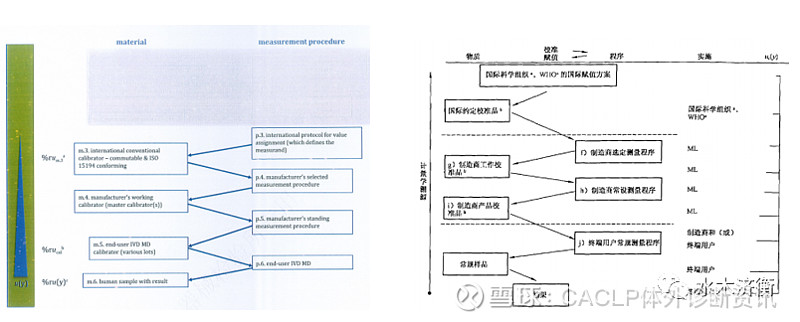
图4 新版ISO 17511模式4与03版的对照
5、模式5 被测量由国际一致化方案定义,没有有证标准物质,不能溯源到 SI单位
模式5是新版ISO 17511增加的,针对例如IFCC正在推动的甲状腺功能检测的国际一致化方案。对于模式5,ISO/TC 212同时发布了一个配套标准ISO 21151:2020《In vitro diagnostic medical devices — Requirements for international harmonisation protocols establishing metrological traceability of values assigned to calibrators and human samples》。
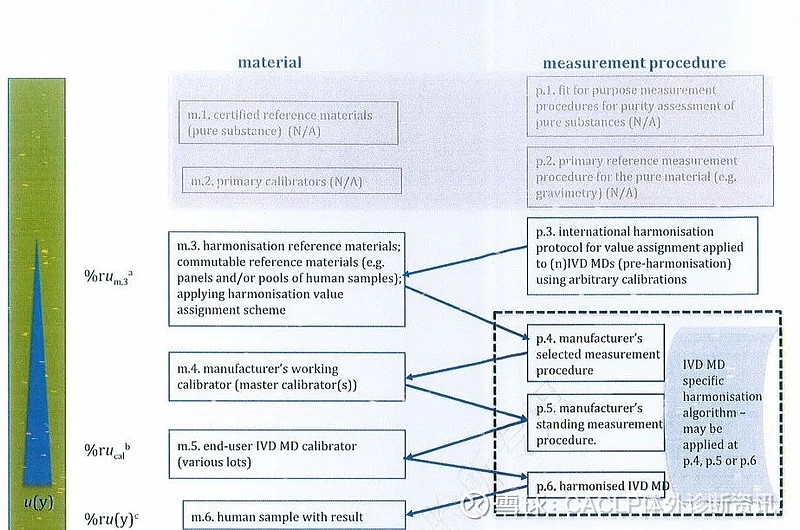
图5 新版ISO 17511模式5
6、模式6 被测量由制造商内部自定义的参考物质定义,没有一级参考物质和有证标准物质,也没有参考测量程序和一致化方案,不能溯源到 SI单位
模式6相当于03版的模式5,溯源到制造商自行建立的标准,例如大分子的抗体、肿瘤标记物等
模式6(图6左)与03版(图6右)虽然相似,但是还是有差别,比旧版多了m3,如图6左红框所示,新版模式6溯源的终点在于制造商自定义的参考物质(m3),被测量由这个参考物质定义。m3通常是一些纯品,例如针对抗原检测,m3往往是纯化的重组抗原,采用重量法或免疫分析方法(p4,制造商选定的测量程序)得到制造商工作校准物。下面的步骤两个版本相同。我本人认为这是符合我们IVD和临床检验的特点和实际情况的,更合理,在实践中,对于这样的量,IVD制造商就是这么做的。
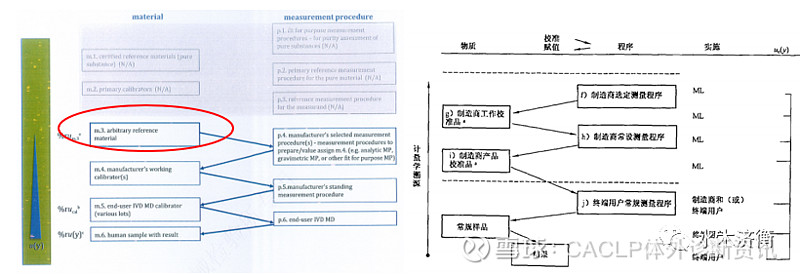
图6 新版ISO 17511模式4与03版的对照
新版ISO 17511就介绍到这儿,最后还想要表达:计量溯源性研究是复杂的、系统的课题,本人水平有限,来介绍这个难度较大的标准,满心的诚惶诚恐,但是我愿意“被拍砖”或者“被喷”,就是想着真理越辩越明。再一次想对大家说:希望大家多关注、多学习ISO 17511。
-END-
来源:水木济衡 | 作者:王军
编辑:As素 | 校对:Ryan | 供稿、责编:Weber

展会动态
CACLP·CISCE 2021年重庆1143家参展企业名录
观众预登记开通!现在注册立省50元现场门票费
CACLP · CISCE 2021重庆站——搭建商指南
CACLP · CISCE 2021重庆站——推荐酒店
阅读推荐
-中国体外诊断产品209项行业标准汇总
-2020年度器审中心体外诊断相关答疑汇总
-2020年度中国体外诊断大事记
-2020年度国内体外诊断相关企业融资一览
-431项免于进行临床试验的体外诊断试剂目录
-宋海波:我国体外诊断关键原材料现状及思考
-进击的分子诊断,PCR行业迎新机遇期
-10家IVD企业获“国家技术创新示范企业”称号(2011-2020)
声明:①本公众号原创发表的文章,任何个人、媒体、网站如需转载,须在文首位置注明转自“CACLP体外诊断资讯”,并注明作者。②本公众号所发表内容注明来源的,版权归原出处所有,与本公众号立场无关。如有侵权请联系微信【826699172】。
↙点击阅读原文 免费观众预登记