6月7日,亚盛医药在第57届美国临床肿瘤学会(ASCO)年会上,以口头报告形式公布了Bcl-2抑制剂lisaftoclax(APG-2575)在复发/难治性(R/R)慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)和其他血液恶性肿瘤患者的首次人体试验最新数据,以及MDM2-p53抑制剂Alrizomadlin (APG-115)联合帕博利珠单抗应用于经免疫肿瘤药物治疗失败的不可切除/转移性黑色素瘤或晚期实体瘤患者的II期临床研究最新数据。
作为日益活跃在国际学术舞台上的“中国声音“,亚盛医药已连续第四年亮相ASCO年会。今年,亚盛医药共有四项临床研究入选ASCO 年会展示及报告,其中2项口头报告的研究数据令人瞩目。APG-2575的最新临床数据初步表现出良好的有效性和安全性。其治疗R/R CLL/SLL患者的客观缓解率(ORR)达80.0%,且耐受良好,不良事件可控,在最高剂量1200mg仍未观察到剂量限制毒性(DLT),仍未达到最大耐受量(MTD),无临床或实验室肿瘤溶解综合征(TLS)报告。APG-115最新临床数据表现出良好的抗肿瘤活性和安全性,在其联合帕博利珠单抗治疗PD-1 / PD-L1抑制剂耐药的黑色素瘤队列中,有一例患者获得完全缓解(CR),该队列的ORR达24.1%,疾病控制率(DCR)达 55.2%。同时,研究还在多例患有其他肿瘤的受试患者中观察到部分缓解(PR)。
美国梅奥医学科学研究院(Mayo Clinic)医学教授、该项临床研究的全球主要研究者Asher Chanan-Khan博士表示:“APG-2575是一种有效的选择性Bcl-2抑制剂,能诱导细胞凋亡,抑制细胞生长。在美国及澳大利亚的首次人体研究中,APG-2575初步显示出对R/R CLL/SLL患者良好的安全性和极具潜力的抗肿瘤活性,并对其他几种血液系统恶性肿瘤也有潜在的疾病控制作用。基于这项I期临床研究的结果,我们期待进一步评估APG-2575在其他血液肿瘤或实体瘤中的抗肿瘤活性。“
美国NEXT肿瘤治疗中心(NEXT Oncology)的创始人和CEO、美国德克萨斯州肿瘤治疗中心的临床研究主任、该项临床研究的全球主要研究者Anthony W. Tolcher博士表示:“这项口头报告中公布的临床数据令人振奋,它展示了APG-115在多种难治肿瘤及多个相关适应症中的初步临床疗效,尤其包括复发/难治性黑色素瘤在内的多个尚无标准治疗方案的肿瘤。此外,这些数据也为前不久在Nature Immunology 杂志上发表的文章提供了临床验证。那篇具有突破性意义的文章揭示了APG-115通过抑制MDM2通路,控制T细胞介导的肿瘤免疫并维持STAT5的稳定性,从而获得与免疫疗法的协同效应的作用机制。文章同时解释了为何APG-115联合肿瘤免疫药物帕博利珠单抗或可为经肿瘤免疫疗法治疗失败的患者带来临床获益。”
“APG-2575初步在R/R CLL/SLL患者中显示了80%的客观缓解率,以及良好的安全性,即使每日递增剂量,仍未观察到肿瘤溶解综合征。该结果非常令人振奋,并再一次展现了APG-2575的“同类最佳“潜力。APG-115联合帕博利珠单抗的这项研究,为MDM2-P53抑制剂与现有免疫肿瘤药物之间的协同效应提供了临床依据,并显示出其作为一种治疗新选择的潜力,这为实体瘤患者带来了新的希望。” 亚盛医药首席医学官翟一帆表示:“今年,我们在ASCO年会上进行了包括APG-2575、APG-115在内的两项口头报告和两项壁报展示。对此我感到非常自豪,因为这是亚盛医药全球创新能力的体现。未来,我们将继续秉持初心,坚守‘解决中国乃至全球患者尚未满足的临床需求‘这一使命,加快临床开发,让安全有效的药物尽快上市,早日惠及患者。“
亚盛医药在2021 ASCO年会上展示的临床研究概览:
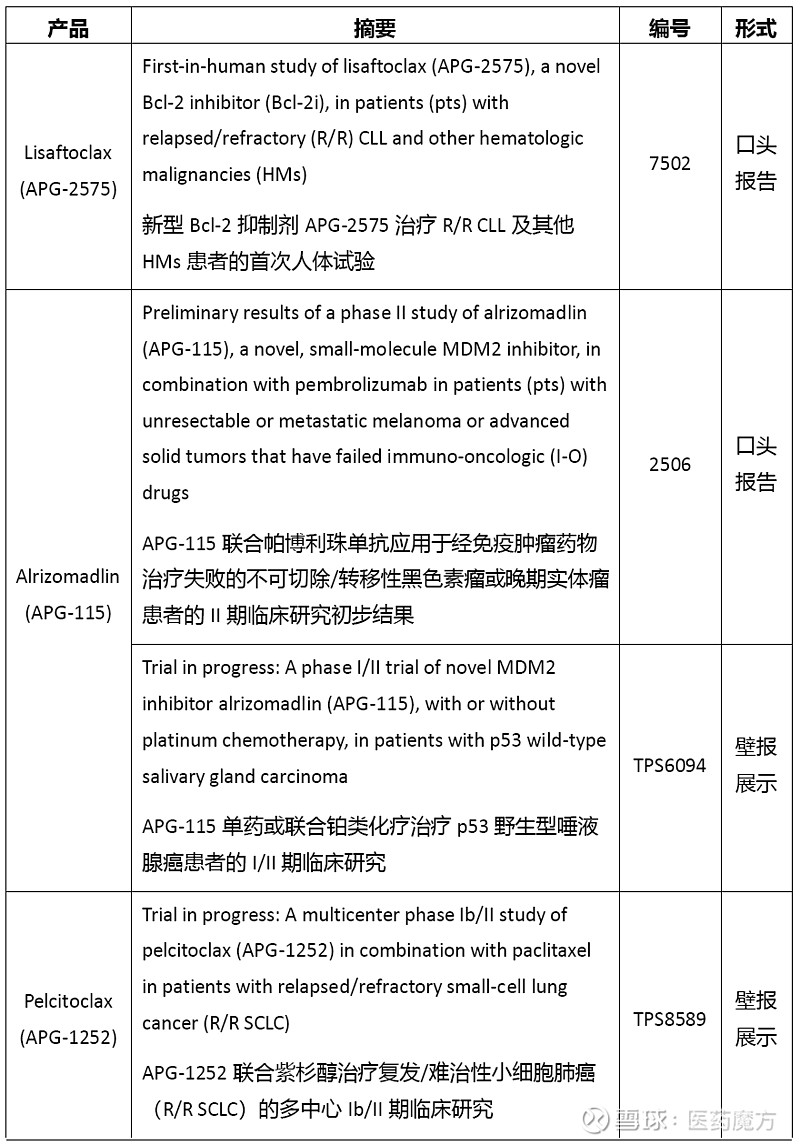
在此次ASCO年会上口头报告的两项临床研究核心要点:
Abstract:First-in-human study of lisaftoclax(APG-2575), a novel Bcl-2 inhibitor (Bcl-2i), in patients (pts) with relapsed/refractory (R/R) CLL and other hematologic malignancies (HMs)
新型Bcl-2抑制剂APG-2575治疗R/R CLL及其他HMs患者的首次人体试验
摘要编号:#7502
这项首次在人体进行的全球I期临床研究评估了APG-2575在R/R CLL和其他HMs患者中的安全性、药代动力学(PK)、药效动力学(PD)、疗效和最大耐受量(MTD)/II期研究推荐剂量(RP2D)。APG-2575每日口服一次,28天为一个周期。CLL患者或肿瘤溶解综合征(TLS)中/高风险患者通过每日剂量递增达到指定剂量。
截至2021年4月15日,36例患者被纳入研究,接受APG-2575 20-1200mg治疗,他们的既往中位治疗线数(范围)为2(1-13),被诊断为R/R CLL/SLL(n=15)、多发性骨髓瘤(MM)(n=6)、滤泡性淋巴瘤(FL)(n=5)、华氏巨球蛋白血症(WM)(n=5),以及急性髓系白血病(AML)、套细胞淋巴瘤(MCL)、弥漫大B细胞淋巴瘤(DLBCL)、骨髓增生异常综合征(MDS)或毛细胞白血病(HCL;分别n=1)。这些患者接受了中位(范围)6(1-24)个周期的APG-2575治疗。
APG-2575耐受性良好,不良事件可控。在最高剂量1200mg仍未观察到剂量限制毒性(DLT),未达到MTD,无临床或实验室TLS报告。在被观察到的任何级别治疗相关不良事件(TRAEs)中,发生率大于10%的血液学TRAEs包括中性粒细胞减少和贫血,非血液学TRAEs包括疲乏、腹泻、便秘和恶心。
15例可评估的R/R CLL/SLL患者中,7例(46.7%)为Rai分类病期Ⅲ-Ⅳ期,7例(46.7%)为国际预后指数(IPI)高危-极高危。中位(范围)治疗9(5-24)个周期,12例患者获得部分缓解(PR),ORR为80.0%,中位(范围)反应时间为2(2-8)个治疗周期。
21例R/R非 CLL/SLL患者的中位(范围)既往治疗线数为3(1-13),其中可评估患者20例。1例伴有t(11;14)突变的MM患者在治疗2个周期后获得轻微缓解(MR)。共10例(50%)患者达到疾病稳定(SD)或更深度的缓解。
初步PK结果显示,APG-2575的暴露量从20mg到1200mg逐渐增加(平均半衰期:4-5小时)。在BH3表达谱上,APG-2575迅速触发CLL/SLL患者样本中BCL-2复合物的变化,这与临床上淋巴细胞绝对计数(ALC)的快速降低表现一致。
结论:有效性和安全性数据表明,Bcl-2抑制剂APG-2575为R/R CLL/SLL患者和其他HMs患者提供了一种卓有潜力的替代治疗方案,其每日剂量递增方案对患者更友好。
Abstract:Preliminary results of a phase II study ofalrizomadlin (APG-115), a novel, small-molecule MDM2 inhibitor, in combinationwith pembrolizumab in patients (pts) with unresectable or metastatic melanomaor advanced solid tumors that have failed immuno-oncologic (I-O) drugs
APG-115联合帕博利珠单抗应用于经免疫肿瘤药物治疗失败的不可切除/转移性黑色素瘤或晚期实体瘤患者的II期临床研究初步结果
摘要编号:#2506
这是一项在美国进行的开放、多中心的II期研究,旨在评估APG-115联合帕博利珠单抗在晚期实体瘤患者中的安全性、耐受性、PK、PD和抗肿瘤活性。
截至2021年4月15日,共有102例患者被纳入II期研究。APG-115 根据RP2D剂量150毫克隔日口服一次,并与帕博利珠单抗联用。此项研究共有6个研究队列,分别为:PD-1 / PD-L1抑制剂耐药的黑色素瘤、非小细胞肺癌(NSCLC)、尿路上皮癌;常规治疗失败的恶性外周神经腱鞘瘤(MPNST)、脂肪肉瘤和ATM突变型实体瘤。
疗效观察显示:
1) PD-1 /PD-L1抑制剂耐药的黑色素瘤队列(n=29):7例葡萄膜(眼)黑色素瘤患者中有1例确认为PR;5例粘膜黑色素瘤患者中有2例PR(1例确认+ 1例未确认);15例皮肤黑色素瘤患者中有1例CR(已确认)和3例PR(2例确认 +1例未确认)。黑色素瘤队列的ORR达到24.1%(7/29),疾病控制率(DCR)为 55.2%(16/29)。
2)MPNST队列(n=6): 1例PR(未确认)。
3)脂肪肉瘤队列 (n=16): 1例PR(未确认)和12例SD,DCR 为 81.2%(13/16)。
4)在PD-1 / PD-L1抑制剂耐药的NSCLC (n=15)和尿路上皮癌 (n=8)队列中,分别有1例确认PR 。
在被观察到的任何级别治疗相关不良事件(TRAEs)中,发生率大于10%的TRAEs有恶心、血小板减少、呕吐、疲乏、食欲下降、腹泻、中性粒细胞减少和贫血。
结论:APG-115联合帕博利珠单抗的耐受性良好,且无叠加毒性。这一初步研究结果为APG-115联合帕博利珠单抗治疗经肿瘤免疫疗法后复发/难治性转移性黑色素瘤(包括葡萄膜、粘膜和皮肤黑色素瘤)提供了临床依据。同时,该联合治疗在帕博利珠单抗无获批适应症的MPNST和脂肪肉瘤患者中也具有良好的抗肿瘤活性。
关于亚盛医药
亚盛医药是一家立足中国、面向全球的处于临床开发阶段的原创新药研发企业,致力于在肿瘤、乙肝及与衰老相关的疾病等治疗领域开发创新药物。2019年10月28日,亚盛医药在香港联交所主板挂牌上市,股票代码:6855.HK。
亚盛医药拥有自主构建的蛋白-蛋白相互作用靶向药物设计平台,处于细胞凋亡通路新药研发的全球最前沿。公司已建立拥有8个已进入临床开发阶段的1类小分子新药产品管线,包括抑制Bcl-2、IAP 或 MDM2-p53 等细胞凋亡路径关键蛋白的抑制剂;新一代针对癌症治疗中出现的激酶突变体的抑制剂等,为全球唯一在细胞凋亡路径关键蛋白领域均有临床开发品种的创新公司。目前公司正在中国、美国、澳大利亚及欧洲开展40多项I/II期临床试验。用于治疗耐药性慢性髓性白血病的核心品种HQP1351已在中国递交新药上市申请,并获纳入优先审评和突破性治疗品种。该品种还获得了美国FDA审评快速通道及孤儿药认证资格。截至目前,公司共有4个在研新药获得11项FDA孤儿药资格认证。