近日,“Unmet medical needs(UMN)”这一概念随着美国食品药品监督管理局(FDA)的新药审批新闻进入大众视野,“新药获批需解决未满足的医疗需求”这一标准正在逐渐成为业界判断FDA是否批准一款新药上市的一个重要因素。但受各个国家和地区及患者所面临的医疗状况影响,目前对 “未满足的医疗需求”的定义还是有较为明显的差异。本文将以多发性骨髓瘤为例,浅谈UMN对于多发性骨髓瘤(MM)药物研发的驱动作用以及MM依旧存在的UMN和可能的解决方案。
对UMN的定义逐渐达成共识
欧洲药监局(EMA)对于未满足的医疗需求定义为:“Unmet medical needs means a condition for which there exists no satisfactory method of diagnosis, prevention or treatment in the Union or, even if such a method exists, in relation to which the medicinal product concerned will be of major therapeutic advantage to those affected”。我们可以将EMA对UMN的定位归纳为,诊断,预防及治疗三个方面,通过满足以上三点来寻求令人满意的解决方案。与欧洲不同,FDA对于解决医疗需求则定义为: “ Filling an unmet medical need is defined as providing a therapy where none exists or providing a therapy which may be potentially better than available therapy.” 其重点更多是对更优的疗效或是填补疗法空缺这两方面。
中国国家药品监督管理局(NMPA)与日本厚生労働省(MHLW)虽未直接对未满足的医疗需求下定义,但通过优先审批、附条件审批等流程中要求,可侧面印证两者对于医疗需求的关注点。2020年10月NMPA发布的《境外已上市境内未上市药品临床技术要求》基于我国患者的医疗需求提出了不同的技术要求。对用于临床缺乏有效治疗手段的危重疾病和罕见病治疗的药品等,监管机构持鼓励态度,以解决公众用药可获得性为首要前提进行审评审批。MHLW在优先审批上要求: “1.No standard existing therapy or superior clinical usefulness as compared with the existing products in terms of quality of life of patients, efficacy, or safety. 2. Applicable to serious diseases or orphan drug designation.”。两方都聚焦于危重疾病的空白或更优疗法的探索与疗法的可及性上。

各个国家与地区,不同监管机构都基于环境与立场,对UMN进行理解与不同的解读。EMA 的专家Jocelijn Stokx认为应对UMN进行更加详细的定义,从疾病的危害性,患者的生命质量与安全及社会的医疗负担等角度出发,贴近真实的需求。但值得注意的是,UMN与药物定价之间没有直接关系,药物定价也不会成为监管当局审批的主要考量因素。同时专家也认为随着全球多中心临床试验的推进,国际社会对UMN需要逐渐达成共识,这将有助于全球多中心临床试验的开展,以及国家间新药审批规范的确立,从而加速创新药物惠及全球患者。

未满足的医疗需求——以多发性骨髓瘤为例
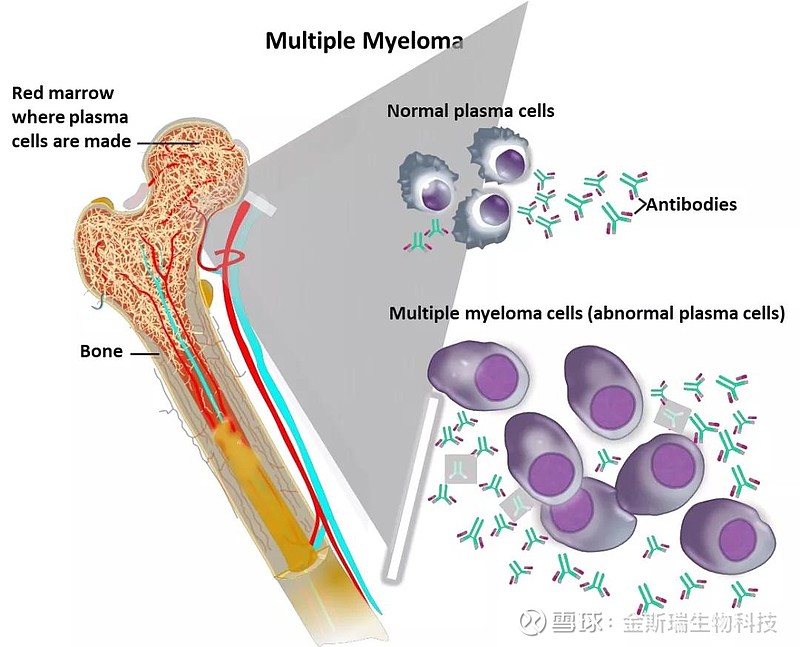
图1
多发性骨髓瘤(Multiple Myeloma, MM)是骨髓浆细胞的一种恶性肿瘤(图1),表现为浆细胞恶性增生,广泛浸润并分泌大量单克隆蛋白(M蛋白),引起贫血、溶骨性病变、血清肌酐水平升高、高钙血症、淋巴结肿大、白细胞减少和血小板减少等临床症状。据 GlobalData预测,2027年MM全球患者将达56万例,其中美国患者约占40%。在中国,患病率也连年增高并呈年轻化趋势。MM已成为第二大常见血液系统恶性肿瘤,约占血液系统恶性肿瘤的10%,五年生存率约为50%。毫无疑问,MM是一种威胁人类健康的危重疾病并且在临床治疗上存在巨大缺口。
现存疗法无法充分满足MM的治疗需求
造血干细胞移植是一种重要的主流MM治疗手段,一旦患者确诊MM后,就应启动初始诱导治疗并进行移植评估,但因为MM患者中位诊断年龄较大与器官功能状态不能支持的原因,一部分患者不适宜移植疗法。同时,接受过造血干细胞移植的患者,复发率及疾病进展的情况依旧不容乐观。早期移植较晚期移植在一定程度上改善了高危组患者的生存,III期患者接受晚期移植后的疾病无进展时间仅为5.9月,且两种移植方案尚无法有效改善或克服不良预后因素对生存的影响。因此对MM创新性疗法的探索应运而生,以满足患者 “未满足的医疗需求” 。
2000年免疫调节剂沙利度胺用于临床后,MM患者的生存期得到了显著改善。蛋白酶体抑制剂硼替佐米(万珂,Velcade),伊沙佐米( 恩莱瑞,Ninlaro)和下一代免疫调节剂来那度胺(瑞复美,Revlimid)获批后,更是为患者提供了化疗之外的其他选择。2021年中国临床肿瘤学会(CSCO)指南大会上,推荐不适宜移植的MM患者诱导治疗使用 “硼替佐米/沙利度胺+马法兰+地塞米松”的混合疗法;维持治疗使用”伊沙佐米“、“来那度胺+硼替佐米/伊沙佐米”。免疫调节剂与蛋白酶体抑制剂部分缓解了无法进行移植患者的医疗需求,但仍留下了疾病复发,预后生存差的临床缺口。

来那度胺

伊沙佐米
复发后的治疗需求
无论是造血干细胞移植还是药物混合疗法,一般认为只能治疗MM,不能治愈该种疾病,绝大部分患者治疗后经历复发。而疾病复发/进展恰恰是MM患者最常见的死亡原因。针对复发/难治性多发性骨髓瘤(R/R MM)患者的治疗需求,杨森制药与Genmab开发的的达雷妥尤单抗(兆珂,Darzalex)于2019年7月在国内获批。达雷妥尤单抗是全球首个作用于CD38的全人源单克隆抗体,用于接受过包括蛋白酶体抑制剂和免疫调节剂的单药治疗后复发且最后一次治疗时出现疾病进展的成年患者。
同年,德琪医药开发的选择性核输出抑制剂—Selinexor(塞利尼索)被FDA批准,联合低剂量地塞米松用于R/R MM患者;联合硼替佐米和地塞米松治疗既往接受过至少一种治疗方案的MM患者。2020年8月6日,葛兰素史克开发的Blenrep(Belantamab mafodotin),一种包含微管抑制剂单甲基耳他汀F(MMAF)偶联靶向B细胞成熟抗原(BCMA)的抗体药物偶联物(ADC)药物,获得FDA的批准用于治疗已接受至少四种先前疗法(包括抗CD38单克隆抗体)的R/R MM成年患者,但是目前其角膜病变的不良反应依然显著。
其他针对BCMA的疗法包括蓝鸟和百时美施贵宝开发的CAR-T药物Abecma,于2021年3月、8月分别在美国、欧盟获批,用于既往接受过4种或更多种疗法的R/R MM成人患者。在Abecma II期临床试验中,严格意义的完全缓解为28 %。这些药物一定程度地满足了R/R MM患者的治疗需求,但是治疗的预后与生存期问题依然有待解决。
需求-迈进-新需求
2021年11月,达雷妥尤单抗获国家药品监督管理局批准,与来那度胺和地塞米松联合用药或与硼替佐米、美法仑和泼尼松联合用药治疗不适合造血干细胞移植的新诊断的多发性骨髓瘤成年患者。达雷妥尤单抗适应症由R/R MM推进到MM的根本原因为目前的混合疗法并不能满足所有不适宜造血干细胞移植的MM患者需求,特别是有遗传风险因素的患者。但随着在治疗范式中越来越多地采用 达雷妥尤单抗,越来越多的患者对达雷妥尤单抗生耐药性。对达雷妥尤单抗耐药的患者治疗方案又将成为下一代MM创新药要瞄准的新医疗需求。
MM未满足的医疗需求将持续存在于高危细胞遗传学患者与重度治疗患者中。如何针对性的展开治疗,提高患者的治疗生存率?传奇生物与杨森制药开发的西达基奥仑赛或许是满足这些医学需求的答案。西达基奥仑赛是由两个靶向BCMA的单域抗体组成的具有差异化结构的CAR-T。基于结构设计上的优势,在治疗R/R MM患者的临床研究中,西达基奥仑赛表现出优异的临床疗效及良好的耐受性。
2021年12月,CARTITUDE-1的两年期最新数据在ASH上公布,客观缓解率(ORR)继续高达98 %,严格意义上的完全缓解率为83 %,无进展生存率和总生存率分别为61 %和74 %。传奇生物与杨森制药已经在美国,欧洲及日本提交西达基奥仑赛用于治疗末线多发性骨髓瘤患者的新药上市申请。我们期待这一疗法,可以早日造福患者,满足“未满足的医疗需求”。
结 语
MM作为一种严重危害人类生命健康的恶性肿瘤,其药物开发过程基于医疗需求驱动,并且各种疗法发展后又产生了新的医疗需求。科学家坚持不懈,不断为满足MM患者的生存需求,提高其生命质量而进行药物创新过程,正是践行希波克拉底誓言中对“人类生命最大尊重”的体现。
扩展阅读(浅谈多发性骨髓瘤专题):
参考文献:
1.EMA: Unmet medical need; definitions and need for clarity
2.FDA: Fast Track, Breakthrough Therapy, Accelerated Approval, Priority Review
3.NMPA:境外已上市境内未上市药品临床技术要求
4.Flexible and Expedited Regulatory Review Processes for Innovative Medicines and
Regenerative Medical Products in the US, the EU, and Japan
5.中国多发性骨髓瘤自体造血干细胞移植指南(2021年版)
6.2021 CSCO指南:多发性骨髓瘤更新要点
7.多发性骨髓瘤患者自体造血干细胞移植后长期随访的单中心结果