文章来源:“凯莱英药闻”微信公众号
月9日,跨国制药巨头赛诺菲公布旗下工程化IL-2药物THOR-707(SAR444245)中期临床阳性数据。
中期临床结果显示,与临床前数据一致,患者在首次服用THOR-707后体内CD8+T细胞和NK细胞数量增加,并且整个给药周期内持续增加,具有剂量递增效应;与K药(pembrolizumab)联合使用时,这种效应更加明显。未观察到CD4+调节性T细胞或嗜酸性粒细胞显著增加,表明THOR-707对α-IL-2受体没有选择性。
安全性方面:报告剂量下,THOR-707未观察到剂量限制性毒性,单药剂量高达24μg/kg,联合用药剂量高达16μg/kg。第一次给药后最常见的治疗期间出现的不良事件(TEAE)包括流感样症状、发热、呕吐/恶心和寒战。症状是暂时的,并解决了标准的支持性护理。3-4级相关毒性反应——T细胞扩增前出血一过性淋巴细胞计数下降。
鉴于THOR-707良好的安全性表现,赛诺菲计划将单药Ⅱ期临床研究推荐剂量上调至每三周给药24μg/kg至32μg/kg。
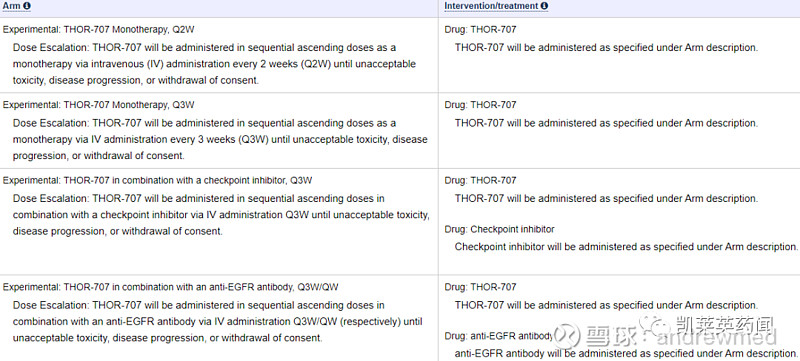
本次公布的中期数据是全球多中心I/II期临床试验THOR-707-101的一部分,该项临床试验代码为NCT04009681,计划在美国、澳大利亚、新加坡等地纳入300位实体瘤患者,共4臂:单药每两周给药一次;单药每三周给药一次;联合K药每三周给药一次;联合抗EGFR单抗每三周给药一次。
本次中期临床数据公开时,赛诺菲还表示计划开展THOR-707联合CD38单抗Isatuximab的临床试验。
天然IL-2(白细胞介素-2)有两种不同的受体结合形式:
a.高剂量下,IL-2与CD4+免疫抑制调节性T细胞(Tregs)表达的IL-2受体α、β和γ亚基复合物结合。IL-2受体α、β和γ复合物也在2型固有淋巴细胞和嗜酸性粒细胞上表达。这些细胞介导血管渗漏综合征(VLS),一种严重的IL-2临床不良反应,导致低血压、肺水肿和肝肾休克。
b.低剂量下,它与CD8+T和自然杀伤(NK)细胞上表达IL-2的β和γ受体复合物结合,这些细胞对抗肿瘤反应至关重要。
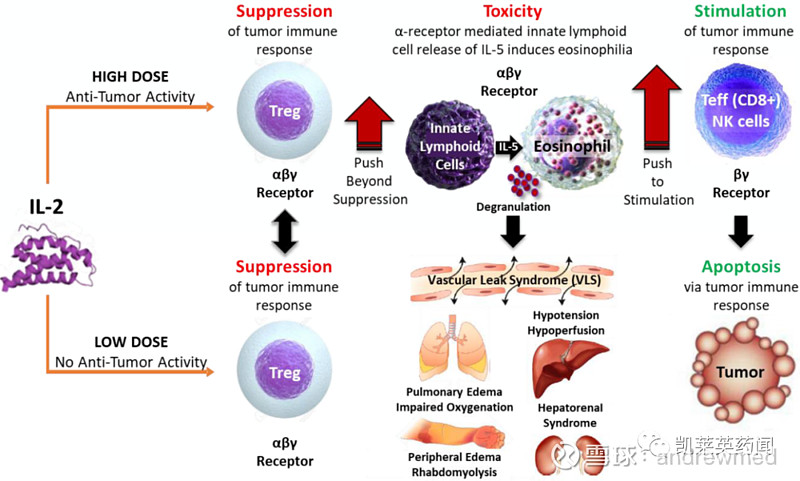
THOR-707原研公司为Synthorx,2019年被赛诺菲以25亿美元收购。Synthorx利用工程细菌在天然IL-2结构中融入了非天然氨基酸,将一种不可cleavable的PEG基团附着在这一非天然氨基酸上,从而产生了 ‘not-α’ IL-2——THOR-707,THOR-707对IL-2受体β和γ复合物具有野生型亲和力,但不与α链结合的IL-2药物。
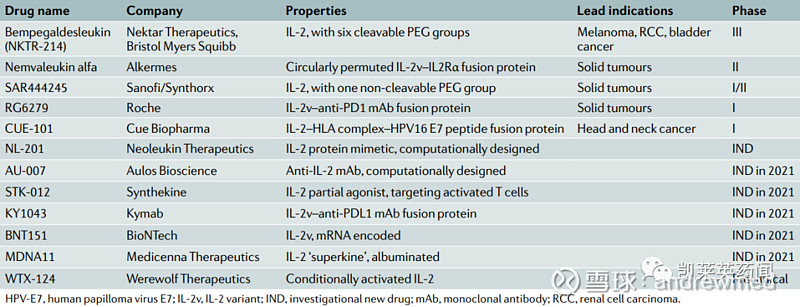
当前开发IL-2类药物一般以避免高剂量用药毒副作用为主要目的,如Nektar Therapeutics与BMS开发的靶向IL-2受体β亚基(CD122)的Bempegaldesleukin(NKTR-214)目前已进入III期临床阶段,该药已被FDA授予治疗不可切除或转移性黑色素瘤突破性疗法。
Alkermes开发的 nemvaleukinalfa,由IL-2变体与α链融合而成,阻断与调节性T细胞上内源性α链相互作用,目前已开展II期临床,获FDA授予治疗粘膜黑色素瘤孤儿药资格。
目前IL-2类药物及开发情况
版权说明:本文来自凯莱英,感谢关注、转发。欢迎媒体/机构转载,转载请注明来自“凯莱英药闻”。