(一)上市依据——鹅国III期临床试验(PPS集)
根据真实生物的官微,阿兹夫定附条件上市的依据是,鹅国III期临床试验(PPS集)。
而不是FAS。

(二)鹅国III期临床还没有完成。
根据《真实生物IPO招股说明书》,鹅国III期临床试验没有完成。

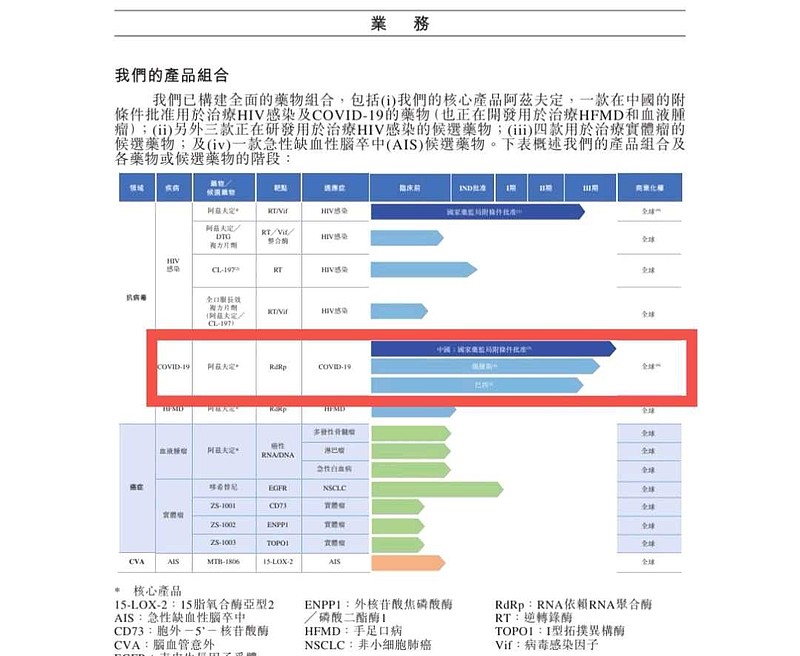
(三)阿兹夫定在鹅国开展临床试验面临的风险
根据《真实生物IPO招股说明书》,因鹅国的研发活动面临更高的制裁合规风险。

(四)鹅国III期临床试验314例入组患者,仅仅纳入了279例患者进入PPS集,进行分析的原因?
仔细阅读《真实生物IPO招股说明书》,没有相关信息披露PPS集的基线状态。
也没有披露鹅国III期临床设置的主要终点,是不是第7天临床状态改善?
也没有披露FAS中,有无重症发生/死亡发生?

2022年8月11日-13日,由中华医学会、中华医学会感染病学分会主办的第十七次全国感染病学术会议在安徽合肥举行,阿兹夫定专题研讨会格外引人瞩目。
来自首都医科大学北京地坛医院感染临床和研究中心的张福杰主任详细的介绍了目前阿兹夫定抗新冠病毒的临床研究成果。

在俄罗斯开展的Ⅲ期临床试验,是由俄罗斯3家临床中心参与的前瞻性、随机、双盲、安慰剂对照研究,纳入314例新冠病毒中度感染的成年患者,按照1:1随机分别给予阿兹夫定5mg,每日一次+基础治疗和安慰剂+基础治疗,试验方案治疗最多14天。

总结
阿兹夫定获CDE批准附条件上市,向全球展现了中国创新药研发的实力。
值得每一位中国人的关注。
鉴于阿兹夫定疗效显著,应该与辉瑞Paxlovid进行头对头对照III期临床试验,占领海外市场。
转发,$君实生物-U(SH688180)$ ,$华润双鹤(SH600062)$ ,$复星医药(SH600196)$