(一)前文
$百济神州-U(SH688235)$ 今天宣布,PD-1单药(替雷利珠单抗)一线治疗肝细胞癌国际多中心3期临床rationale-301研究主要终点OS达到#非劣效#(对照组是索拉非尼单药,开放标签) 。
今年8月,默沙东K药+仑伐替尼一线治疗肝细胞癌国际多中心3期临床LEAP-002研究主要终点OS#没有达到优效# (对照组是仑伐替尼单药,头对头双盲对照)。
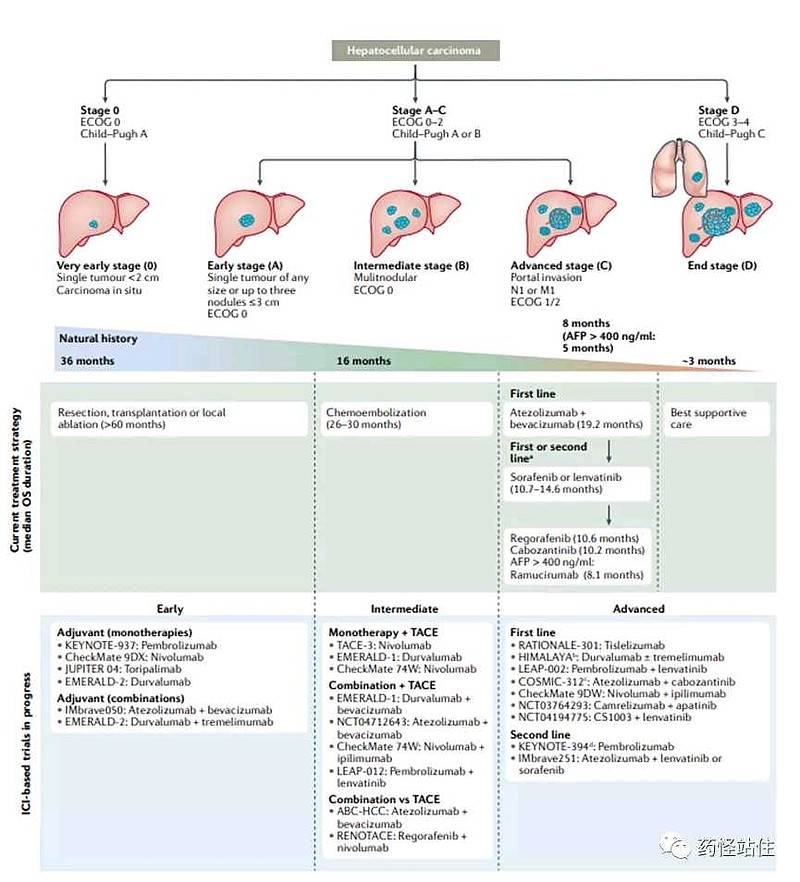
(二)中国🇨🇳上市预测,成功概率接近100%
由于中国🇨🇳阿兹夫定治疗‘‘口罩疾病’’研发进展快,临床试验数据水平高,CDE全票通过批准上市紧急使用。
推测CDE也会批准百济神州PD-1单药一线治疗肝细胞癌。
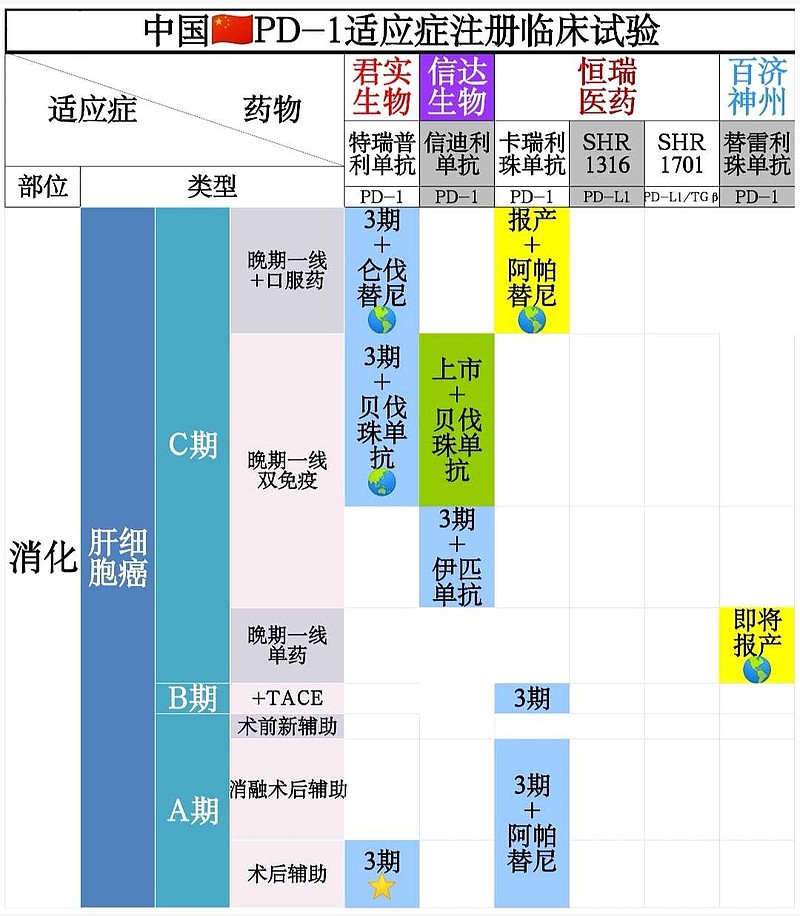
需要注意,$君实生物-U(SH688180)$ PD-1联合贝伐珠单抗一线治疗肝细胞癌是亚洲多中心3期临床,君实生物PD-1联合仑伐替尼一线治疗肝细胞癌是国际多中心3期临床。
(三)美国🇺🇸上市预测,FDA能否批准上市?

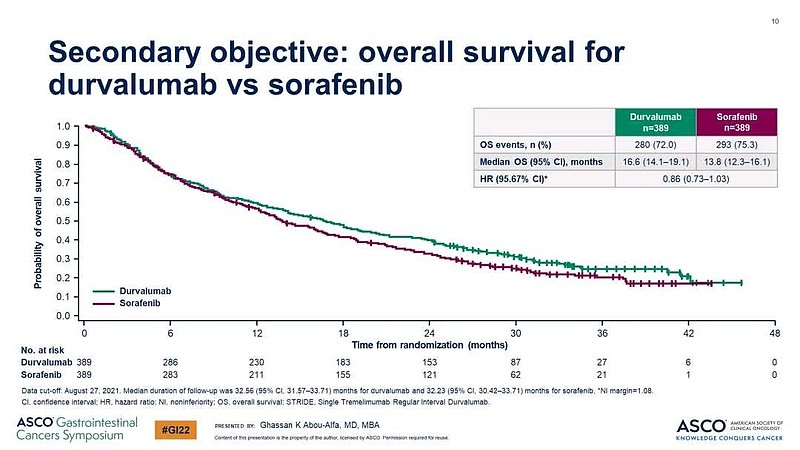
$阿斯利康(AZN)$ 的HIMALAYA研究,I药+CTLA4单抗 vs I药单药 vs 索拉非尼。中位生存期OS分别是 联合治疗组 16.43个月 vs I药单药组16.56个月 vs 索拉非尼组 13.77个月。
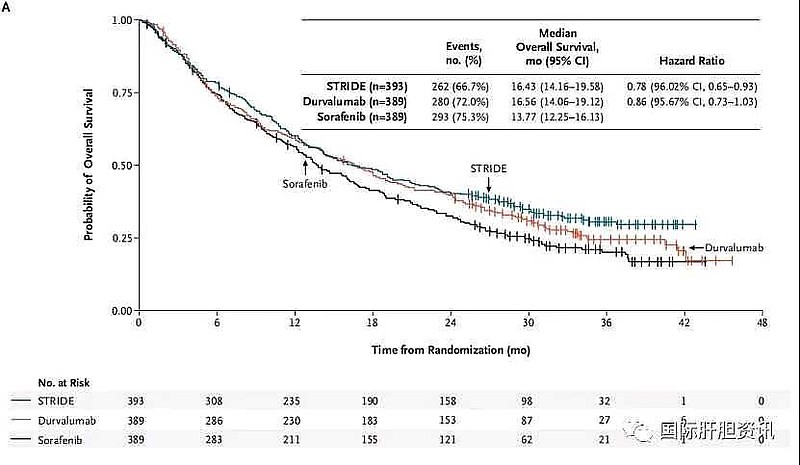
阿斯利康,仅仅向美国🇺🇸FDA提交注册,I药+CTLA4单抗联合一线治疗肝细胞癌适应症,获优先审评。
没有提交I药(PD-L1)单药注册申请。
诺华/百济神州是否向美国FDA提交替雷利珠单抗(PD-1)单药注册申请,不知道?
(四)阿斯利康没有向美国FDA提交申请注册I药单药一线治疗肝细胞癌的原因
I药虽然有延长OS的趋势,16.56个月 vs 13.77个月,但是#没有达到OS优效# 。
OS HR=0.86(95%CI,0.73,1.03)。
替雷利珠单抗有没有达到OS优效,不知道?
(五)阿斯利康I药单药副作用比索拉非尼更小,安全性更好。
3/4级AE,I药单药组发生率37.1%<索拉非尼组52.4%。
3/4级TRAE,I药单药组发生率12.9%<索拉非尼组36.9%。
TRAE导致的死亡,I药单药组发生率0%<索拉非尼组0.8%。
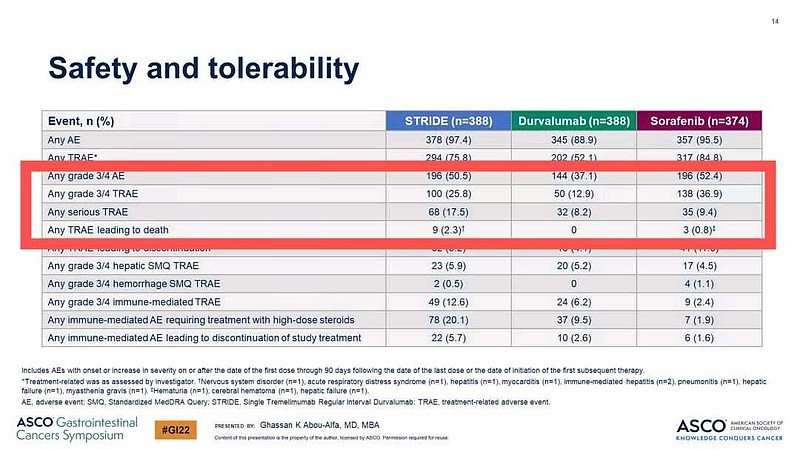
替雷利珠单抗安全性是不是比索拉非尼更好,不知道?
(六)阿斯利康入组患者基线状态符合美国医疗实践
HBV(乙肝患者)入组比例30+%,符合欧美肝细胞癌的临床表现。
实际上欧美曰入组患者比例>亚洲入组患者。
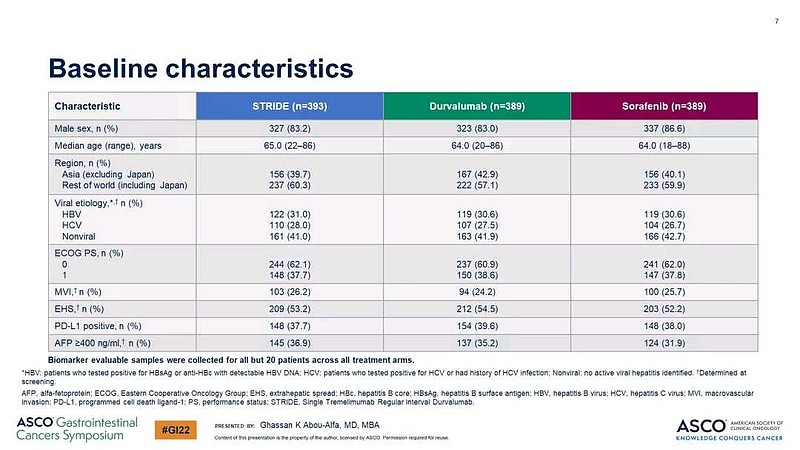
替雷利珠单抗乙肝患者入组比例、欧美患者入组比例,不知道?
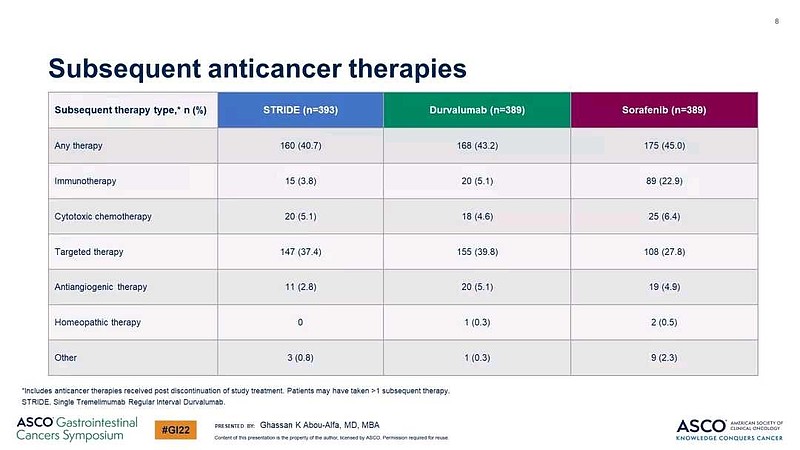
(七)后线交叉治疗情况
毕竟是对比总生存期OS,后续交叉治疗情况很重要。
整体看两组后续治疗比例相近,只是索拉非尼组后续接受更多的IO免疫治疗,而I药治疗两组更多的接受了TKI靶向药物治疗。
总结
美国🇺🇸FDA是否批准PD-1一线治疗肝细胞癌,最重要标准——是否符合美国医疗实践?是否优效?