恒瑞医药宣布,PD-1联合阿帕替尼一线治疗肝细胞癌国际多中心3期临床达到终点,至今没有公布临床试验数据,在美国🇺🇸FDA申请注册上市面临的难题如下。
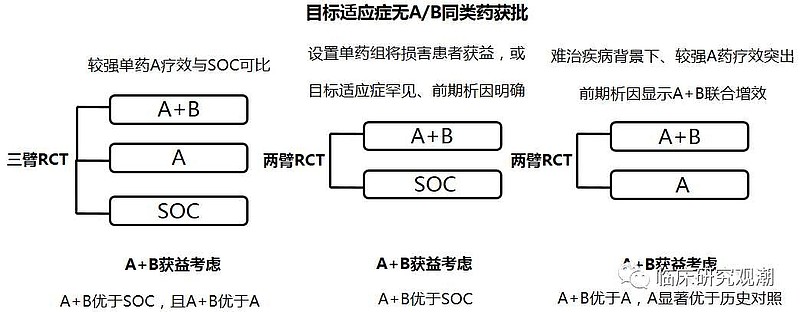
(一)FDA要求三臂试验
美国🇺🇸FDA于2013年发布了,如何在临床试验中设计联合用药的指导原则。

FDA首先说了,本指南旨在协助发起人共同开发两种或两种以上的新药,这些新药之前尚未开发出任何适应症,用于联合治疗疾病或病症。就本指南而言,这些以前未开发的药物被称为新的研究药物。该指南就如何解决两种或两种以上新试验药物共同开发过程中可能出现的某些科学和监管问题提供了建议和意见。
本标准不适用于开发先前批准药物的固定组合,也不适用于开发与先前批准药物联合使用的单一新试验药物。
这里需要注意,
$恒瑞医药(SH600276)$ 的卡瑞利珠单抗(PD-1)+阿帕替尼一线治疗肝细胞癌,卡瑞利珠单抗和阿帕替尼,都算是新的研究药物。需要按照这篇指导原则执行。
$君实生物-U(SH688180)$ 的特瑞普利单抗(PD-1)+仑伐替尼一线治疗肝细胞癌,特瑞普利单抗算是新的研究药物,仑伐替尼不算新的研究药物。所以,不需要按照这篇指导原则执行。

FDA也说了,对于恒瑞医药联合用药一线治疗肝细胞癌,可能需要设计 卡瑞利珠单抗+阿帕替尼 vs 卡瑞利珠单抗 vs 索拉非尼(SOC标准治疗),这种三臂试验。
(二)百时美施贵宝O药+Y药治疗肝细胞癌的临床试验设计
$百时美施贵宝(BMY)$ 怎样开展临床试验设计Y药的肝细胞癌适应症的呢?
首先适应症要尽可能选择一个已经被FDA批准的O药单药适应症(当时有条件批准上市,目前已经撤回),另外还要考虑是否能在这个适应症上充分体现联合用药的协同效应,是否能在较短的时间完成临床试验,未来是否有较大的适应症病人群体等问题。肝细胞癌基本符合上述的所有条件,FDA已经批准了O药有条件治疗索拉非尼失败的肝细胞癌病人,Y药只是被FDA批准了对恶性黑色素瘤单一适应症的治疗,因此只要证实在肝细胞癌适应症上,O药 + Y药好于O单药,且病人有良好的耐受性,就基本可以获得FDA的批准了。
百时美施贵宝为此开展的临床试验设计是,
①选择一线治疗肝癌,需要与SOC/索拉菲尼作头对头(设计试验时,罗氏T药 + 贝伐珠单抗还没有获得FDA批准用于一线的HCC治疗),但两组试验,一个口服,一个静脉,难以进行双盲,另外,Y药的疗效不确定,FDA可能会要求增加第三个接受单药治疗组(O药),最后可能需要三组病人(三臂试验),由于疗效不确定,病人的数目难以预估,数量可能会很大,周期可能会较长,可能需要3-5年或更长的时间,因此操作性差,若非万不得以,还是不要以一线治疗为目标。另外一个选择是先去证实O药+Y药二线治疗肝细胞癌的效果后,回头以2期试验的用药方案来开展肝细胞癌一线的3期临床试验,这样可能就不需要增加第三个单药治疗组。
所以,就采用先二线,后一线的开发策略,目前百时美施贵宝这个正在开展O药 + Y药与索拉非尼的随机对照3期试验就是在确认肝细胞癌二线的治疗效果后,采用了肝细胞癌二线HCC确认的给药计划,并重新修订优化了3期试验的早期设计,病人数量也从1084人减少到650人。
②选择二线治疗肝癌要合理得多,虽然O药已经获批有条件的二线治疗肝细胞癌,其有效性已经确立,但是尚没有获FDA完全批准真正成为二线的SOC治疗,也就是说,选择同样的病人入组,只要证明O药 和Y药 联合应用,有效性明显好于单药治疗的结果就可以了,FDA也可能会要求两组病人来进行试验,O药+ Y药对照O药两个病例组的数据就会支持药物申请有条件上市。
所以,对照着来看恒瑞医药在美国的3期临床试验……卡瑞利珠单抗、阿帕替尼都没有在美国上市 ,也没有在美国获批肝细胞癌适应症。
(三)阿斯利康I药+CTLA-4单抗一线治疗肝细胞癌的HIMALAYA研究
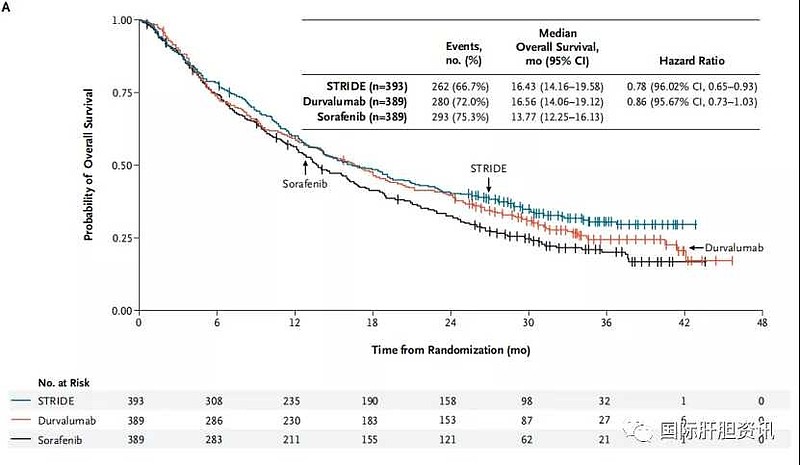
共有1171例患者被随机分配到I药+CTLA-4单抗联合治疗组 (n=393)、I药单药组 (n=389)或、索拉非尼单药组(n=389)。
联合治疗组的中位OS=16.43个月 vs 索拉非尼组的中位OS=13.77个月(95%CI,0.65-0.93)。
I药单药治疗对比索拉非尼组达到了非劣效性的预设指标。度伐利尤单抗单药组的中位总生存期为16.56个月(95%CI,0.73-1.03)。
阿斯利康都可以设计三臂试验,为什么恒瑞医药不可以设计三臂试验?
安全性方面,分别有196例(50.5%)、144例(37.1%)和196例(52.4%)接受I药联合治疗、I药单药单药、索拉非尼单药治疗的患者发生3级或4级不良反应。
也就是说,I药单药比索拉非尼安全性更好。
恒瑞医药怎么证明卡瑞利珠单抗比索拉非尼安全性更好?
(四)美国🇺🇸肝细胞癌一线治疗的标准治疗方案
另外,索拉非尼究竟还算不算SOC标准治疗,值得商榷。
根据最新的美国🇺🇸NCCN指南,虽然罗氏T药+贝伐珠单抗、仑伐替尼、索拉非尼都是一线治疗方案。
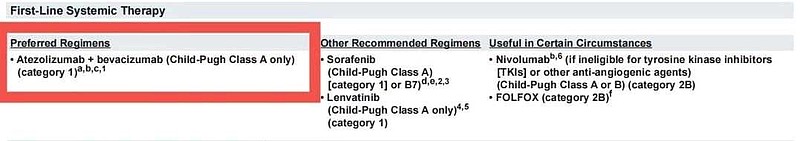
但是,只有罗氏T药+贝伐珠单抗是‘‘优选方案’’。仑伐替尼、索拉非尼纷纷从“一线优选方案”退居“一线其他推荐治疗方案”。
选择对照组索拉非尼的,都是开放标签。
选择对照组仑伐替尼的,都是双盲对照。
索拉非尼治疗乙肝后肝细胞癌,疗效可能比仑伐替尼更差。
(五)恒瑞医药仅仅打算申请‘‘卡瑞利珠单抗+阿帕替尼组合’’在美国上市,还是打算申请‘‘卡瑞利珠单抗+其他药物组合’’在美国上市?
美国🇺🇸FDA于2013年发布了,如何在临床试验中设计联合用药的指导原则。还说了什么呢?

FDA认为,假设每种药物单独上市,应该有独立的IND。