
博腾微信公众号将不定期连载CMC(化学/生产/控制)相关文章,欢迎关注。本期文章约2600字。
设计空间
制剂研发QbD的终极目标(下)
在提交的注册文件中清楚地写出建立设计空间的理论依据和实验结果,从而便于审评人员快速了解产品质量关键控制点、方便后期注册评审工作。这些理论依据可以来自实验设计(DoE),用这些实验来确定和测试“预计设计空间”的外部界限,了解它们对产品的关键质量属性(CQAs)的影响,找出任何“新的控制空间”可能产生的关键工艺参数(CPPs)。这样,在技术转移的时候,才能够得到有关控制空间的数据并建立设计空间,从而保证大生产的顺利进行。
一般而言,选择是否为单元操作开发设计空间的关键标准可能包括:需要进一步的工艺理解和交互作用确认;技术风险评估单元操作为较高风险;单元操作复杂,具有多个潜在的CPPs / CQAs,即本质上是多变量的;寻求增加操作灵活性。为此,我们看下设计空间是如何建立的。
六、如何开发设计空间
设计空间开发流程如下图:

步骤1和步骤2:
已在前期文章中介绍,本文不再概述(文末链接,跳转阅读)
步骤3
设计空间建立方法-第一性原理、经验模型与人工神经网络模型(ANN)
■ 第一性原理是指不需要任何实验参数,只需要一些基本的物理常量,就可以得到体系基态的基本性质的原理,其是基于化学、物理学和工程学的实验数据和机理知识,从而对工艺性能进行预测(如反应动力学、能量守恒);虽然模型的形式是由工艺的机械知识预先决定,但仍需要实验(和实验设计)来估计未知的模型系数;
■ 经验模型是采用设计实验结合DoE研究来获取用于推导模型形式和相关未知模型系数的数据;常用的DOE研究包括部分析因、完全析因、响应面分析法(RSM)等,有关DoE研究的系列文章敬请期待;
■ ANN[1]是从信息处理角度对人脑神经元网络进行抽象,建立某种简单模型,按不同的连接方式组成不同的网络;它不需要知道输入输出之间的确切关系,不需大量参数,只需要知道引起输出变化的非恒定因素,即非常量性参数,是处理非线性系统的有力工具;
■ 一般优选第一性原理,因其具有科学依据并被广泛接受,具有产生高预测性能潜力,并具有规模和设备独立性潜力;
■ 实际上,药品开发第一性原理的设计空间模型的机会较少,使用经验模型更为普遍;一般需要在商业化批量条件下对关键工艺步骤的工艺参数进行DoE研究,才能建立商业化批量条件下的设计空间;从这个角度讲,为了避免在商业化批量条件下生产过多批次、使用过多物料,一般在工艺设计阶段优先选择与批量相关性低的生产工艺,如直接压片、干法制粒、HME等,其优势在于在小中试阶段建立的DoE模型和设计空间可转移至商业化生产阶段,在商业化生产阶段仅通过1-2个批次即可完成工艺优化和DoE模型;
步骤4
根据步骤3中获取的数据构建物料属性和工艺参数之间多元关系的定量模型;使用多元分析软件分析数据,消除异常值,确定具有统计意义的因素,量化每个因素的影响大小并生成模型(方程式);可根据影响大小确定关键材料属性(CMAs)和CPPs;
步骤5
设计空间的边界定义为输入属性和工艺参数所有组合集的边界,这些边界可充分确保可接受的产品质量;
由于存在多个不确定性,模型确定的边界存在一定的风险,这些不确定性来自:材料属性和工艺参数值受测量误差和批间差异影响;模型构建关系基于有限的数据,存在不确定性;即使工艺在相同条件下运行,CQAs值也存在一定不确定性(如测量误差和批间差异);在确定风险水平时,这些不确定性或多或少组合在一起,可能导致无法达到可接受的质量,因此需提出可容忍的风险级别;
经验模型中的边界确定方法:
■ 重叠方法:根据多个CQAs可操作范围的共同区域确定;下图为ICH Q8 (R2)指南提供的一个关于片剂生产的两个CQAs的设计空间的示例(设计空间由两个CQAs的响应面重叠区域构成),其涉及“溶出”和“脆碎度”与两个参数的函数关系;由于存在不确定性,图中绿点批次符合其各自规范限值的可能性约为50%,而红点批次的可能性可能约为50%×50%(即25%);而实际上,资料显示其构建的设计空间中的参数其所有CQAs满足它们各自的规范要求预估概率低至11%,且其风险随CQAs数量增加呈指数增长[2];
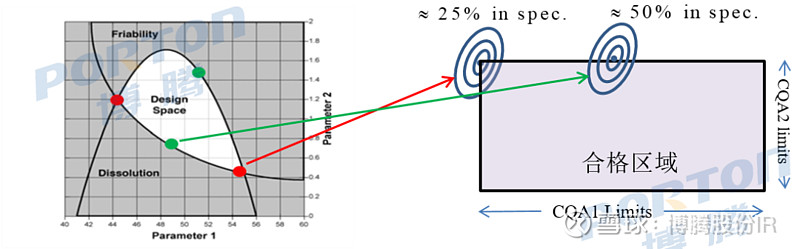
■ 为保证设计空间可靠性,可开发一种为设计空间工艺参数的每种组合生成预测分布的模型,然后用其来校准设计空间可靠性的下限,这种可靠性可通过直接概率计算或蒙特卡罗模拟[3]来计算(蒙特卡罗模拟:当所要求解的问题是某种事件出现的概率,或者是某个随机变量的期望值时,它们可以通过某种“试验”的方法,得到这种事件出现的频率,或者这个随机变数的平均值,并用它们作为问题的解);
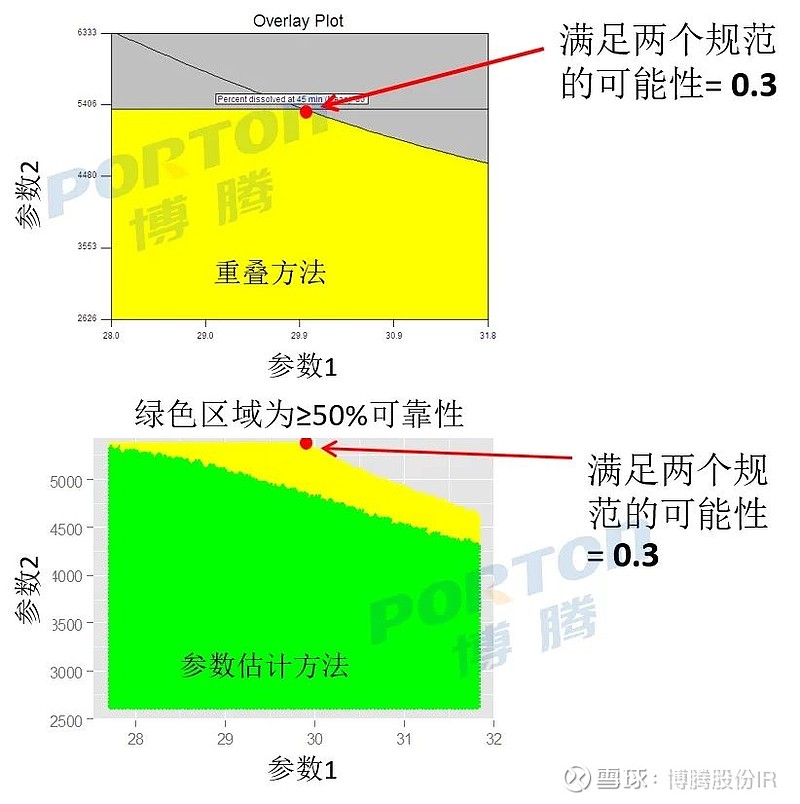
■ 此外,贝叶斯统计方法[4~6]可用于评估设计空间中每个点满足规范的可靠性,并用于校准设计空间,使其在满足CQAs限制的可靠性上具有指定的下限,从而保证设计空间的可靠性;相较于贝叶斯定理,还有一种参数估计方法,其忽略了模型参数的不确定性;
■ 通过简单地估计未知模型参数,然后用它们估计的点来校准设计空间边界的可靠性,可以容易地计算出具有50%边界可靠性的设计空间。如下图,与ICH Q8 (R2)指南中建议的重叠法建立的设计空间不同,这种(参数估计法)设计空间将具有50%或更好的可靠性。
步骤6:
生命周期内设计空间更新
■ 在生命周期中,应通过正式审查对与设计空间相关的假设的符合性进行年度确认;
■ 设计空间内的变化不需要报告,但可能需要一些其他验证,以确保变更后的工艺操作范围的可靠性,设计空间缩小需包含在年度报告中,而设计空间扩大需监管部门批准;
■ 在生命周期某一阶段建立的设计空间,仅代表当前对生产工艺的最佳理解,随着理解的不断深入,设计空间可能会发生变化,这并非说明最初的开发工作失误,而是产生了更多的知识和信息:持续改进。
总结
设计空间的提出是为了遏制不断上升的研发成本,缩短研发周期,扫除创新途中那些给监管方面增加的困难和工作量。设计空间的研究是通过识别变异来源,通过生产过程设计管理变异性以及使用设计空间预测产品质量属性,促进对生产过程的理解。在QbD理念中,产品设计空间为药物临床效果提供数据可靠性,而工艺设计空间保证了产品设计空间的可靠性。成功地建立设计空间可以解决只通过最终产品检验来保证产品质量的问题,因为工艺的开发是建立在对产品CQAs与CPPs之间关系的透彻理解的基础之上的,从而减少不合格批次的产生,最终提高产品质量稳定性,减少由于不合格带来的损失。
参考文献
1. 张安定. 遥感原理与应用题解:科学出版社,2016.
2. Peterson, J. J. and Lief, K. (2010) "The ICH Q8 Definition of Design Space: A Comparison of the Overlapping Means and the Bayesian Predictive Approaches", Statistics in Biopharmaceutical Research, 2, 249-259.
3. 杨衡. 蒙特卡罗模拟优化与风险决策分析的应用研究[D]. 天津大学.
4. Peterson, J. J. (2008) "A Bayesian Approach to the ICH Q8 Definition of Design Space", Journal of Biopharmaceutical Statistics, 18, pp959-975.
5. Peterson, J. J. and Yahyah, M., (2009) "A Bayesian Design Space Approach to Robustness and System Suitability for Pharmaceutical Assays and Other Processes", Statistics in Biopharmaceutical Research 1(4), 441-449.
6. Peterson, J. J. and Lief, K. (2010) "The ICH Q8 Definition of Design Space: A Comparison of the Overlapping Means and the Bayesian Predictive Approaches", Statistics in Biopharmaceutical Research, 2, 249-259.

下期预告
如何采用Minitab进行T-检验?(上篇)