
编译丨苗三岁
编辑丨于靖
毫无疑问,Aducanumab的问世,行业对其褒贬不一。
自2021年FDA批准Aducanumab以来,发生了许多“联动反应”,包括两名Aducanumab咨询委员会成员辞职,进而导致两项联邦调查启动。医疗保险和医疗补助服务中心(CMS)决定,医疗保险将只覆盖FDA或美国国立卫生研究院(NIH)批准的Aducanumab临床试验。
然而,从FDA的临床药理学和医学角度来看,审查审评小组在对包括Aducanumab项目数据和其他临床项目数据在内的所有证据进行广泛审查后,支持批准决定。虽然FDA统计团队不支持批准,外部专家也不支持批准,最终FDA依然采纳了临床药理学和医学团队的意见而批准了Aducanumab。在这种复杂的情况下,需要新的分析解析FDA内部到底发生了什么。
阿尔茨海默病(AD)等具有挑战性的疾病领域,需要在新药开发方面取得渐进式进展,为保持势头,直至最终找到治愈方法,还迫切需要对AD有现实期望、对疾病和临床试验设计有深入了解的科学家发表他们的发现和观点,以平衡那些基于对AD药物开发不完全了解而发表的非科学或看似科学的文章。
因此,亟需新颖的分析最大限度地理解Aducanumab支持完全批准建议是必要的。5月18日,曾参与Aducanumab审评工作的FDA前临床药理学办公室定量药理部主任部长王亚宁,在受Alzheimer’s AssacationAssociation期刊Alzheimer's & Dementia: Translational Research & Clinical Interventions主编邀请中发表一篇名为An insider's perspective on FDA approval of aducanumab的文章中,文章希望激发科学界的更多兴趣,能阅读完整的临床药理学,医学和统计学评论和其他关键评论审评报告,以深入了解用于数据分析的不同方法和FDA内不同学科得出的结论。

(表1 FDA批准Aducanumab的监管过程和关键里程碑)
01 FDA临床药理支持完全批准的4点证据
Aducanumab批准可以说是新药开发和监管的特殊案例——Aducanumab的临床试验结果并不理想。FDA批准药物通常要求有两个有支撑性证据的有效研究,而Aducanumab药物的两个III期试验仅有一个(302)显示出积极阳性的结果。而且还是在2019年3月,两项III期临床研究(301和302)试验因为期中分析认为药物无效情况下被按下暂停键被终止的。
然而,这是由于分析相同数据用不同方法,因此得出相反结论的结果。从定量临床药理学(药物计量学)的角度来看,可以从四点来支持Aducanumab的疗效:
Aducanumab的暴露-疗效和剂量-反应关系明确。
在多个临床研究中一致的药效学效果(淀粉样蛋白β [aβ]斑块减少),以及aβ斑块减少与临床终点临床痴呆评定量表评分盒数(CDR-SB)之间的明确关系。
与其他靶向Aβ途径的候选药物报道的Aβ斑块减少与临床终点CDR-SB之间存在相似的关系(组水平)。
临床试验模拟显示,302研究中高剂量组出现假阳性结果的概率非常低,这强烈表明301研究的阴性结果可能是由高剂量组中的一个亚组驱动的偶然发现。
两项研究中收集了几乎所有的患者的个体纵向药物浓度(暴露)在不同时间的数据,通过纳入试验期间的剂量滴定方案和高剂量增加,可以进行综合疗效分析,充分纵向观察暴露-反应随时间变化的数据。基于该模型的另一个优点是,在纳入参数模型以量化疗效终点随时间的疾病进展后,检测药物暴露与疗效终点之间正相关关系的能力增强,且没有假设单一参数数学模型,而是用能观测数据选择最优模型(线性模型)。
与主要传统统计分析方法相比,若以临床终点随时间恶化的速度(CDR-SB)来评估药物效果,参数化纵向基于模型的定量药理学建模方法受后期访问缺失数据的影响较小。(图1)
因此,即使是失败的研究301也显示出总体上正的暴露-反应关系(图1A)。研究301的暴露-反应斜率幅度小于研究302,而且前者研究中Pre-PV4亚组没有显示出预期的暴露-反应关系,但研究301中的pv4后亚组显示出预期的正暴露-反应关系。值得注意的是,只有一个亚组部分患者提供了成对的SUVR和CDR-SB数据(每组大约N=100),因此图2中的CDR-SB值与总体随机分组的数据不相同。
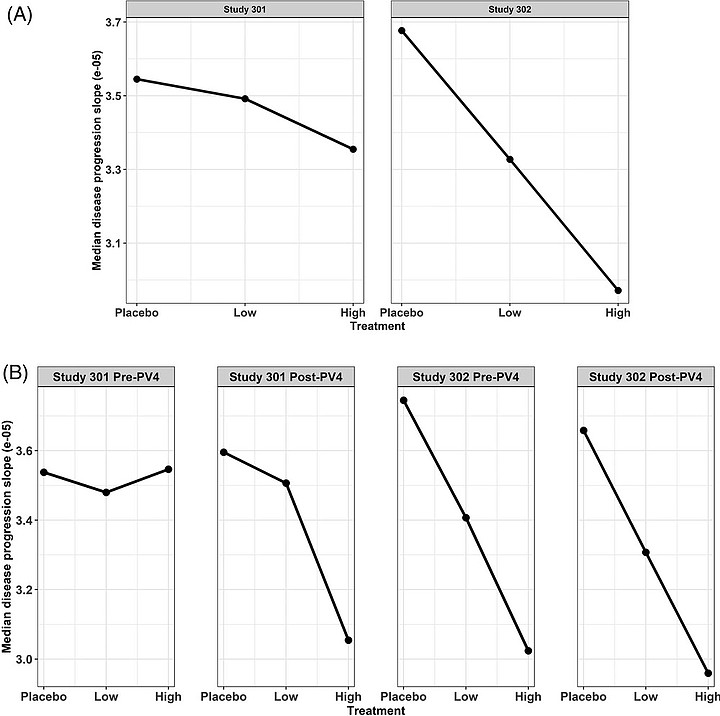
(图1 Aducanumab浓度-CDR-SB反应关系)

(图2 安慰剂组矫正后平均SUVR和CDR-SB与安慰剂之间的差异与安慰剂之间的关系,仅用限于Aducanumab)
这也是咨询专家委员会会议上企业提出的第二个认同Aducanumab疗效的支持数据支持,但对于任何委员会成员来说,这显然还不够有说服力。事实上,科学界完全有理由质疑,为什么历史上所有针对Aβ的候选药物都是阴性的,而只有Aducanumab可以成功(如果我们相信研究302的阳性结果代表了事实)。
为解决这些问题,王亚宁FDA临床药理团队还收集了所有其他靶向Aβ的抗体,以了解历史失败的原因以及最近开发的抗体(Aducanumab、Lecanemab/BAN2401、Donanemab)与过去报告阴性结果的抗体之间的差异。
数据显示,SUVR降低的p值令人印象深刻,与Aducanumab、Lecanemab和Donanemab相比,所有过去阴性试验的SUVR降低幅度还相当小。但要想实现临床终点改变,还需要足够大的SUVR降低幅度。
一位专家委员会成员建议FDA采取相反的做法:假设Aducanumab不起作用,并来评估在研究302中观察到阳性结果的机会。结果显示,如果假定Aducanumab无效,那么在研究302中观察到总体阳性结果的机会极低,这个结果数据也大大增加了FDA临床药理对支持完全批准建议的证据的信心。


(图3 多种化合物的安慰剂组矫正后平均SUVR和CDR-SB与安慰剂之间的差异关系)
在临床药理团队分析数据过程中,无意间发现了FDA统计团队在咨询专家会议上报告中的两个错误,委员会成员还提出了以下两个问题:
安慰剂的恶化解释了302研究中明显的高剂量效应
高剂量组第78周CDR-SB变化与第78周SUVR变化无相关性
然而,在FDA临床药理学评论审评报告中提到,对这两个结论为什么是由人工差错和不适当的分析得出的进行了详细的解释。最终,在FDA新药办公室主任Peter Stein的官方备忘录中,来自FDA临床药理学办公室的分析方法被认为更合适,并成为支持FDA的最终决定的原因。
02 什么被认为有临床意义?
即使有足够的证据表明Aducanumab在降低Aβ和改善临床终点方面有效,那么对CDR-SB的效应大小又是否具有临床意义?
这就涉及到一个常见的问题,当考虑CDR-SB终点(0-18)的范围时,相对于安慰剂的0.39单位数值变化可能还是太小了。但在不考虑两项III期研究的具体研究设计过程和纳入患者群体的情况下,这种笼统的说法又似乎是合理的。
以至于一部分人得出“即使不是统计学家,也能理解Aducanumab的最高(和最不安全)剂量在满分18分制的表中仅减缓了0.39(<2.2%)的认知能力下降是永远不会被认为有临床意义的,不管是多少的样本量和多强的统计学意义”的结论。但值得注意的是,几乎不考虑样本大小和统计显著性的观察,是绝不可能被认为是重要的影响因素。
另一观点认为,在研究中,患者至少应该有1-2个单位的CDR-SB改变才具有临床意义。这部分观点也是即使FDA已经批准了Aducanumab情况下,CMS决定拒绝将Aducanumab覆盖普通人群的主要原因之一。
而FDA和渤健也有一套评定标准,在301和302的研究设计阶段,两者就预期效应量达成了共识,并签订了特殊方案评估(SPA)协议。根据SPA协议内容,在第78周,渤健计划有大约有90%样本量成功率来检测基线CDR-SB相对于基线变化在用药组和安慰剂组之间的差异,其中变化并假设真实平均差异0.5(假设安慰剂在第78周时CDR-SB的平均变化为2,那么0.5的平均差异代表约25%的减少)。
但在实际的试验中,在第78周时,安慰剂组的CDR-SB平均变化量化的疾病进展甚至比假设的2个单位还要慢:在研究301中为1.56,在研究302中为1.74,平均为1.65。这一结果也导致任何潜在有效治疗的效果边际只有1.65个单位,而不是完整的18个单位范围,因此,与安慰剂组相比,即使0.39单位的变化也代表疾病进展减慢24%,几乎与设计阶段假设的效应大小相同。研究人员还如果将1-2个单位的变化与安慰剂的1.65个单位的疾病进展相比,这表示疾病进展减缓了61%-121%。
百分之百的疾病进展延缓,意味着疾病进程的完全停止。该结果,也可以为治愈这意味着轻度认知障碍(MCI)和轻度AD恢复到几乎正常的状态,达到预期治疗效果,提供更多选择方案。
如此高效的治疗方法,当然是对未来治疗范式的一个美好愿景。然而,考虑到在过去二十年中阿尔茨海默病药物开发面临的挑战,现阶段就想直接能治愈MCI和AD是完全不现实的。但如果治疗手段不是以治愈疾病为目的,那么患者疾病进展减慢24%的数值又是否有临床意义?
FDA和渤健似乎在该问题上意见保持一致,都同意这个幅度的变化在临床上是有意义的。不只这两方,尽管有许多观点或发表文章反对Aducanumab的临床意义,仍有一些专家坚持得出积极结论——Aducanumab在降低淀粉样蛋白方面具有临床意义。
如果安慰剂组观察到的线性疾病进展和Aducanumab治疗下的相对变化幅度可以外推到更长的时间,24%的疾病进展延缓将转化为更大的绝对单位(1-2个单位)。
距离2021年6月6日FDA批准Aducanumab已经将近2年,当初的不确定性现在已经有了答案。2023年1月6日FDA基于一个毫无争议的大型三期临床试验结果批准的Lecanemab和2023年5月3日礼来公布的Donanemab三期阳性结果两次证明了当初FDA将Aducanumab,Lecanemab,和Donanemab作为新一代靶向Aβ途径的药物支持Aducanumab批准的决策是正确的。历史再次提供了一个真理往往是掌握在少数人手里的案例。
参考资料:
1.Wang Yaning. An insider's perspective on FDA approval of aducanumab. Alzheimers Dement (N Y). 2023 May 18;9(2):e12382. doi: 10.1002/trc2.12382. PMCID: PMC10193636.An insider's perspective on FDA approval of Aducanumab
2.FDA Grants Accelerated Approval for Alzheimer’s Disease Treatment
3.Lilly's Donanemab Significantly Slowed Cognitive and Functional Decline in Phase 3 Study of Early Alzheimer's Disease
investor.lilly.com/news-releases/news-release-details/lillys-donanemab-significantly-slowed-cognitive-and-functional