人类和疾病的抗争由来已久,很长一段时间内都是以人类的惨败收场。随着疫苗的普及,那些关于天花、小儿麻痹症、白喉、麻疹等的痛苦记忆离我们越来越远。疫苗的出现无疑是医学史上浓墨重彩的一笔。
但疫苗不是万能的。许多病原体可以躲避宿主机体的免疫监视,例如导致疟疾的恶性疟原虫、人类免疫缺陷病毒(HIV)和丙肝病毒等。传统疫苗在对抗此类病原体时面临非常大的挑战。
作为领跑此次新冠疫苗研发的技术之一,与传统疫苗相比,mRNA疫苗有其过人之处。首先,mRNA不进入细胞核,不会插入到基因组中,避免了插入突变;再者,mRNA疫苗实际上是利用机体细胞产生抗原蛋白,跳过了细胞培养、抗原提取与纯化等过程,大大降低了成本,提高了产能。具体来说,一个生物反应器单次反应中就可以产生近100万剂的mRNA疫苗;此外,单个mRNA疫苗可编码多种抗原,在流感、新冠这类易突变的病毒中应用前景广阔。
1961年科学家第一次发现了mRNA并知晓其作用,出于对其稳定性和免疫刺激性的担忧,起初并未将mRNA作为一种潜在的治疗手段。随着递送和免疫原性难题得到解决,mRNA技术在预防和治疗疾病领域都有了长足的进步,直至在此次COVID-19大流行中大放异彩。

来源:Nature Reviews Drug Discovery
mRNA疫苗是如何设计和生产的?递送技术有哪些?mRNA疫苗想要后来居上面临哪些关键问题?8月25日发表在Nature Reviews Drug Discovery上的一篇深度报告对这些问题一一作出了解答。
一、mRNA疫苗的设计
信使核糖核酸(mRNA)是连接DNA与蛋白质的桥梁,是携带遗传信息的临时副本。与内源性mRNA一致,体外转录mRNA也包含5个部分:5’端帽子(cap)结构、5′非翻译区(UTR)、编码蛋白质的开放阅读框(ORF)、3′ UTR和Poly (A)尾(tail)。mRNA体外转录(IVT)以DNA为模板(如线性质粒),在RNA聚合酶的作用下转录合成,再加上5’端帽和Poly(A)尾得到mRNA[2]。
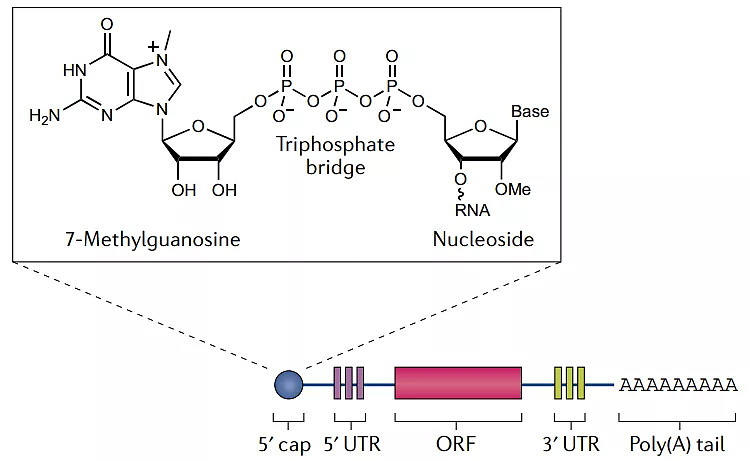
体外转录mRNA由5部分组成(来源:Nature Reviews Drug Discovery)
下面对5个结构部分的功能分别作简要介绍。
帽子结构是真核生物在转录后修饰过程产生的位于5’端的特殊结构。5’端帽包含一个通过三磷酸桥连接到mRNA 5’端的7-甲基鸟苷。帽子结构包裹住mRNA的5’端,使其免于核酸外切酶的降解;还可促使mRAN环化,并募集核糖体启动翻译进程。
非翻译区(UTR)包括5’UTR和3’UTR两个部分,可调节mRNA的翻译和半衰期等。5’UTR在帽子结构和编码区ORF之间,其长度和二级结构都会对翻译起始阶段的效率产生影响。3’UTR位于编码区ORF下游,在终止密码子之前。真核生物mRNA 的 3’UTR 是其重要功能元件,在翻译调控和mRNA 定位等方面起着不可忽视的作用[3]。
编码区ORF由起始密码子开始,到终止密码子结束。每三个碱基构成一个密码子,编码一个氨基酸。编码区若存在过多的二级结构和稀有密码子则会降低翻译效率。因此,“mRNA三巨头”之一的CureVac将ORF中第三个位置的A或U替换为更常见的G或C,并将这一优化策略用于其COVID-19候选疫苗CVnCoV中。但有些时候,翻译较慢的稀有密码子对保证蛋白质准确折叠很有必要,因此使用这种替换方法还须谨慎。
3’UTR尾部是一段Poly A序列。与帽子结构类似,Poly(A)尾也能起到保护mRNA防止被核酸外切酶降解的作用。尾部结构也参与到翻译及其调控过程中,可与多聚腺苷酸结合蛋白(PABP)结合形成环状复合物,参与翻译的起始过程。
Katalin Karikó等科学家发现,在mRNA中掺入修饰核苷(假尿苷、N6-甲基腺苷、5-甲基胞苷)后可大大提高mRNA的翻译量。除此之外,修饰核苷对在抑制RNA降解、提高翻译效率和调节半衰期等方面也发挥着重要作用[4]。未修饰的mRNA(如病毒RNA)会被模式识别受体识别,从而产生免疫刺激。
辉瑞/BioNTech的mRNA疫苗BNT162b2和Moderna的mRNA-1273都利用了核苷修饰技术,用假尿苷替换尿苷。而CureVac的mRNA疫苗CVnCoV使用未经修饰的天然mRNA,通过其RNActive 平台改变mRNA序列并优化密码子,以提高mRNA的稳定性和免疫原性[5]。
二、mRNA疫苗的生产工艺
随着mRNA疫苗的上市,生产工艺也逐步走向成熟,主要可简化为以下6步:
首先第一步是获取病原体的基因组测序,再将编码抗原的序列插入到质粒DNA(pDNA)中,并利用大肠杆菌制备得到高纯线性pDNA;
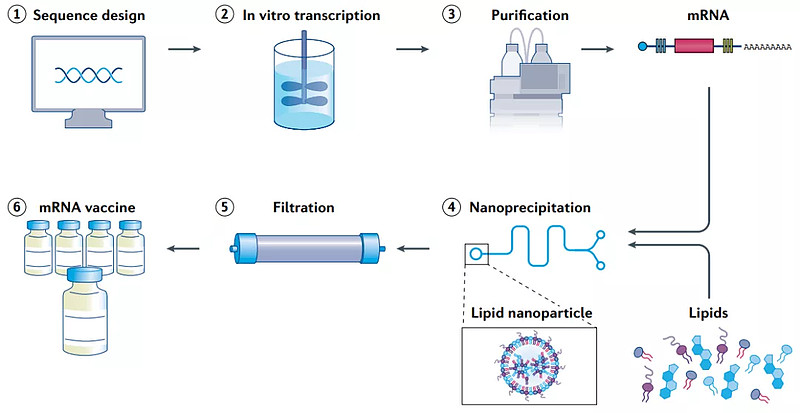
mRNA疫苗的生产工艺(来源:Nature Reviews Drug Discovery)
接下来第二步使pDNA在体外被噬菌体聚合酶转录成mRNA;
第三步,将mRNA转录物经高效液相色谱(HPLC)纯化以去除污染物、酶、游离核苷酸等杂质,以满足GMP生产的质量需求;
第四步是将制剂与载体结合。经过纯化的mRNA在微流控混合器中与脂质混合形成脂质纳米粒,以便于体内递送;
第五步,利用透析或过滤的方法除去非水溶剂和未经载体封装的mRNA;
最后将过滤得到的mRNA疫苗封装在无菌小瓶中,疫苗的生产之旅就结束了。
三、mRNA疫苗的递送系统
与DNA相比,RNA结构天然不稳定,易被多种酶降解。此外,mRNA是一个带负电的长链大分子,细胞膜也带有负电,静电排斥作用使mRNA难以进入细胞内。因此,与其他核酸药物类似,必须解决递送难题,才能实现mRNA的广泛应用。
电穿孔、基因枪等技术可实现mRNA在培养皿中的细胞间递送。要实现体内递送,必须使用安全无毒、低免疫原性的载体。近年来已发展出多种mRNA体内递送技术,比较有代表性的有脂质纳米粒(Lipid nanoparticle,LNP)、聚合物纳米粒子(Polymeric nanoparticle)和阳离子纳米乳(Cationic nanoemulsion)等。
目前LNP是临床进展最快的mRNA递送载体。现阶段获批上市和在研的mRNA疫苗绝大部分采用LNP技术进行递送。除mRNA外LNP主要包括4部分:可电离的脂质分子(ionizable lipids)、聚乙二醇修饰的磷脂(PEGylated lipid)、中性辅助磷脂和胆固醇。这4个部分组成了“脆弱”的mRNA的保护伞。
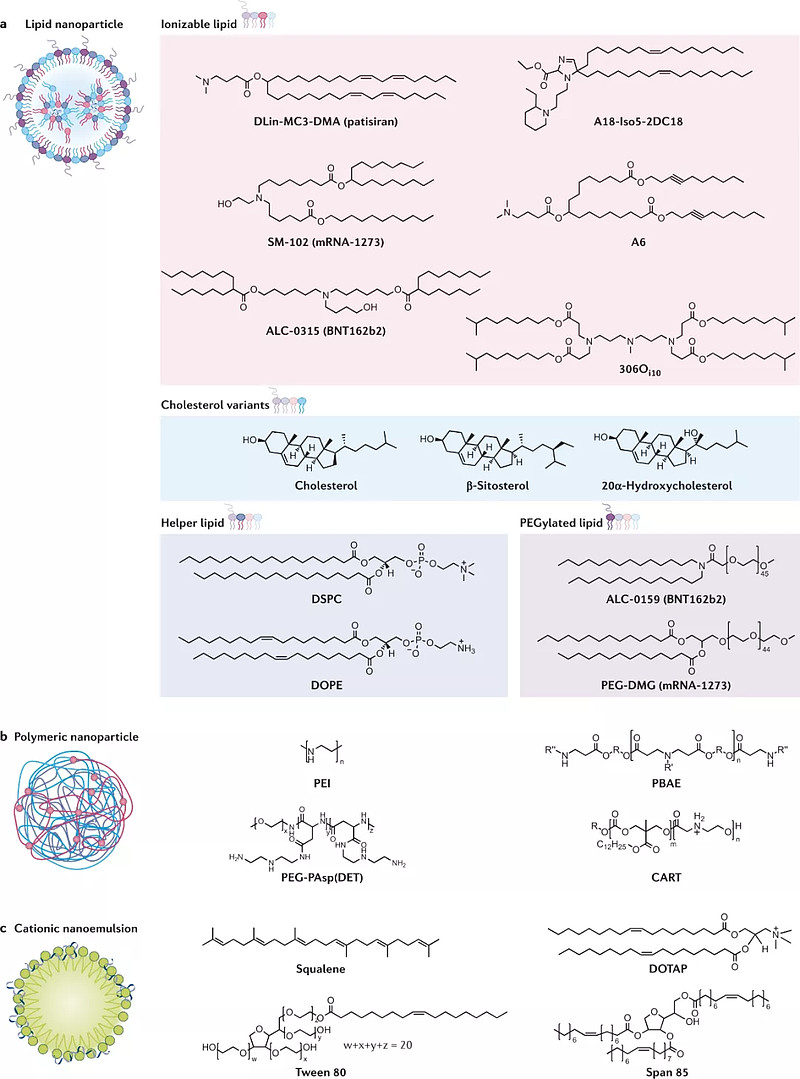
mRNA递送载体通常都含有阳离子或可离子化的分子(来源:Nature Reviews Drug Discovery)
聚合物纳米粒子也能实现mRNA的体内递送。阳离子聚合物与RNA结合成形状大小各不相同的复合物,通过内吞作用传递到细胞内。除此之外,阳离子纳米乳、鱼精蛋白、肽类、树突细胞等也被开发用于mRNA的体内递送。
四、在传染性疾病中的进展
mRNA在传染性疾病领域进展最快,目前临床上mRNA疫苗的接种方式多采用肌肉注射和皮下注射。进入体内的抗原经抗原递呈细胞摄取、处理和呈递,诱发T细胞和B细胞产生免疫应答。
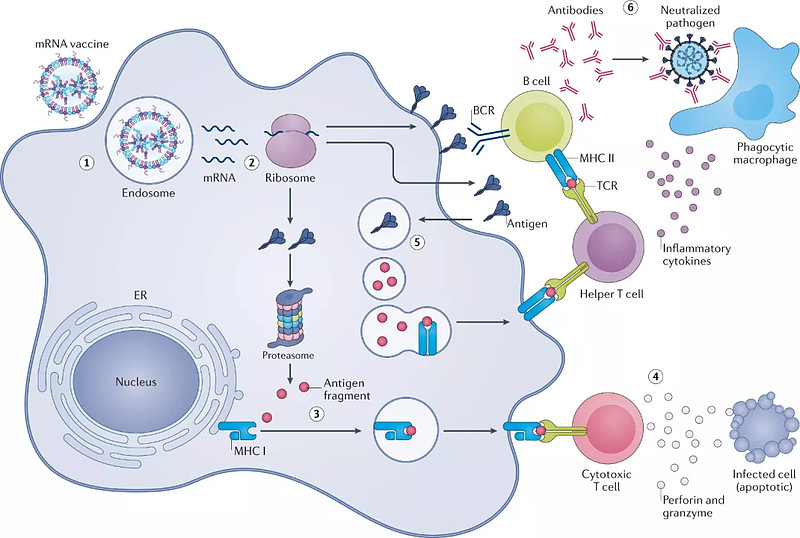
mRNA疫苗通过转染抗原递呈细胞产生免疫应答(来源:Nature Reviews Drug Discovery)
据统计,在2019年底COVID-19大流行之前,已有15款针对传染性疾病的mRNA疫苗进入临床,但无一处于Ⅲ期临床阶段。布局公司中不乏日后mRNA领域明星公司Moderna、CureVac和制药巨头默克、赛诺菲、GSK等的身影。按照既往速度,距离mRNA疫苗被监管部门批准至少需要5-6年。一场突如其来的COVID-19大流行彻底改变了mRNA疫苗的发展轨迹。
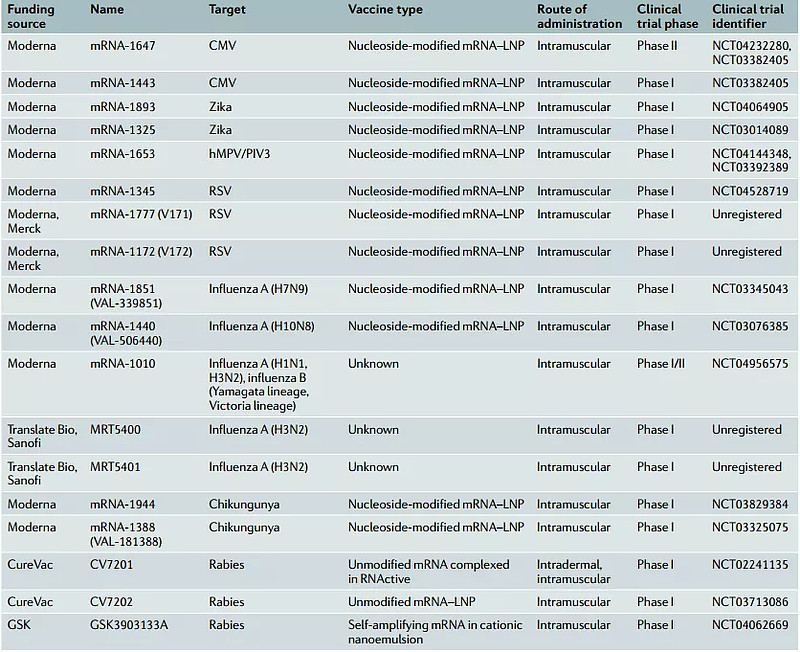
2019年底传染性疾病领域在研mRNA疫苗(来源:Nature Reviews Drug Discovery)
自2020年1月中国科学家公布新冠病毒基因序列,到12月FDA批准BioNTech的BNT162b2的紧急使用权,仅仅间隔不到1年的时间。目前,mRNA疫苗也正在被研发用于对抗多种其他传染性疾病,例如HIV、寨卡病毒、狂犬病毒、流感、埃博拉、疟原虫和呼吸道合包病毒(RSV)等。
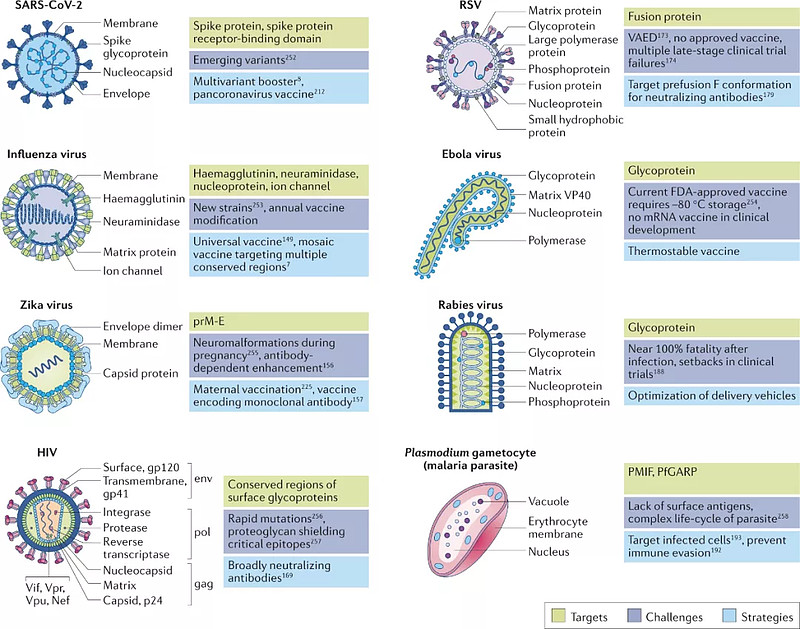
mRNA疫苗在传染性疾病中的应用(来源:Nature Reviews Drug Discovery)
五、mRNA疫苗能否后来居上?
mRNA疫苗与传统疫苗相比,有许多固有优势。但科学家认为,mRNA疫苗作为新兴技术想要后来居上,仍有几个关键问题需要克服。
首先是抗体持续时间。抗原进入机体后诱发免疫应答,体内抗体滴度随着时间逐步降低,直至失去保护效力。抗体持续时间是所有疫苗都必须考虑的问题。为了提高抗原递呈效率、促进免疫细胞的增殖和分化,一些递送系统直接靶向抗原递呈细胞。除此之外,还可以通过改善抗原翻译的药代动力学来延长抗原刺激时间,进而增强免疫应答。
其次,频繁出现的病毒突变体给疫苗的有效性带来挑战。病毒基因组的突变在复制过程中不可避免,大多数突变对病毒的影响很小,但有些突变会增强病毒的免疫逃逸和传播能力等,阻碍疫苗的开发。例如,流感病毒的频繁突变,造成每年都必须对疫苗作出修改以应对优势毒株;新冠病毒的Delta、lambda等变体也被发现具有更强的传播能力。
针对这类病毒的新策略是靶向不易突变的抗原蛋白或使编码的抗原范围更广。有研究表明,目前两款mRNA疫苗BNT162b2和mRNA-1273对新冠病毒的突变体也可产生较好的保护作用。但若未来某个突变株成为主体毒株,则要接种针对此变异株的加强剂。
从长远来看,开发一种能预防新型冠状病毒和其他冠状病毒的泛冠状病毒疫苗是未来的发展方向。病毒学家王林发团队8月18日发表在Lancet上的研究论文表明,泛冠状病毒疫苗策略具有可行性。该团队发现,SARS幸存者在接种了新冠疫苗BNT162b2后,体内产生的抗体可以中和10种不同的冠状病毒,且抗体水平相对较高[6]。
来源:Lancet
再者,目前获批的mRNA疫苗要求-70℃左右低温贮藏,大大限制了疫苗的使用,尤其在一些发展中国家。2014-2016年西非爆发埃博拉疫情,刚果使用-80℃冰箱为40万人完成疫苗接种。而COVID-19大流行中,需要接种疫苗的群体扩大至数十亿人,这就要求开发出更稳定的mRNA疫苗。在临床前研究中,CureVac证明其狂犬病疫苗RABV-G可以耐受-80℃至70℃的温度范围达数月以上。
最后,疫苗的安全性、特定人群(孕妇、婴幼儿、老人)的接种等都是摆在mRNA疫苗面前的问题。
六、展 望
COVID-19大流行期间mRNA的爆发离不开几十年间递送技术和mRNA设计技术的进步。我们有理由相信,随着科学技术的发展,mRNA疗法将为疫苗、肿瘤免疫治疗和蛋白质替代疗法等领域带来颠覆性变革。