
2763字3图,阅读大约需要6分钟。
文章首发于丰硕创投,欢迎朋友圈与微信转发。
公众号及其它平台转载请后台留言。
PDC药物正处于ADC药物当年起飞的时间节点上,但市场还未认识到它的价值,PDC能否引爆偶联药物,让我们拭目以待。
1.PDC药物简介
2.竞争格局
3.PDC药物临床研究进展
4.对PDC药物的一些看法
5.结语
1
PDC药物简介
PDC(peptide-drug conjugate)即多肽偶联药物,由连接子(linker)、归巢肽(homing peptide)以及具有细胞毒性的有效载荷(payload)构成,归巢肽可以特异性靶向肿瘤细胞表面过表达的蛋白受体从而传递细胞毒素诱导肿瘤细胞凋亡。相比于目前大火的ADC药物,PDC药物具有分子量小、肿瘤穿透性强、免疫原性低、利用固相合成法可大规模合成、生产成本较低、相对较好的药代动力学等特点,成为继小分子靶向药、单克隆抗体、ADC之后的下一代靶向抗肿瘤药。
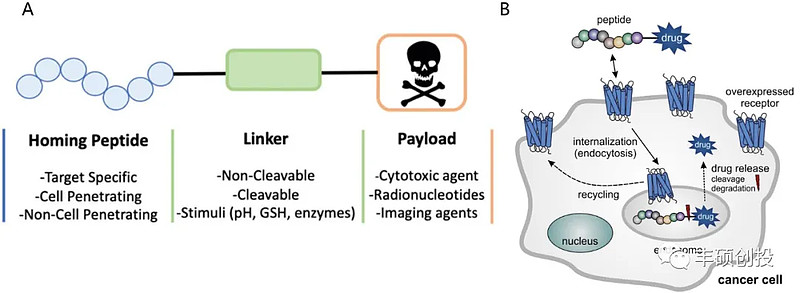
图1 PDC药物的结构及作用机理(资料来源:Chemical Society Reviews,Peptide Science,丰硕创投整理)
2
竞争格局
从全球市场来看:目前仅有两个PDC药物获批上市,行业关注度低、整体处于早期开发状态,国内在这个领域尚是一片处女地。

图2 PDC药物全球竞争格局(资料来源:ClinicalTrials,各公司官网,丰硕创投整理)
3
PDC药物临床研究进展
诺华的Lutetium Lu 177 dotatate针对生长抑素受体阳性的渐进性中肠神经内分泌肿瘤(NETs)的III期临床数据非常积极!与单独使用octreotide LAR(60 mg)的对照组(Oct,n=114)相比,无论患者的基线肝肿瘤负荷(LTB)如何,与最佳标准护理手段(30 mg 长期奥曲肽octreotide LAR)联用的Lutathera试验组(Lu,n=117)可使肿瘤进展或死亡风险降低约80%,在低、中、高三组LTB患者中,Lutathera组与单独使用60 mg奥曲肽LAR的中位数PFS(月)分别为:28.35 VS 11.04(HR=0.218,95% CI 0.120 to 0.394);NR(Not Reached,未达到)VS 8.67 (HR=0.202,95%CI 0.077 to 0.525);19.38 VS 5.52(HR= 0.193, 95%CI 0.079 to 0.474)。整体健康状况方面,Lutathera组与单独使用60 mg奥曲肽LAR组相比,中位数TTD(月)分别为28.81 VS 6.11(低度LTB); NR VS 5.98(中/高度LTB患者,由于中度和高度肝脏负担组的患者数量和恶化事件对于生活质量评估较小,因此将中度/高度肝脏负担组合并为一组)。身体功能的中位数TTD(月)分别为25.20 VS 11.47(低度LTB患者组); NR VS 11.56(中/高度LTB患者组)。
Oncopeptides公司的Pepaxto联合地塞米松的治疗方案针对157名三重难治、髓外疾病、具有细胞遗传学高危特征的患者亚组在免疫调节剂(IMiD)和蛋白酶体抑制剂(PI)治疗失败且对泊马度胺/达雷木单抗不敏感的关键II期HORIZON临床结果显示:(1)在意向性治疗(ITT,n=157)群体中,总缓解率(ORR)为29%、中位无进展生存期(PFS)为4.2个月、中位总生存期(OS)为11.6个月;在有治疗应答的患者中,中位缓解持续时间(DOR)为5.5个月、中位PFS为8.5个月。(2)在三重难治亚组(n=119)中,ORR为26%、中位PFS为3.9个月、中位OS为11.2个月;在有治疗应答的患者中,中位DOR为4.4个月、中位PFS为8.5个月。(3)在髓外疾病(EMD,n=55)亚组中,ORR为24%、中位PFS为2.9个月、中位OS为6.5个月;在有治疗应答的患者中,中位DOR为5.5个月、中位PFS为17.3个月。组合疗法显示出持久缓解、且随着治疗时间的延长而加深,这表明患者能够从长期治疗中获益,为难以治疗且预后很差的多发或难治性骨髓瘤患者患者提供一种治疗选择。
AngioChem Inc 的ANG1005对中位年龄47.5岁,94%的受试者(n=72乳腺癌脑转移患者,n=28软脑膜癌亚群患者)接受过紫杉烷治疗的II期临床结果显示:在77%(颅内)和86%(颅外)可评估患者中观察到患者获益(疾病稳定或更好),iORR为15% VS 8%。在软脑膜癌的亚组中,有79%的患者颅内疾病得到了控制,估计mOS为8.0个月(95%CI,5.4-9.4)。
4
对PDC药物的一些看法
根据我们对全球PDC药物的盘点可以发现:相比于目前大火,国内企业扎推上马的ADC药物,PDC药物显得格外冷门,就像Mylotarg刚上市时ADC药物的情景,但我们应该对其要有一个相对全面的认识:
(1)稳定性。PDC相比于ADC最大的不同在于其分子量较小,这决定了PDC比ADC更适合治疗实体瘤,但PDC较小的尺寸(<5000 Da)导致其容易被肾脏清除,在体内的稳定性差和半衰期短,造成其对实体瘤的治疗效果有限,但化学修饰可以改善其成效性比如肽钉合和环化(Bicycle Therapeutics公司开发的针对实体瘤的PDC药物BT5528和BT8009就是利用该方法)、多肽侧链的氨基酸改造(如将L-氨基酸更替为D-氨基酸)、多肽本身的化学修饰(如将多肽链PEG化或者链接脂肪链)、制剂优化(如使用渗透促进剂和耐酸涂层)。
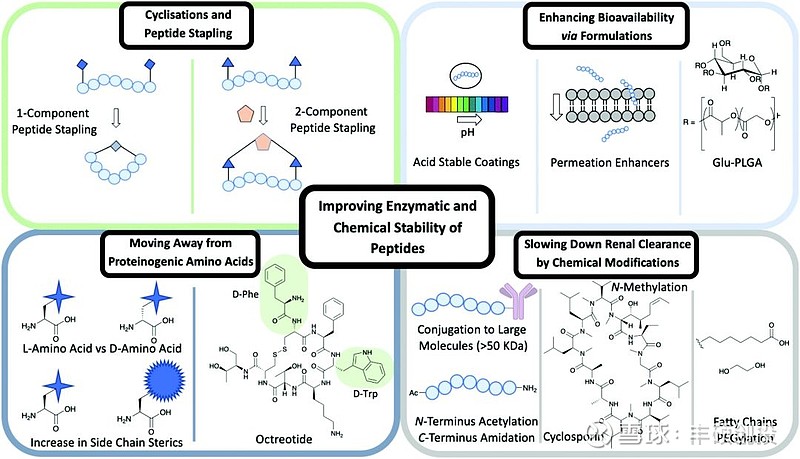
图3 提高多肽稳定性的方法(资料来源:Chemical Society Reviews,丰硕创投整理)
(2)靶向性。ADC药物快速发展的重要原因在于单克隆抗体技术的改进,使得靶向肿瘤的特异性得以提高。而噬菌体展示技术的飞速发展使得筛选出对肿瘤特异表达或高表达的受体亲和力高的多肽成为可能,而且多肽比抗体结构更为简单,生产和鉴定的成本更低。
(3)国内药企弯道超车的机遇。宏观来看,国内药企目前在ADC药物开发方面HER2-ADC扎推严重,但究其本质无非是类似第一代ADC的T-DM1或类似第三代的DS-8201,有效载荷模仿国外药企的MMAE、MMAF、DM1,链接技术或赖氨酸或半胱氨酸,HER2-ADC临床效果大多甚至不如T-DM1,更妄谈DS8201。领跑国内ADC药物开发的百奥泰的BAT8003、BAT8001相继失败,给国内的仿创新、伪创新药企敲响了警钟,“临床效果差不多”就会获批的时代已经终结。国内药企要想在偶联药市场占据一席之地,必须避免缺乏核心竞争力的同质化竞争,要在连接子、有效载荷、连接点技术等方面有所创新。目前暂时受到冷落的PDC药物,无论从成本还是本身的开发价值上都很值得期待,国内药厂应该积极关注,审慎进场。2000年辉瑞推出第一个ADC药物Mylotarg后市场不温不火,11年后才上市第二个ADC药物Adcetris,最近两三年ADC药物才迎来了爆发期,PDC或许目前就处于当初ADC启程的那个时间点。
结语
从全球PDC药物市场来看,行业基本“遇冷”,没有受到太多关注。百奥泰给绝大多数还沉迷于ADC药物争夺战中的中国企业好好上了新药研发的技术风险与同质化竞争的进度风险的一课,PDC药物或许是中国偶联药物开发企业另辟蹊径所在。
声明:以上内容仅供参考,不构成投资建议。
参考资料
1. 网页链接
2. 网页链接
丰硕创投
丰硕创投成立于2019年,专注于大健康领域的投资。丰硕创投是一家以基本面研究为基础的创投,注重公司长期发展价值的挖掘。通过多维度的认知和不断自我进化构建完整的投资体系。我们有受托人基因,对资本市场有敬畏之心,把风险控制放在首位,用狙击式打法和专业的视野持续为投资人创造价值。