
贝壳社,国内领先的医疗健康创新创业平台
来源丨美柏医健
微信丨mybio1
根据CRI(Cancer Research Institute)的统计,自2017年9月CRI首次开展PD-1/L1试验的现状调查以来,4款新的PD-1单抗已进入市场,依次为——再生元的cemiplimab、信达生物的信迪利单抗、君实生物的特瑞普利单抗、恒瑞医药的卡瑞利珠单抗,将全球市场上已获批的PD-1/L1单抗总数增加至10款(图1、图2)。而第5款新的PD-1单抗——来自百济神州的替雷利珠单抗,也即将获国家药品监督管理局(NMAP)批准上市。
根据《NatureReviews ·Drug Discovery》近日发表的一篇综述,PD-1/ PD - L1单抗现已成为16种不同癌症类别和不限癌种适应症的标准治疗手段。
另外,FDA还批准了23项涉及扩大PD-1/L1单抗适应症的补充新药申请(sNDA)。
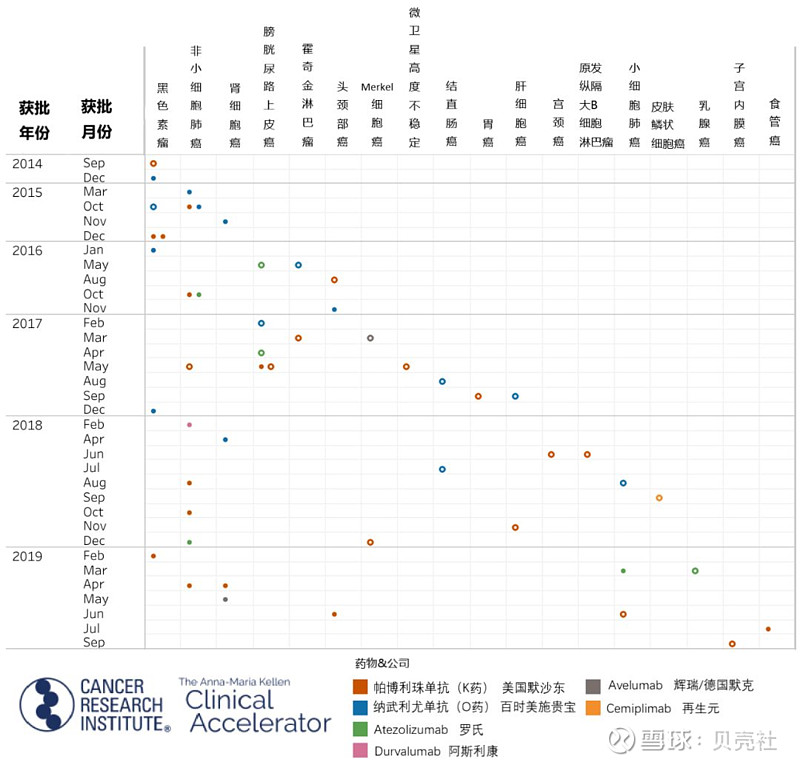
▲ 图1. PD-1/L1单抗获美国FDA批准时间线
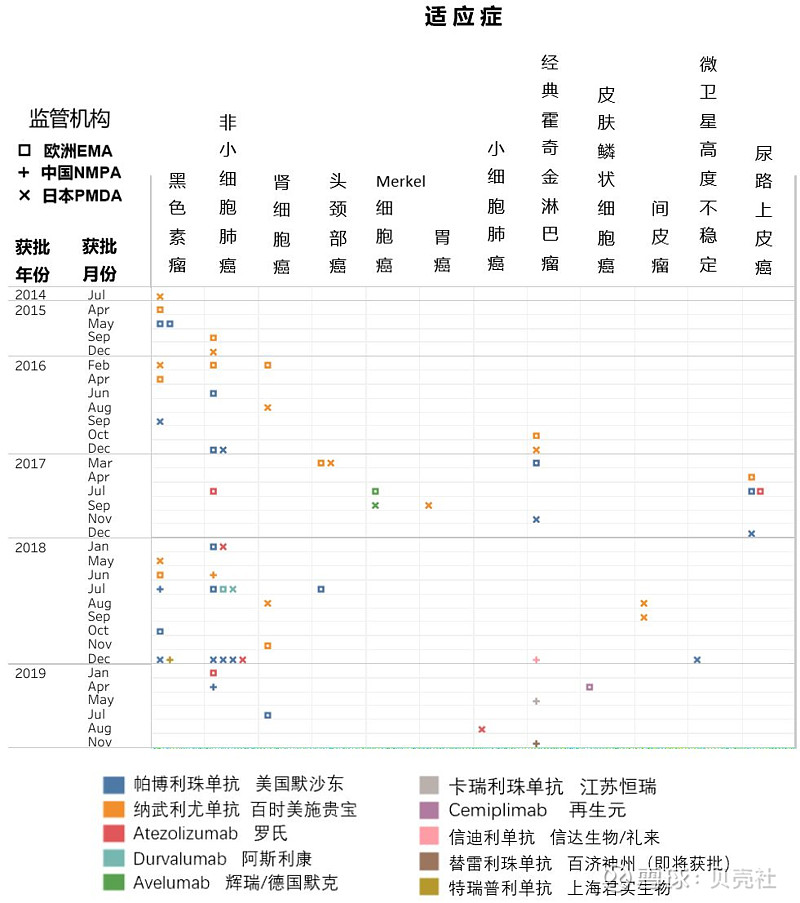
▲ 图2. PD-1/L1单抗在欧盟、中国和日本获批时间线

PD-1/L1单抗临床试验趋势
共上市10款,50%于两年内获批
自2006年以来,全球范围内共开展了3362项PD-1/L1单药或联合其他药物的试验;截至2019年9月,其中的2975项仍在进行,计划招募50多万名患者。
与2017年9月进行的第一次调查的1506项相比,近两年新增了1469项正在进行的临床试验,这些试验涵盖了大多数癌类型,涉及一、二、三线治疗 (图3)。
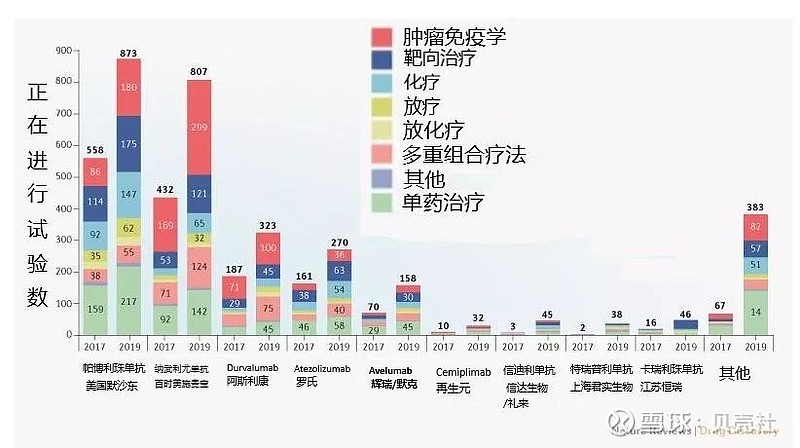
▲图3. 2017年&2019年PD-1/L1抑制剂临床试验数对比图
从图3可见,除了之前最先上市的5款PD-1/L1单抗之外,在过去两年里,有4款新的PD-1单抗获批——再生元的cemiplimab、信达生物的信迪利单抗、 君实生物的特瑞普利单抗和恒瑞医药的卡瑞利珠单抗。此外,百济神州的PD-1单抗替雷利珠单抗也即将获批。
联合疗法大势所趋
目前,76%正在进行的试验,主要检测PD-1/L1单抗与其他癌症治疗手段的联合治疗效果,如免疫肿瘤学疗法、靶向治疗、化疗或放疗。
在过去的两年中,临床试验领域从单一疗法向联合疗法的转变,促使FDA批准了14种联合疗法。
值得一提的是,两种新的重磅联合治疗策略获得批准:1)PD-1单抗+靶向治疗,针对肾癌和子宫内膜癌;2)PD-1单抗+靶向治疗+化疗,针对肺癌。
CRI还发现295种其他药物靶点正在与PD-1 / PD-L1单抗进行联合疗法试验,两年来共增加136种靶点(图4)。

▲ 图4.2017~2019年间PD-1/L1抑制剂与其疗法联合的试验数增加了一倍
而在新开展的PD-1/L1抑制剂联合疗法试验中,最常见的3种组合分别涉及:化疗(235项新试验)、CTLA-4单抗(186项新试验)和血管内皮生长因子(VEGF)信号通路靶向药(114项新试验)(图5)。
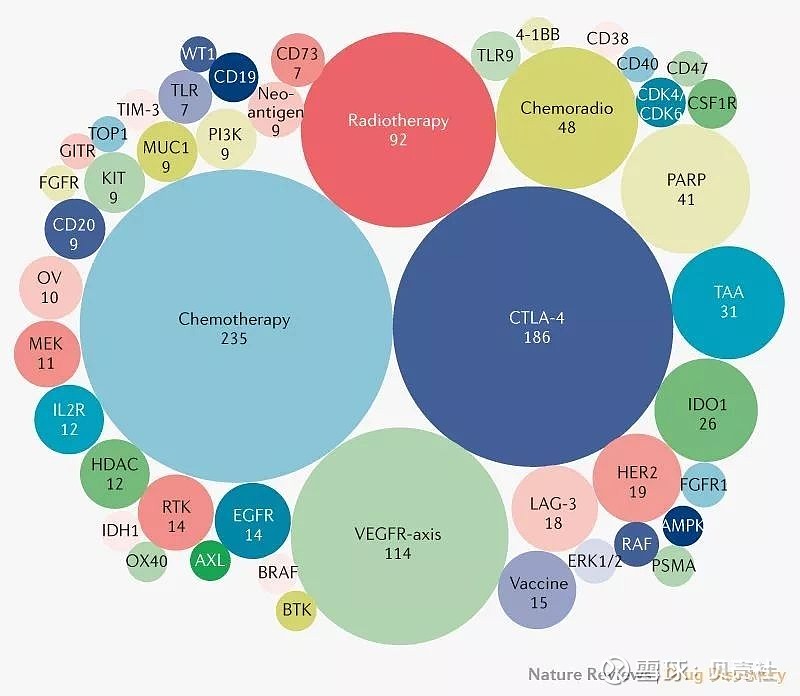
▲图5. 2017~2019年新开展的PD-1/L1抑制剂联合疗法试验概览
注 OV:溶瘤病毒;TAA:肿瘤相关抗原
FDA最近批准的4项治疗方案就是基于PD-1/L1抑制剂与VEGF抑制剂的组合策略:
两项用于肾癌(① 帕博利珠单抗 + 阿昔替尼、②avelumab + 阿昔替尼),一项用于子宫内膜癌(帕博利珠单抗 + 仑伐替尼),另一项用于非小细胞肺癌(atezolizumab+贝伐珠单抗+化疗),表明PD-1/L1抑制剂+VEGF抑制剂的组合策略具有广泛的应用前景。

PD-1/L1试验从常见癌症转向罕见癌症
在试验设计方面,平均每个PD-1/L1试验计划的入组人数在不断下降。过去6年,每个试验的平均入组人数从2014年的429人下降至2019年的129人(图6)。
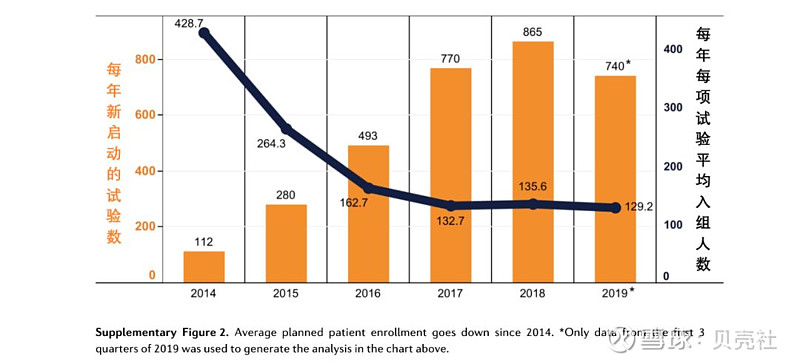
▲图6. 自2014年起PD-1/L1抑制剂试验计划的平均入组人数一直在下降
这种试验规模的缩小与针对常见癌症类型的新启动试验数量的减少有关,如黑色素瘤、乳腺癌、肾癌以及肺癌。尤其是对于已经有相应已获批PD-1/L1疗法的癌症类型,每年新启动的试验数增长缓慢甚至下降。
相比之下,更多的新试验针对的是罕见癌症类型,不过符合入组条件的患者群体就要小得多(图7)。
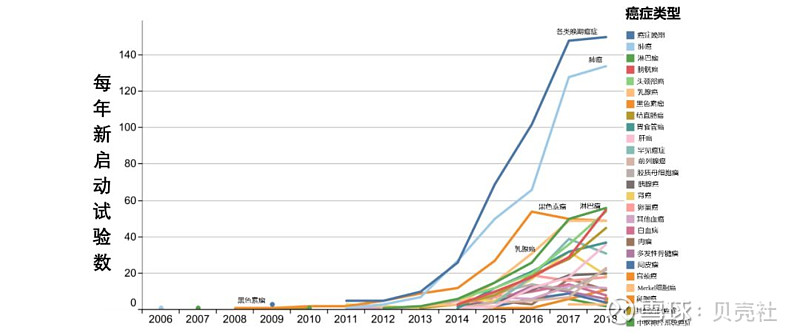
▲ 图7. 各类癌症每年新启动试验数变化

中国 PD-1/L1试验入组率最高
通过分析在中国、美国、其他六大主要市场(法国、德国、意大利、日本、西班牙和英国),以及亚太地区(澳大利亚、中国香港、韩国、新西兰、中国台湾和泰国)每个临床试验基地(site)的病人招募情况,CRI发现美国的受试者招募率最低,可能是由于PD-1/L1单抗作为标准治疗的普及率最高。
相比之下,我国PD-1/L1单药疗法试验的受试者招募率高出美国近6倍,联合疗法约为美国的4倍(图8)。中国每年有超过400万癌症新发病例,大多数中国癌症患者未曾接受过PD-1/L1单抗治疗,这意味着中国拥有相对较多符合入组条件的患者。
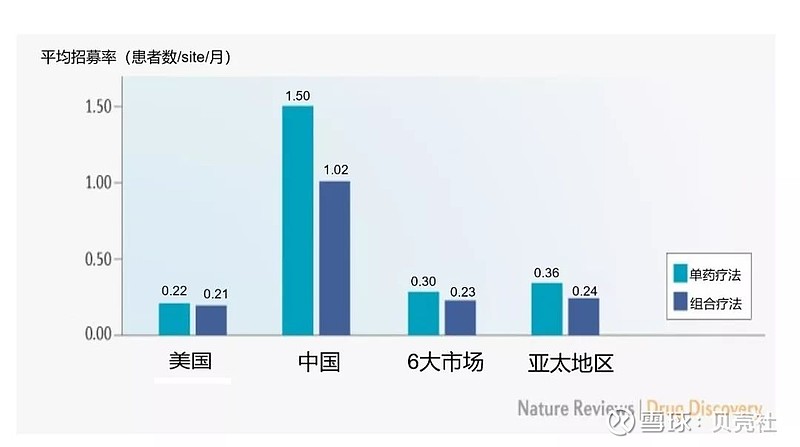
▲ 图8. 不同国家/地区PD-1/L1抑制剂试验的受试者招募率
事实上,与其他已获批的PD-1/L1单抗相比,中国公司在国内上市的三种PD-1单抗——信达生物/礼来的信迪利单抗、君实生物的特瑞普利单抗、恒瑞医药的卡瑞利珠单抗,其临床开发进展颇为迅速——仅为26~45个月,这得益于其临床试验能快速招募到患者。
随着最近中国加入人用药品注册技术要求国际协调会(ICH),中国临床试验产生的数据可能会支持其产品在其他成员国市场的应用。全球PD-1/L1试验机构应该利用在中国宝贵的患者资源来加速临床开发。

结语
目前,随着试验数量的不断增加,全球PD-1/L1单抗临床试验仍在快速发展,包括针对不同靶点的组合疗法,以及针对不同癌症类型的试验。在这一领域中,不同学科的创新汇聚在一起,为患者带来了许多突破性的治疗方案。随着该领域转向联合治疗,有必要针对目标患者,为每种联合治疗开发有效的生物标志物。
此外,由于大多数接受已上市PD-1/L1单抗治疗的患者会出现耐药性或复发,因此,该领域应更关注开发针对PD-1/L1耐药性的新组合方案。这些新的生物标记物和治疗方法,需要在临床试验中进行检验,而这些临床试验需要足够的患者亚群。我国作为新兴市场,拥有大量患者帮助支持更快的试验入组,这终将为全世界更多的患者带来更有效的PD-1/L1疗法!
参考资料:
https://网页链接
https://网页链接


更多合作扫描二维码
加微信备注公司+合作需求
更多精彩回顾
1
新药开发成本解析(附案例)
2
『同航汇·浙里融』AI+健康医疗项目秋季品质路演
3
知名药企,裁撤员工320人;两大注射剂被修改说明书 大批重点监控品种将遭市场抛弃丨贝壳日报