2020年的上半年即将结束,截至发稿时为止,美国FDA的药物评估与研究中心(CEDR)已经批准了24款创新药。在2020年上半年,新冠疫情给全球的医疗卫生系统带来了巨大的冲击,美国FDA也需要投入大量人力审评与新冠疫情相关的多种在研产品的研发工作。在这种情况下,对创新药的常规审评工作能否及时完成是业界关注的焦点之一。截至发稿时的数据表明,FDA在审评创新药上市方面,给出了满意的答卷。
今年上半年FDA新药批准创下了近10年来的多个“新高”。今天,药明康德内容团队,将结合FDA上半年获批新药的信息,与读者分享药物研发的几个趋势。
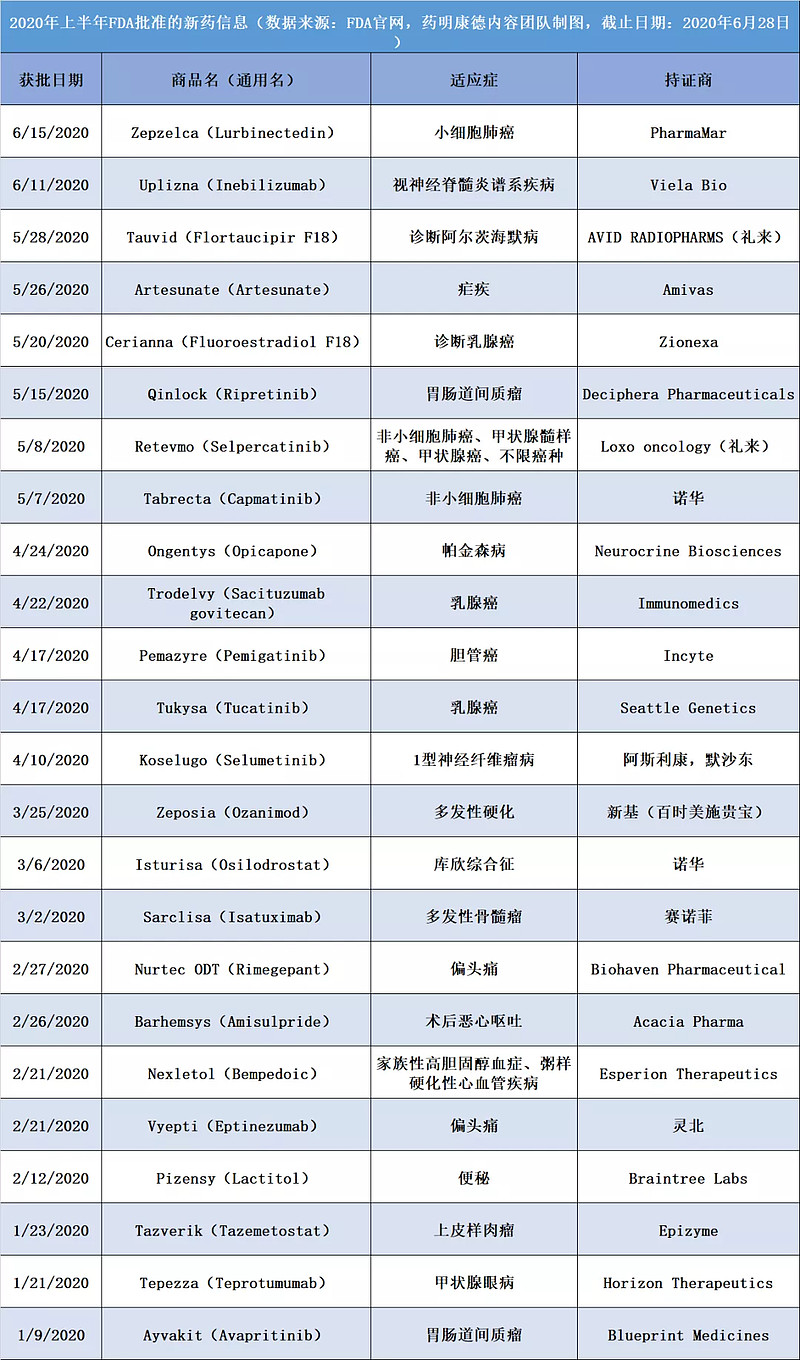
▲美国FDA在2020年上半年批准新药一览(数据来源:FDA官网,药明康德内容团队制图)
FDA上半年新药批准数目创10年来新高
当新冠疫情席卷全球之时,FDA能否在新冠疫情的压力下,按时完成对创新药的审评和批准工作,是业界关注的焦点之一。毕竟新冠疫情不但给FDA的工作人员增加了工作负担,也为多种审评流程和专家咨询会的召开设置了障碍。不过,从FDA今年上半年的新药批准数量来看,新冠疫情尚未显著影响到新药获批的速度。今年上半年FDA批准的新药数量在近10年中排名第一,甚至超过了获批总数创纪录的2018年的上半年表现。
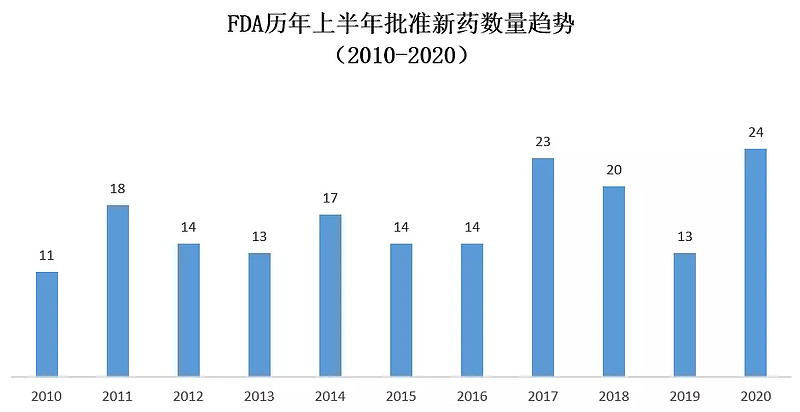
▲美国FDA历年上半年批准新药数目(数据来源:FDA官网,药明康德内容团队制图)
诚然,影响新药获批数目的原因是多方面的,涉及到新药申请递交的时间,不同加速通道的使用,以及FDA审批流程现代化等多种因素。而且,FDA官员也表示,虽然上半年的新药批准进度令人满意,但是如果新冠疫情持续发展,也不能保证以后的新药获批进度仍然能够得到保持。但是,FDA在新冠疫情中的表现,表明了它仍然将把创新疗法带给急需的患者作为工作的首要目标之一。
孤儿药获批比例创10年来新高
近10年来,获得FDA批准的孤儿药在获批创新疗法中的比例逐步上升。今年上半年,获得孤儿药资格的创新疗法获得批准的数目为14个,占上半年获批新药58.3%。从比例上看,达到了10年来占比的新高,比2018年的峰值(57.6%)还要高出一线。
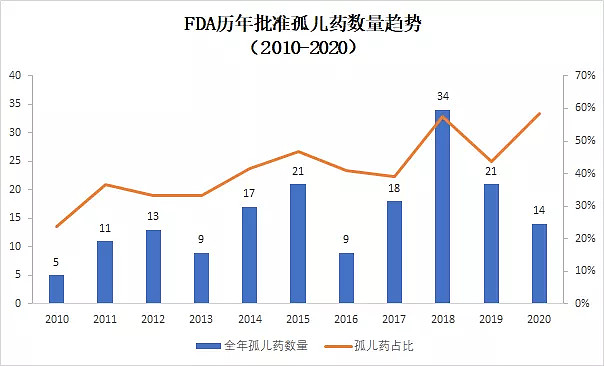
▲2010-2020年孤儿药获批数量和占比(数据来源:FDA官网,药明康德内容团队制图,2010-2019年数据为全年数据,2020年为上半年数据)
针对罕见病的孤儿药开发不但得益于FDA颁发的多种监管措施的激励,也体现了医药行业对罕见病疗法开发的重视。今年上半年获批的孤儿药中很多是针对患者数目稀少的罕见病。例如首款治疗1型神经纤维瘤病的药物疗法Koselugo(Selumetinib)。
另一方面,随着对癌症分子生物学特征的进一步了解,研发人员能够根据肿瘤携带的特定突变开发具有针对性的精准疗法。将癌症患者根据分子生物学特征进行细分,使治疗患者的数目也达到了获得孤儿药资格的标准,这也增加了孤儿药获批的数目。今年获批的首款新药,Blueprint Medicines公司开发的Ayvakit(Avapritinib)就是一个例子。
精准疗法获批占比创10年来新高
如上面所说,分子生物学技术的发展,让研究人员能够更详细地发现驱动癌症发展的基因变异,并且针对这些基因变异开发精准疗法。这些疗法由于特异性非常强,往往在具有良好疗效的同时,降低了疗法的毒副作用。今年上半年,FDA总计批准了4款精准疗法(定义为需要使用FDA批准的伴随诊断确定患者携带特定基因变异的疗法),占获批创新疗法的17%,达到近10年来占比值的高峰。上面提到的Ayvakit,和首款获得FDA批准的MET抑制剂Tabrecta(Capmatinib)都是这一药物开发策略的范例。
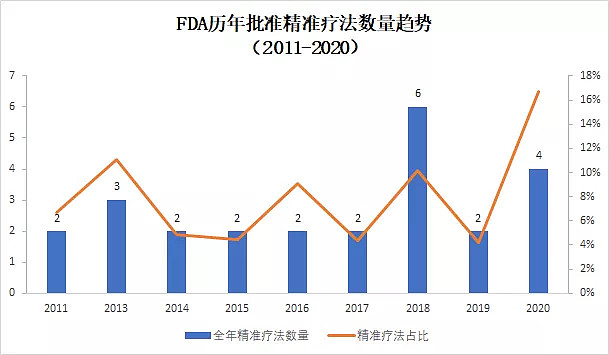
▲2011-2020年精准疗法获批数量和占比(数据来源:FDA官网,药明康德内容团队制图,2011-2019年数据为全年数据,2020年为上半年数据)
从历史数据中可以看出,精准疗法获批占比在过去十年中没有太多变化。然而,随着下一代测序技术的进一步普及,以及液体活检技术的进一步完善,个体化治疗的策略正在被医药行业普遍采纳。我们希望今年上半年多款精准疗法的批准,成为精准疗法爆发的先兆。
抗体偶联药物的光明未来
今年上半年,FDA批准了Immunomedics公司开发的抗体偶联药物Trodelvy(sacituzumab govitecan-hziy)上市,治疗三阴性乳腺癌患者。这也是近一年半以来,FDA批准的第4款抗体偶联药物,占FDA总共批准的抗体偶联药物的50%。
抗体偶联药物(ADC)的开发并非一帆风顺,虽然这一概念早在上世纪70年代就被提出,但是到2000年,辉瑞的Mylotarg才成为FDA批准的首款ADC。然而,因为毒性原因它在2010年撤市。开发成功的ADC需要特异性高的抗体,毒性强的细胞毒性分子,以及稳固的连接子(linker),在保证足够的药物能够达到肿瘤细胞内部,产生杀伤活性的同时,降低对健康组织的伤害。过去的几十年里,业界投入大量资源和精力改进构建ADC的技术。
可喜的是,近年来多款ADC的获批显示,对ADC构建技术的改进有效地提高了ADC药物的获益/风险比。新一代的ADC不但携带全新的细胞毒性分子(例如去年底获批的Enhertu),而且在控制药物抗体比例(ADR)和连接子稳定性方面也做出了长足的进步。使用非天然氨基酸,研究人员能够精确控制偶联在抗体上的细胞毒性分子的数目和偶联位点,让ADC的安全性控制更为精准。
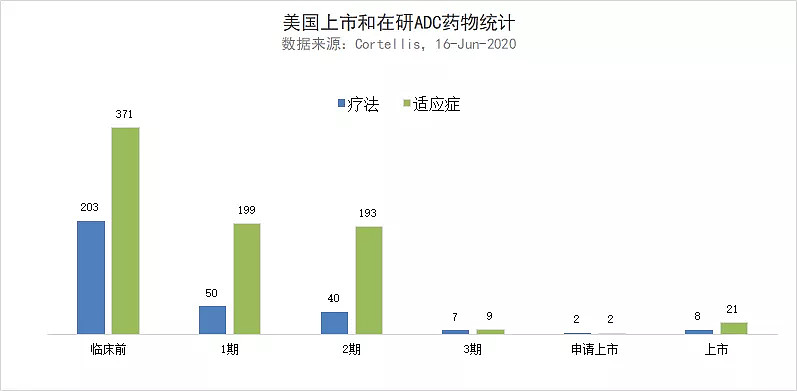
▲美国上市和在研ADC药物统计(数据来源:Cortellis,截至2020年6月16日,药明康德内容团队整理数据和制图)
对ADC研发管线的统计也表明,目前在临床1/2期阶段,有大量在研ADC疗法在用于治疗几百种适应症。ADC技术的进步也让研究人员不再局限于将细胞毒性分子偶联在抗体上,新一代ADC能够将免疫调节因子等其它药物类型偶联在抗体上,治疗癌症以外的其它疾病。
我们期待随着ADC技术的不断完善,这一治疗模式能够发挥出它最大的潜力。
限于篇幅,本文不再对2020年上半年每款获批药物进行点评,点击文末“阅读全文/Read more“,即可浏览FDA新药获批专辑,查看药明康德内容团队对这些新药的报道。
参考资料:
[1] Novel Drug Approvals for 2020. Retrieved June 28, 2020, from 网页链接
[2] How the Next Generation Antibody Drug Conjugates Expands Beyond Cytotoxic Payloads for Cancer Therapy. Retrieved June 28, 2020, from 网页链接
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。