

如今,全球很多国家正步入老龄化社会,其中日本、德国、意大利是老龄化最严重的三个国家,其老年人占比均超过 20%。据联合国人口老龄化统计标准,65 岁以上老年人占总人口的 7% 就意味着该国家或地区已经进入老龄化社会。
中国亦是“老龄化社会”的一员,根据国家统计局发布的数据显示,截至 2019 年底,中国 65 岁及以上人口数量已经超过 1.8 亿,约占总人口的 12.6%,显然也已步入老龄化社会。
随着全球老龄化的加剧,神经退行性疾病的发病率呈上升趋势,逐渐成为主要的衰老相关疾病类型之一,然而,目前仍然缺乏有效药物和治疗方法。
近些年越来越多的研究显示,烟酰胺腺嘌呤双核苷酸(NAD)具有一定的抗衰老功效,并且,基于神经退行性疾病动物模型的研究发现,提高 NAD 水平可有效改善神经细胞健康、记忆和认知能力。因此,维持 NAD 的代谢稳态对于保持神经系统健康乃至抗衰老都至关重要。
近期,清华大学药学院王戈林和唐叶峰团队,通过高通量药物筛选并基于靶点结构的理性药物设计方法,发现了靶向 NAD 生物合成限速酶烟酰胺磷酸核糖基转移酶新型小分子激活剂,为开发神经退行性疾病创新药物提供了新的策略。目前,这两项研究成果分别发表在 Cell Research 和 European Journal of Medicinal Chemistry 上。

▲图|相关论文(来源:Cell Research)

▲图|相关论文(来源:European Journal of Medicinal Chemistry)
“我们开展这项研究的初衷,是针对人口与健康领域的重大需求,瞄准 NAD 代谢调控和神经退行等衰老相关疾病这一新的科学前沿热点来开发神经保护药物。”清华大学药学院王戈林教授告诉生辉。
王戈林 1992 年本科毕业于武汉大学生物学系,1998 年她在武汉大学生命科学学院获得遗传学博士学位后留校任教,次年赴美国德克萨斯大学西南医学中心从事博士后研究工作。现在,她是清华大学药学院研究员、博士生导师,主要研究方向是通过解析小分子药物的靶向作用来揭示衰老生物过程和调节机制,同时发现新的抗肿瘤及抗老年神经退化性疾病药物,并设计和开发相应的治疗策略。

▲图|清华大学药学院王戈林教授(来源:受访者)
这两篇论文的共同通讯作者、清华大学药学院唐叶峰教授本科毕业于在兰州大学化学系,随后在中国医学科学院药物研究所获得药物化学硕士学位。2003 年他进入北京大学攻读博士学位,而后赴美国斯克利普斯研究所从事博士后研究工作。
2010 年,唐叶峰进入清华大学做独立 PI 并于 2018 年获得长聘副教授,主要研究方向为“功能导向的合成化学”,基于绿色合成方法,实现目标分子的快速、高效和多样性合成,并将其应用于药物化学以及化学生物学等相关研究领域。截至目前,唐叶峰已在本领域重要期刊(如 Cell Res., Acc. Chem. Res., J. Am. Soc. Chem., Angew. Chem. Int. Ed.)上发表 SCI 论文 70 余篇,申请中国专利 4 项、国际 PCT 专利 1 项。

▲图|清华大学药学院唐叶峰教授(来源:受访者)

开发小分子激活剂增强细胞内 NAD 合成,为神经退行性疾病药物提供潜在靶点
NAD 于 1904 年被英国生物化学家 Arthur Harden 首次发现为发酵过程中的辅助因子,多年后, Hans von Euler-Chelpin 确定这种因子是一种核苷磷酸糖,两人因此共同获得了 1929 年诺贝尔化学奖。NAD 是生物体内广泛存在的重要代谢物,其主要功能体现在两个方面:首先,作为新陈代谢的关键参与者,NAD 帮助将营养物质转化为能量;其次,具有强大的抗衰老价值,NAD 可以维持关键端粒的长度,促进基因修复,延缓细胞衰老速度,减缓衰老过程并延长寿命。
NAD:
NAD(Nicotinamide Adenine Dinucleotide),全名烟酰胺腺嘌呤双核苷酸,简称辅酶Ⅰ,是一种转递质子的辅酶,参与细胞物质代谢、能量合成、DNA 修复等多项重要生理活动。
然而,在迄今为止研究的生物体中,从单细胞酵母,到小鼠,再到人类,体内 NAD 水平会随着时间的推移而逐渐下降。有临床研究显示,人类在 50 岁时体内的 NAD 水平仅为 20 岁时的一半左右。
提高 NAD 水平的一种有效方法是补充 NAD 前体,如 NA(烟酸)、NR(烟酰胺核糖)、NAM(烟酰胺)以及 NMN(β-烟酰胺单核苷酸)等。
在这项试验中,王戈林和唐叶峰团队并非从 NAD 前体着手研究,而是另辟蹊径,从开发 NAD 合成关键酶的激活剂展开研究,通过增强体内 NAD 的生物合成来实现对抗神经退行性疾病的目的。
“十多年前,我们通过在小鼠中进行的基于表型的药物筛选,发现 P7C3 类小分子能促进成年小鼠海马神经发生,并在多种神经退行性疾病动物模型中具有良好疗效,随后的药物作用机制研究揭示了 P7C3 的靶点是 NAD 生物合成限速酶 NAMPT,首次展现了利用靶向 NAD 生物合成酶以增强 NAD 水平的策略实现神经保护功能的可行性。”王戈林指出。
NAMPT:
NAMPT(Nicotinamide Phosphoribosyl Transferase),全名烟酰胺磷酸核糖转移酶,是催化烟酰胺(NAM)合成 β-烟酰胺单核苷酸(NMN)的酶。
NAMPT 是 NAD 合成过程中的一个限速酶,NAD 的合成量的多少直接受 NAMPT 酶活性的调控,更广泛地层面,其实整个机体 NAD 循环代谢水平都会受到 NAMPT 的影响。
NAM 作为 NAD 的前体之一,主要通过“生物合成挽救途径”在人体中合成 NAD,该途径也可以看作是一种“回收再利用”机制,因为在这个过程中 NAM 既是 NAD 的合成原料,也是 NAD 被消耗后的代谢产物。然而,在 NAM 转化为 NAD 的过程中,NAMPT 酶进行了“限速”,导致 NAM 合成 NMN 的效率低,进而导致 NAD 的提升水平非常有限。
“基于先前的研究,我们此次通过高通量药物筛选,获得了靶向 NAMPT 的新型小分子激活剂(NATs),并深入研究了 NATs 作用机制,及其在细胞和临床前动物模型中的保护功能。”王戈林表示。
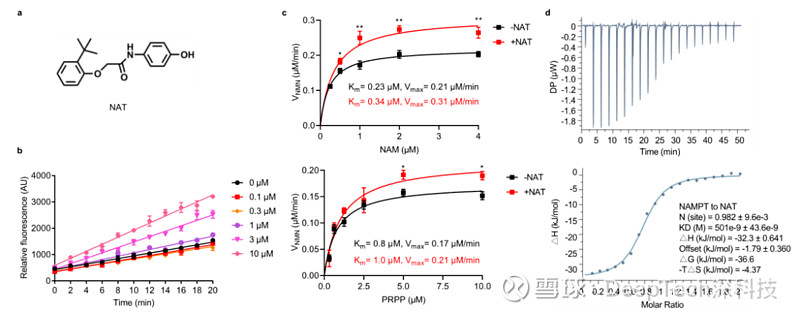
▲图|通过高通量筛选发现新型 NAMPT 小分子激活剂 NAT(来源:Cell Research)
在这项新研究中,“阐明NAT 如何通过激活 NAMPT 来增强 NAD 水平,是我们面临的最大难题。”王戈林坦言,“通过对 NAMPT 与 NAT 复合物的晶体结构进行解析,我们在原子水平上观察到 NAT 作用于 NAMPT 的催化口袋内部,通过与酶活性位点附近区域的相互作用,促进两个底物 NAM 和 PRPP(5-磷酸核糖-1-焦磷酸)的缩合形成 NMN,进而提高 NAMPT 的催化效果,从而显示出对该限速酶的激活效应。”她表示。
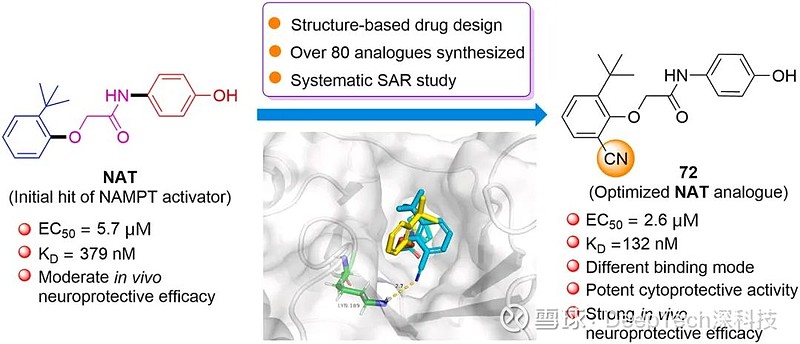
▲图|针对先导化合物 NAT 进行结构改造和优化(来源:European Journal of Medicinal Chemistry)
“在此基础上,我们进一步采用理性药物设计理念,结合靶点和小分子复合物晶体结构信息,对 NAT 进行了系统地改造和优化,最终获得了能显著提高酶激活活性和细胞内 NAD 水平的候选药物分子(NAT-5r)。”唐叶峰补充道。
随后,他们通过动物试验研究发现,NATs 可增强细胞内 NAD 合成,并诱导代谢和转录重编程,而更为关键的是,NATs 在化疗诱导的神经损伤小鼠模型中表现出了较好的神经保护效果。
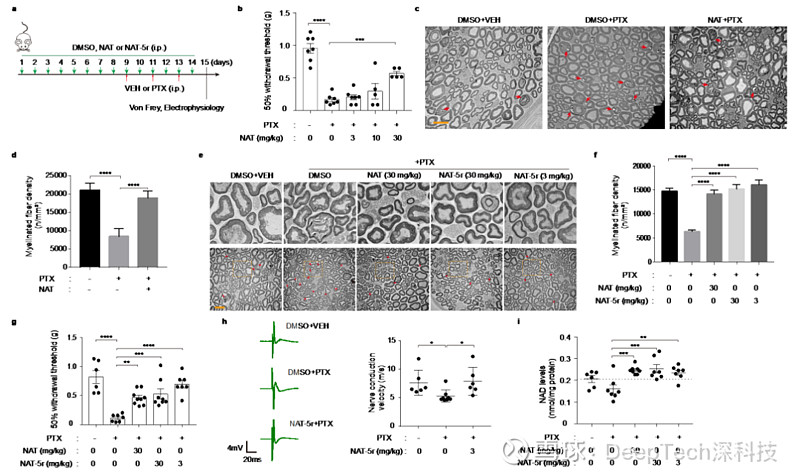
▲图|NAT 和 NAT-5r 在化疗诱导神经损伤小鼠模型中起到神经保护效果(来源:Cell Research)
“我们的这项研究在理论上提供 NAD 代谢物在神经保护中发挥重要作用的概念验证,为理解 NAD 对神经退行性疾病发生和发展的影响提供了新的视角,并为神经退行性疾病药物研发提供了潜在的靶点,以及创新药物。”王戈林总结道。

多项成果已经实现产业转化
关于下一步的研究动向,“我们的目标是深化基础研究工作,为产业转化打下良好的基础。”王戈林指出,“我们聚焦阐明这类全新 NAMPT 激活剂 NATs 的神经保护作用机制,并拓展其在中枢神经系统神经退行性疾病中的应用。”
很多研究已经证实,NAD 水平下降是衰老的重要特征。NAD 合成受损或 NAD 消耗加剧导致的 NAD 水平下降,这与衰老相关疾病的发生/发展密切相关,而在动物模型中提高 NAD 水平可以延缓衰老及相关疾病的进程,所以,提高 NAD 水平有望发展成为一种在总体上延缓衰老的新型治疗策略。“因此,我们也会同步探究 NAMPT 激活剂 NATs 在干预衰老中的潜在应用。”她补充说。
这项研究成果未来若要广泛应用于神经退行性疾病的临床治疗,“还需要通过进一步的化合物改造和优化,提高活性和成药性。除此之外,适应症若是扩展到与衰老相关的疾病,如何进行临床试验也将是我们面临的一个挑战。”王戈林指出。
据王戈林介绍,相较于 NAD 的前体,这种小分子激活剂 NATs 具有如下几个优势:
其一,可以有效提高细胞内的 NAD 水平;其二,拥有较高的“生物利用度”;其三,合成简单,成本较低,而且拥有更大的结构空间可以进行药物特性优化,更有利于后期开展临床研究;其四,NATs 的作用会在限速步骤受到调控,以满足不同生理条件下细胞的需求,从而防止 NMN 或 NAD 过量可能引发的副作用。
王戈林课题组多年来聚焦于细胞死亡信号通路及相关抗肿瘤药物发现领域,曾筛选出许多诱发肿瘤细胞死亡的小分子,并从中发现了第一个直接通过蛋白多聚化来激活死亡受体 DR5 的小分子,为安全有效的抗癌药物开发打下了基础。
此外,她还首次发现 NAD 合成的限速酶 NAMPT 是一类神经保护小分子药物 P7C3 的靶点,揭示出提高体内 NAD 的生物合成可以延缓细胞死亡,具有这种效果的小分子药物能发挥抗老年神经退化性疾病的作用,从而帮助相应治疗策略的设计和更优小分子的开发,相关研究成果已经获得专利。2015 年,谷歌旗下的生命科学公司 Calico 购买了 P7C3 神经保护分子的专利进行药物开发。
唐叶峰课题组的研究方向定位于“功能导向的合成化学”。“我们以具有新颖化学结构和重要生物活性的天然产物或药物分子作为研究对象,通过发展新策略和新反应,实现目标分子的高效和多样性合成,并在此基础上,围绕所获得的活性分子开展药物化学和化学生物学研究,为发现具有应用转化前景的新药物、新靶点和新机制提供物质基础和技术支持。”唐叶峰说道。据了解,唐叶峰课题组已经与德国拜耳(Bayer)公司开展合作,将已经开发出的大量杂环分子库应用于“基于片段的药物发现”。
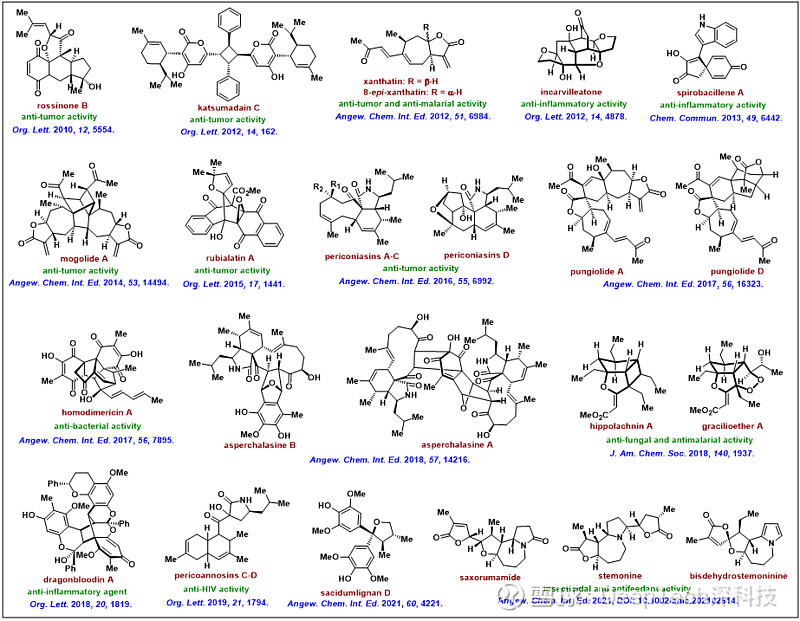
▲图|唐叶峰课题组完成的代表性天然产物全合成(来源:清华大学药学院)
以苍耳烷型倍半萜为例,这是从药用植物苍耳中发现的一类天然产物,具有丰富的化学和生物多样性。“自 2011 年以来,我们课题组围绕苍耳烷型倍半萜展开了系统深入地研究,解决了该家族几乎所有代表性骨架的合成问题。”唐叶峰表示,“在此过程中,我们还建立了一系列新颖独特的合成方法学,如环张力驱动的环丙内酯 Dyotropic 重排反应,为合成该类天然产物提供了一种普适性合成方法。”他补充说。
据介绍,唐叶峰课题组与王戈林课题组合作,对上述合成工作中获得的天然产物及相关分子进行了药物化学和化学生物学研究,并开发出一类具有诱导肿瘤细胞凋亡活性的小分子化合物,他们还发现,该类分子通过共价键与其靶点结合,具有新颖的抗肿瘤作用机制,相关研究成果将于近期发表。
“我们以天然产物为纽带,将不同研究领域(合成化学、药物化学、化学生物学以及生物学)有机地串联在一起,为新药研发提供了坚实的物质基础和理论支撑,也充分体现了‘学科交叉、协同发展’的研究特点。”唐叶峰指出。
产业转化层面,王戈林和唐叶峰向生辉介绍道,“我们在上述两篇文章投稿前,就已经产生了成立干预衰老相关疾病初创公司的想法,也进行了一些前期的准备工作,与此同时,我们还在考虑与一些药企合作进行产业转化的可能。”

参考资料:
1. 网页链接
2. 网页链接
3. 网页链接
4. 网页链接
5. 网页链接

【往期推荐】
专访丨 8 个月即获里程碑,国内首家免疫代谢新锐利用 AI 打破自免疫疾病医疗僵局,3 项在研管线同步推进中
清华团队创办,初创重点布局渐冻症、帕金森病,预计2-3年内首条管线进临床 | 专访神济昌华
专访红云生物|首款药物布局 「耐药」市场,依托蛋白动态结构平台开发第四代EGFR抑制剂,已启动全球临床研究
专访 | MIT团队发现帕金森病治疗新靶点,可同时改善运动/情感障碍,即将开展灵长类动物试验
点击访问生辉小程序,查看更多报道。