精彩内容
首款治疗鼻咽癌的PD-1诞生;
默沙东、AZ、GSK新药获批;
60亿明星药东阳光药申报上市;
流感1类新药首次获批临床;
正大天晴2款1类新药获批临床;
齐鲁、海思科......60款1类新药亮相;
17个新药上市申请新进展,首款治疗鼻咽癌的PD-1诞生
1月23日-2月26日期间,17个新药(34个受理号)的上市申请有审评审批状态更新。6款国产新药获批上市(含新适应症),包括君实与信达的两款PD-1、正大天晴的安罗替尼、海思科的环泊酚等;9个新药批准进口,包括安斯泰来的吉瑞替尼、葛兰素史克的拉莫三嗪、默沙东的泊沙康唑等。
(1.23-2.26)新药上市申请审评审批状态更新
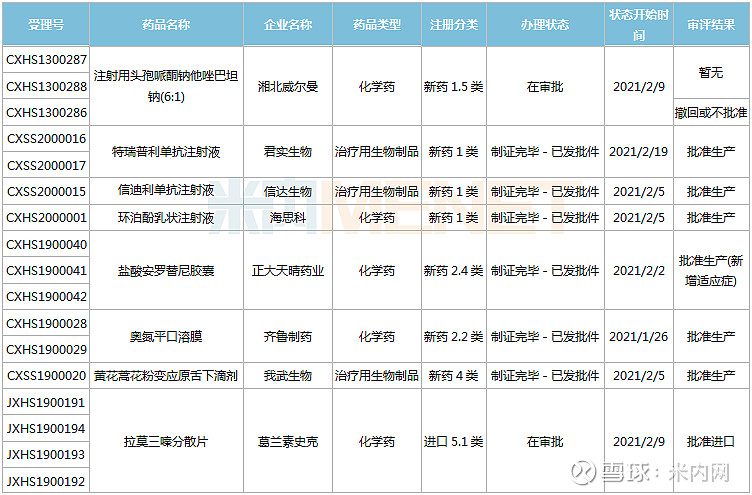
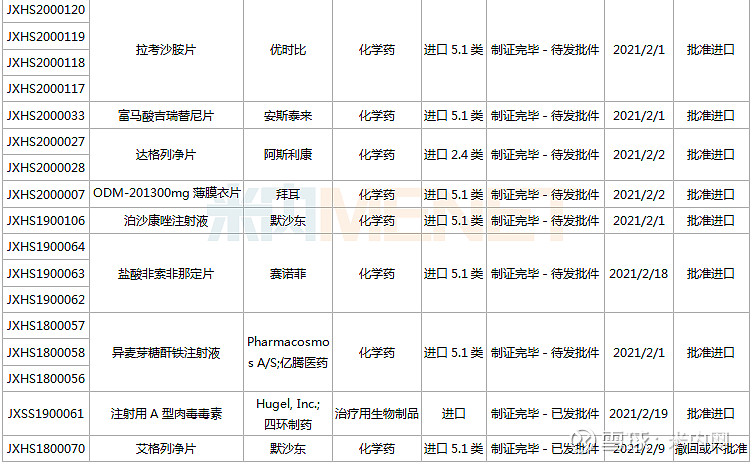
君实生物的特瑞普利单抗注射液新增适应症,成为国内首款获批鼻咽癌适应症的PD-1 。特瑞普利单抗是国内上市的首款国产PD-1,目前已在全球开展了覆盖十多个瘤种的三十多项临床试验。
百奥泰的阿达木单抗注射液是一种靶向TNF-α的全人源单克隆抗体,是国内获批的首款阿达木单抗生物类似药(原研产品2020年全球销售额接近200亿美元),此次为新适应症获批(第6个适应症),用于治疗儿童斑块状银屑病。
富马酸吉瑞替尼片是安斯泰来开发的一款FMS样酪氨酸激酶3(FLT3)抑制剂,于2018年11月在美国获批上市,是FDA批准的首款单药治疗复发或对初始治疗无反应的具有FLT3突变急性髓细胞白血病(AML)患者的药物。在国内,吉瑞替尼被列入国家第三批临床急需境外新药名单,从2020年4月申请上市到如今获批,用时不到10个月。
22个新药申请上市,东阳光药进攻60亿大品种
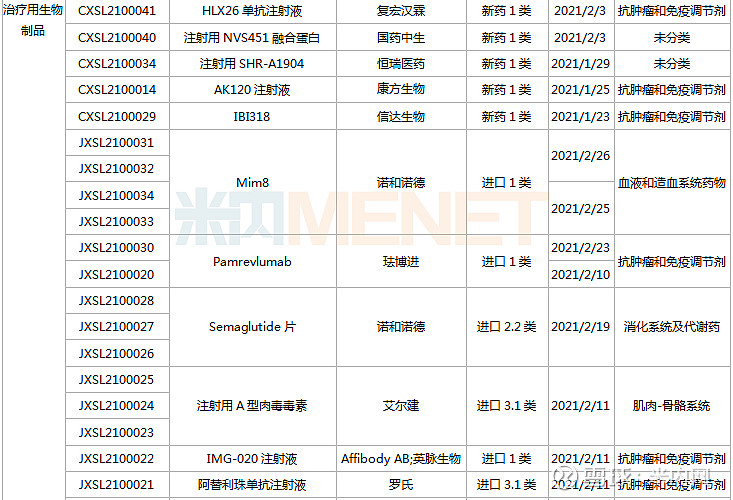
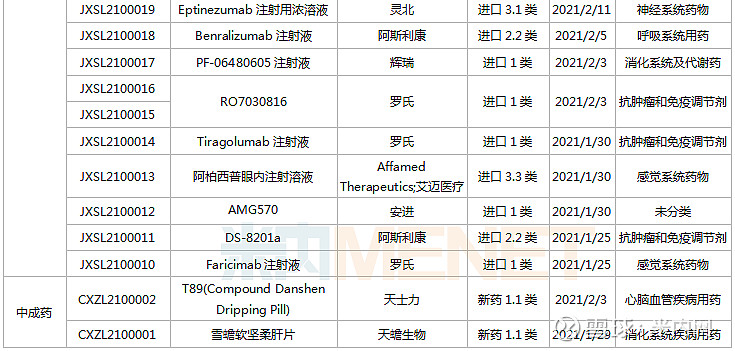
1月23日-2月26日期间,22个新药(38个受理号)上市申请获得CDE承办。10个品种(16个受理号)为国产新药,12个品种(22个受理号)为进口新药。从药品类型看,13个品种(21个受理号)为化学药,8个品种(14个受理号)为治疗用生物制品,1个品种(3个受理号)为中成药。
(1.23-2.26)获承办的国产/进口新药上市申请
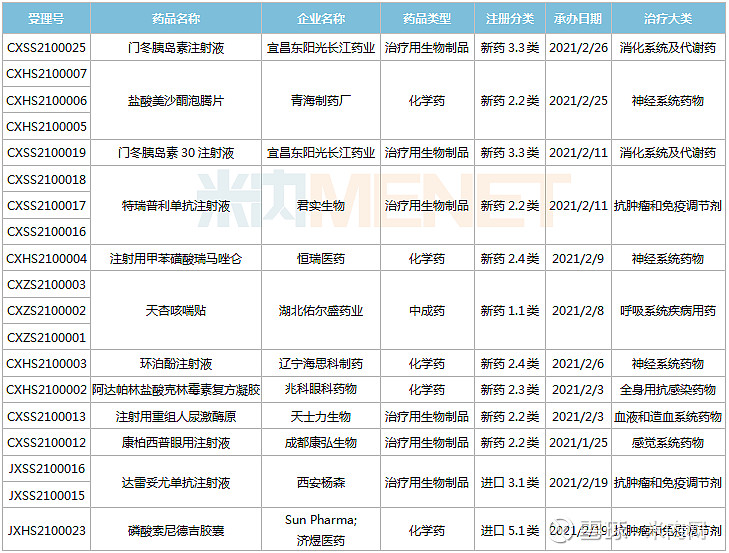
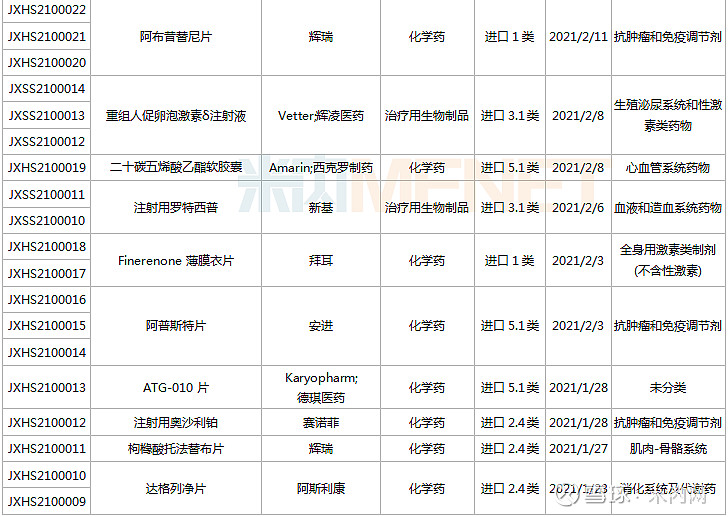
东阳光药2款胰岛素申请上市,其中门冬胰岛素30注射液是由诺和诺德开发的一款预混胰岛素,在改善血糖控制、减少低血糖风险、提高依从性以及节约医疗成本等方面优势明显。目前国内仅诺和诺德、甘李药业拥有门冬胰岛素30注射液生产批文,米内网数据显示,该产品在2019年中国公立医疗机构及中国城市城市药店终端合计销售额约60亿元。
新基首次提交进口上市申请的注射用罗特西普是一款全球首创的红细胞成熟剂,用于需要定期输注红细胞(RBC)的成人β-地中海贫血患者。该新药未在中国境内进行临床试验而直接利用境外临床数据申报上市,获批速度有望大大提升。
ATG-010片是同类首款且唯一一款口服型选择性核输出抑制剂(SINE)化合物,由Karyopharm研发,已有多个适应症获得FDA批准上市,包括复发性多发性骨髓瘤、复发性弥漫性大B细胞淋巴瘤等,德琪医药拥有多个亚太市场的独家开发和商业化权利,此次为首次在国内提交上市申请。
阿普斯特是由新基开发的一款小分子磷酸二酯酶4(PDE-4)抑制剂,安进于2019年8月以134亿美元获得该新药在全球的开发权益。米内网数据显示,阿普斯特2020年全球销售额为21.95亿美元。在国内,该产品被纳入《第一批临床急需境外新药》名单。
98个新药获批临床,正大天晴、科伦、复星......
1月23日-2月26日期间,98个新药(163个受理号)获得临床试验默示许可,其中64个品种(107个受理号)为国产新药(50个为1类新药),34个品种(56个受理号)为进口新药;从药品类型看,化学药有51个、治疗用生物制品有43个、中成药有4个。
(1.23-2.26)获批临床的国产/进口新药
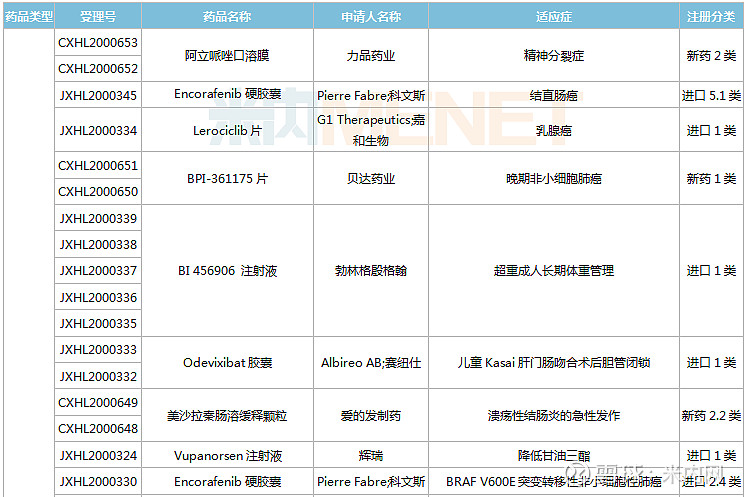
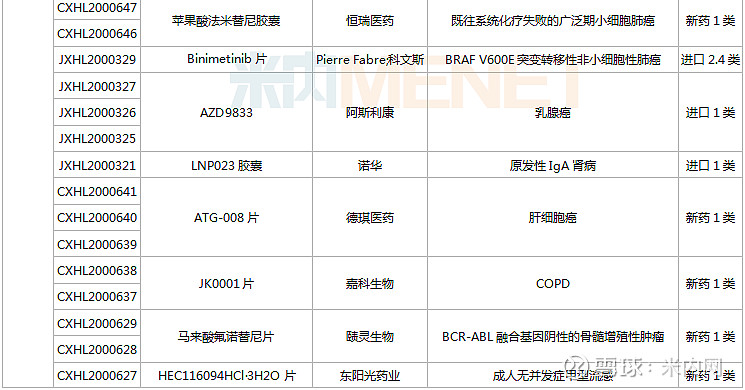

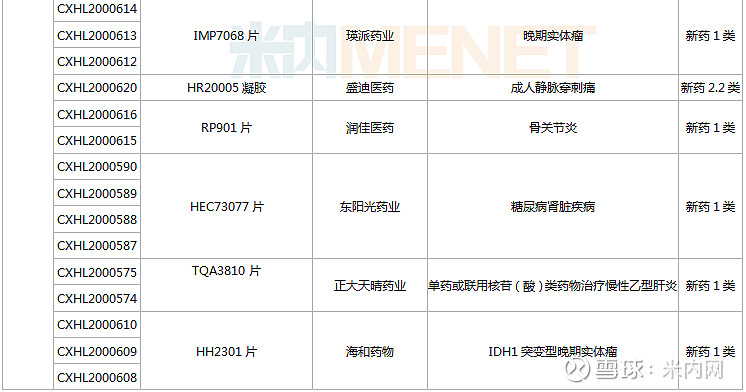

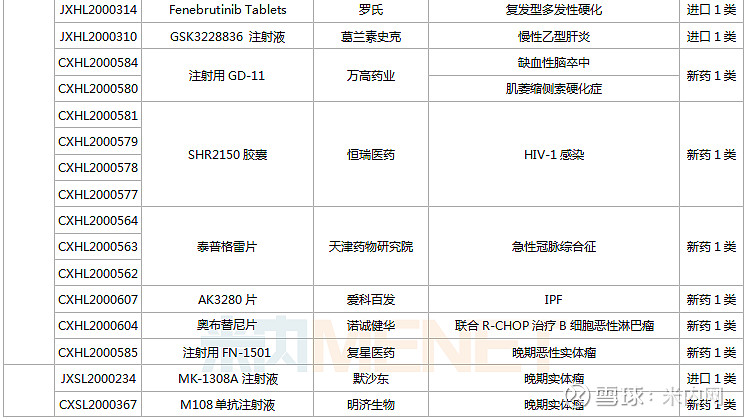


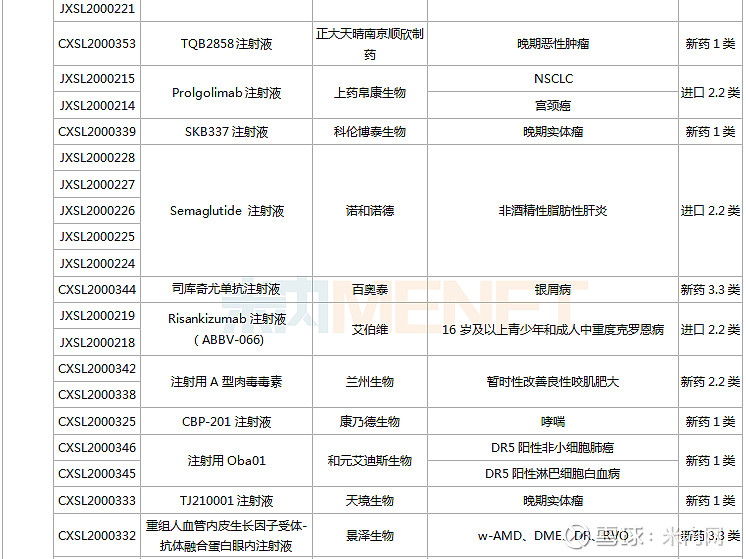
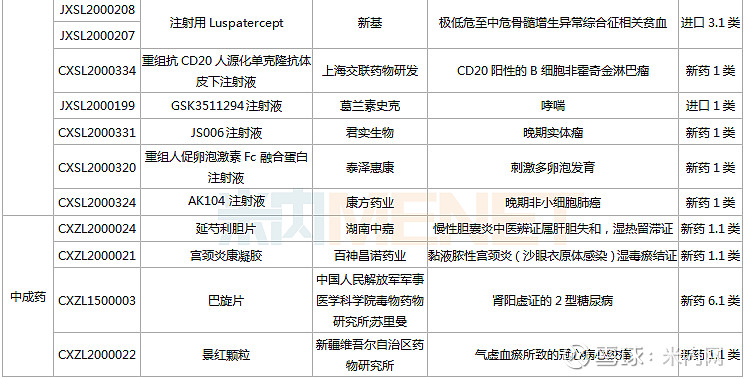
东阳光药、正大天晴各有2款1类新药首次获批临床。东阳光药的HEC116094HCl·3H2O片为甲型流感创新药,可与公司拳头产品奥司他韦形成协同效应,HEC73077片用于治疗糖尿病肾脏疾病;正大天晴的TQB2858注射液为抗肿瘤生物新药,TQA3810片用于治疗乙肝。
JS006注射液是君实自主研发的特异性抗TIGIT单克隆抗体注射液,可特异性阻断TIGIT-PVR抑制通路,刺激杀伤性免疫细胞活化,分泌肿瘤杀伤性因子,目前国内外尚无同类靶点产品获批上市。
SHR-1701注射液是恒瑞自主研发并具有知识产权的抗PD-L1/TGF-βRII双功能融合蛋白,国内外尚无同类靶点产品获批上市。目前恒瑞启动了7项SHR-1701相关的临床研究,其中头颈部鳞状细胞癌、非小细胞肺癌等已进入II期临床阶段。
辉瑞的Vupanorsen注射液首次在国内获批临床,这是一款靶向肝脏血管生成素样蛋白3(ANGPTL3)的RNAi药物,用于降低心血管疾病风险和严重高甘油三酯血症。辉瑞于2019年以最高15.5亿美元(首付款+里程碑付款)自Akcea和Ionis公司获得了该药的全球独家许可权益。
科伦的SKB337注射液属于肿瘤免疫检查点新一代双特异抗体,采用对称性的IgG1κ-scFv,将双靶点结合区域设计在抗体的两端,避免设计在同侧可能导致的空间位阻。该创新药选择的靶点组合能同时作用于肿瘤细胞和效应T细胞,发挥肿瘤免疫生物学效应,激活T细胞杀伤功能,并具备富集T细胞到肿瘤细胞周围的潜力。
AZD9833是阿斯利康研发的一款口服雌激素受体拮抗剂(SERD),目前在全球范围内处于III期临床阶段,用于ER阳性HER2阴性的乳腺癌患者,此次为首次在国内获批临床。
甘李药业自主研发的GLR2007是一种细胞周期蛋白依赖性激酶4/6(CDK4/6)抑制剂,拟用于治疗含脑胶质瘤在内的多种晚期实体肿瘤。1月29日,FDA已授予其快速通道审评资格认定,用于治疗胶质母细胞瘤。
首次在国内获批临床的MAX-10181片是再极医药研发的一款口服PD-L1抑制剂,用于晚期实体瘤,此前已在澳洲启动I期临床试验。据悉,除MAX-10181外,国内在研的口服PD-L1抑制剂还有天津红日药业的艾姆地芬,目前已启动临床。
Selitrectinib口服混悬液用粉末是拜耳/Loxo Oncology合作研发的一款第二代TRK抑制剂,用于神经营养受体酪氨酸激酶(NTRK)融合的成人和儿童肿瘤。TRK抑制剂属于广谱抗癌药,针对特定基因突变而非特定癌种,全球已有2款同靶点药物获批上市,暂未获批进入国内市场。
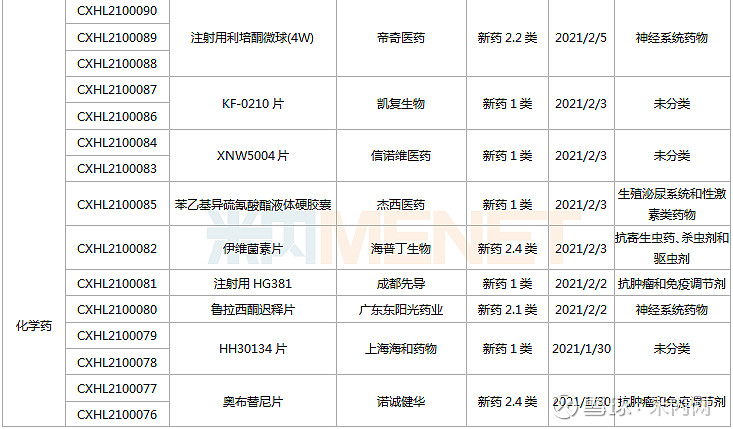
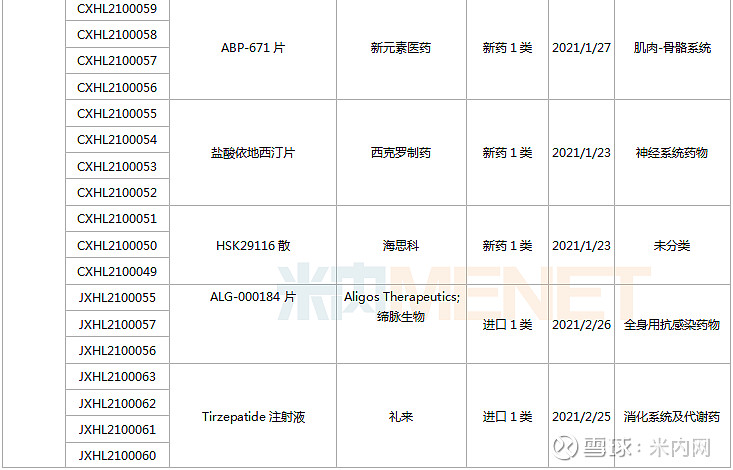
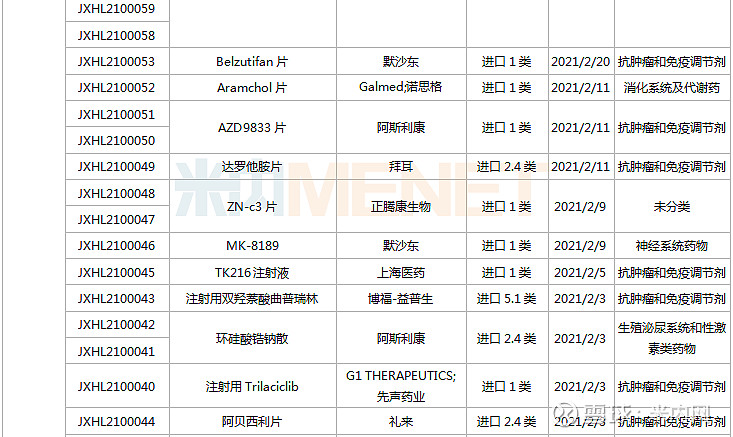
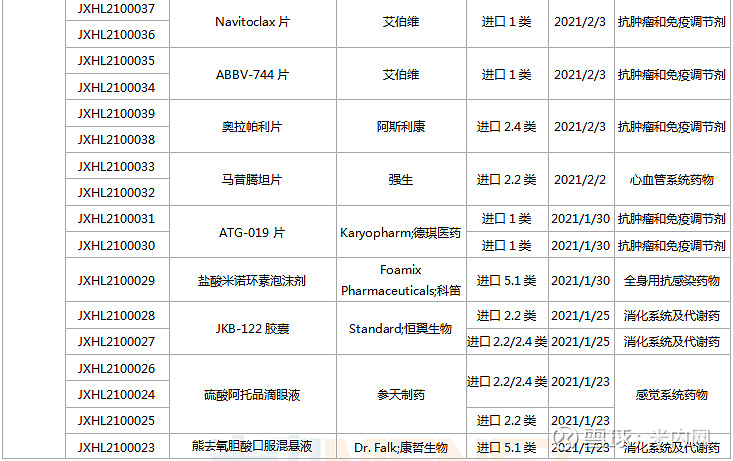
1月23日-2月26日期间,113个新药(197个受理号)的临床申请获CDE承办受理,其中76个品种(132个受理号)为国产新药(60个为1类新药),37个品种(64个受理号)为进口新药。从药物类型看,化学药、治疗用生物制品、中成药分别有66个、45个、2个。
(1.23-2.26)承办的国产/进口新药临床申请
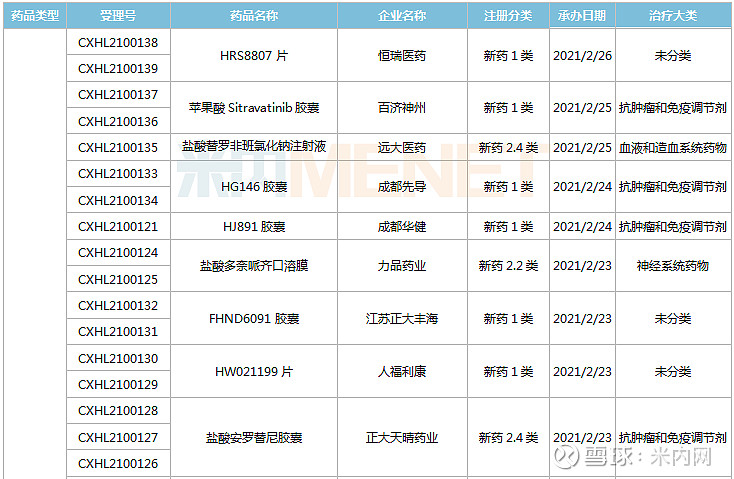

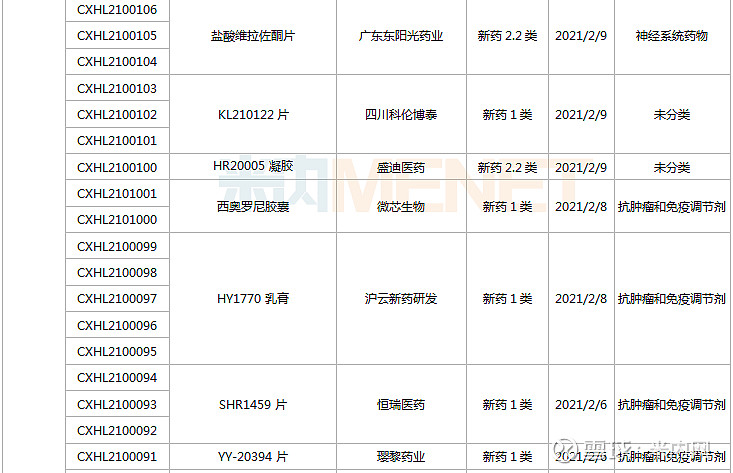



君实生物的JS201注射液是一款PD-1/TGFβ双特异性抗体,可同时抑制PD-1和TGFβ通路较之单药疗法可增强T细胞激活,疗效更佳且安全性可控,目前国内暂无其他企业开发该双抗靶点相关药物。
恒瑞医药的注射用SHR-A1904、HRS8807片首次递交临床申请,两款均为化学药1类新药,其中注射用SHR-A1904是公司申报的第四款ADC类药物。
百奥泰的BAT6026注射液是一款采用ADCC增强的OX40靶向单抗,目前全球已有多家企业开发靶向OX40的抗体药(暂无ADCC增强),进度最为领先的是辉瑞的PF-04518600,已进入II期临床试验。
数据来源:米内网数据库、CDE、公司公告
注:数据统计时间段为1月23日-2月26日,按药品名称统计(不含预防用生物制品、体外诊断试剂等,不含补充申请),如有疏漏,欢迎指正!