精彩内容
作为国内领先的综合型制药企业,石药集团积极转型创新药研发与开拓海外市场,不断推进国内外新药临床试验。在国内,石药集团1类新药恩必普年销超50亿元,在研新药一半以上为抗肿瘤药,25个为1类及1.1类新药,最快开展至III期临床;在海外,公司拿下中国首个获得FDA完全批准的创新药,ADC药物、双特异性抗体、first-in-class人源化单抗等创新药获批临床,5个新药获得孤儿药资格认定,此外23个ANDA已在美国获批。
在研项目300余项,未来3年预计上市新品50余个
图:石药集团研发费用(单位:亿元)

石药集团年报数据显示,近几年来公司研发费用逐年增加,年增长率均在20%以上,研发费用占成药业务收入的比重逐年上升。2020年第一季度研发费用达5.68亿元,同比增长23.2%,占成药业务收入比重为11.3%。
公司在中国及海外设立四大研发中心,拥有十大核心技术平台,研发团队1800余人。在研项目300余项,其中小分子创新药40余项、大分子创新药50余项,新型制剂20余项,主要聚焦在肿瘤、自身免疫、精神神经、消化和代谢、心脑血管系统及抗感染等治疗领域。
目前石药集团有39个产品正在开展临床试验(包括28个创新药及11个新型制剂),7个产品正在进行生物等效试验。公司表示,未来三年预计将上市新产品50余个,其中市场空间超过10亿元的重磅品种将不少于15个。
国内:猛攻抗肿瘤药,25个1类新药在研
恩必普(丁苯酞系列产品)是用于治疗急性缺血性脑卒中的1类新药,2019年在中国城市公立医院、县级公立医院、城市社区中心以及乡镇卫生院(简称中国公立医疗机构)终端销售额超过50亿元。
表1:石药集团(含子公司)在研新药
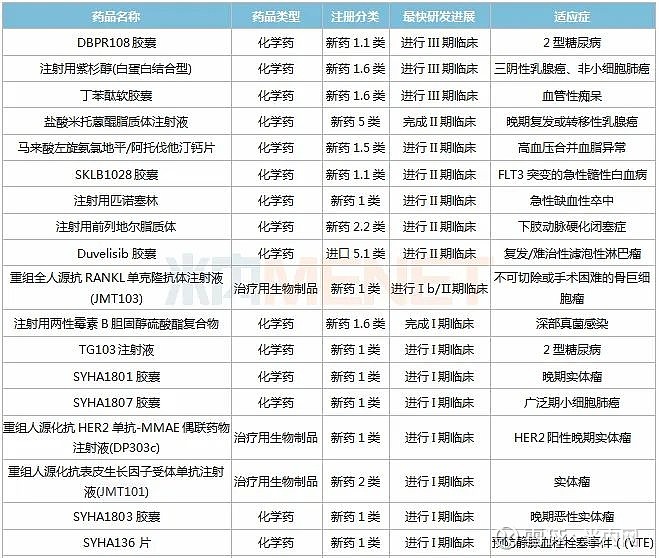

米内网数据显示,石药集团国内在研新药涵盖抗肿瘤、抗感染、消化及代谢系统、呼吸系统、心血管系统等治疗领域,其中抗肿瘤药占据一半以上的比例,可见临床急需的危重症用药是公司重点布局的方向;从注册分类看,25个为1类及1.1类新药,6个为2类新药。
抗肿瘤领域,SKLB1028是一种新型多靶点蛋白激酶抑制剂,分子结构全新,为特殊审评及重大专项品种,FLT3突变的急性髓性白血病适应症正在开展II期临床,全球尚无FLT3靶点药物上市;SYHA1801、SYHA1807、SYHA1803均为新型小分子激酶抑制剂,全球尚无同类产品上市,目前均在国内开展I期临床;M701、M802均为双特异性抗体药物,目前均在国内开展I期临床;米托蒽醌脂质体、紫杉醇阳离子脂质体、长春瑞滨脂质体、表柔比星脂质体均为脂质体品种,与传统剂型相比,可显著降低毒副作用及提高疗效。
消化系统及代谢领域,DPP-4抑制剂DBPR108研发进展最快,2型糖尿病适应症正在进行III期临床;另一款2型糖尿病药物TG103是公司从天境生物引进的创新型重组人源胰高血糖素样肽-1(hGLP-1)Fc融合蛋白,目前在国内开展I期临床;SYHA1805是一种新型小分子激酶抑制剂,目前全球尚无同类产品上市,非酒精性脂肪性肝炎(NASH)适应症已获批临床。
呼吸系统领域,重组抗IgE单克隆抗体为全球首个哮喘靶向治疗药物奥马珠单抗的生物类似药,诺华与罗氏的原研产品2019年全球合计销售额超过30亿美元;CSPCHA115是一种高选择性和强效的前列腺素D2受体拮抗剂,可阻断IL-4、IL-5、IL-13等白介素,哮喘和变应性鼻炎适应症已在国内开展I期临床。
心脑血管领域,SYHA136为新型口服抗凝药物,预防静脉血栓栓塞事件的适应症已在国内进行I期临床试验;1类新药匹诺塞林用于治疗急性脑卒中,目前正在国内开展II期临床;丁苯酞新适应症-血管性痴呆的临床实验已进行到III期;马来酸左旋氨氯地平/阿托伐他汀钙是复方制剂,马来酸左旋氨氯地平为二氢吡啶类钙通道阻滞药,阿托伐他汀钙为他汀类降血脂药,两者合用可治疗高血压合并血脂异常。
抗感染领域,Q101-聚乙二醇重组人干扰素α2a是由40KDa的Y-PEG-NH2和重组人干扰素α2a通过稳定的共价键连接而成的特异性定点修饰的聚乙二醇重組人干擾素-α2a,可单药或联合用药治疗乙肝,也可与利巴韦林联用治疗丙肝;RMX2001是公司与海和生物联合开发的第二代恶唑烷酮类似物的新型抗生素,对革兰氏阳性菌有很强的体外体内活性,结核适应症已在国内开展I期临床。
神经系统领域,阿姆西汀是结构全新、作用靶标明确(5-HT/NE双重再摄取抑制剂)的手性化合物,与度洛西汀相比具有抗抑郁活性强、起效快,肝脏毒性和胃肠道不良反应低等优点。
国外:首个创新药获批上市,拿下23个ANDA
作为国内领先的综合型制药企业,石药集团在医药行业洗牌整合之际,积极转型创新药研发与开拓海外市场。在美国和澳大利亚的新药临床试验不断推进,马来酸左旋氨氯地平片成为首个获得FDA完全批准的中国本土创新药,该产品于2003年在国内获批上市,2019年中国公立医疗机构终端马来酸左旋氨氯地平片及分散片合计销售额超过10亿元。
2019年3月,石药集团向FDA提交玄宁(马来酸左旋氨氯地平片)的新药上市申请,成为我国首家向FDA提交NDA的医药企业;2019年12月,玄宁获得FDA批准上市,用于治疗高血压,成为中国首个获得FDA完全批准的创新药。
表2:石药集团在海外获批临床的部分新药
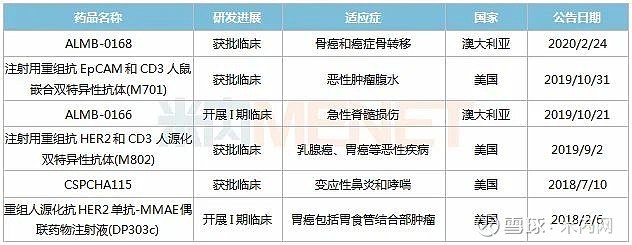
石药集团海外在研新药中,丁苯酞(肌萎缩侧索硬化症)、DP303c(胃癌)、ALMB-0166(急性脊髓损伤)、ALMB-0168(骨癌)、米托蒽醌脂质体(外周T细胞淋巴瘤)5个产品均获得FDA颁发孤儿药的资格认定并展开新药临床试验。
DP303c是石药集团自主研发的由一个对HER2有高度选择性的抗体和一个细胞毒素偶联而成的抗体偶联药物(ADC),是治疗HER2阳性胃癌的新型靶向药物。2018年2月,该产品获得FDA颁发的孤儿药资格,目前在美国开展I期临床。
ALMB-0166、ALMB-0168均为first-in-class人源化单克隆抗体,靶点为半通道膜蛋白Connexin43(Cx43)。ALMB-0166拟用于治疗急性脊髓损伤,缺血性中风及其它多种临床急需的神经性疾病。该产品于2018年获得FDA颁发的孤儿药资格,2019年10月获批在澳大利亚进行首次人体临床试验;ALMB-0168能通过激活Cx43蛋白释放抑癌性物质而起到治疗骨癌和癌症骨转移的作用,2019年该产品先后获得FDA颁发的孤儿药资格和罕见儿童疾病资格,2020年2月在澳大利亚获准开展临床试验。
M701、M802均为双克隆抗体药物,其中M701可同时靶向EpCAM及CD3,目前已在美国获批开展恶性肿瘤腹水的临床研究;M802可同时靶向HER2和CD3,拟用于治疗乳腺癌、胃癌等恶性疾病,目前已在美国获批开展临床研究。
此外,丁苯酞软胶囊在美国已启动II期临床试验;伊立替康脂质体、盐酸米托蒽醌脂质体等新型制剂也已在美国开展临床试验;奥马珠单抗生物类似药(SYN008)已在澳大利亚完成生物等效研究。
表3:石药集团ANDA获批情况

除了创新药,石药集团在ANDA上也收获颇丰,目前公司已有23个ANDA文号获得FDA批准,涉及21个品种(以药品名称计),此外还有甲磺酸伊马替尼片、埃索美拉唑镁胶囊、帕利哌酮缓释片等多个ANDA待获批。
来源:米内网数据库、上市公司公告
注:数据统计截至7月17日,如有疏漏,欢迎指正!
本文为原创稿件,转载请注明来源和作者,否则将追究侵权责任。
投稿及报料请发邮件到495903287@qq.com
稿件要求详询米内微信首页菜单栏
商务及内容合作可联系QQ:412539092
米内精选
惊呆了,两周103个新药报临床
华海、华东、信立泰......25个新药获批临床
东阳光药25个1类新药、6大生物药来袭
齐鲁、豪森......26个新药获批临床
东阳光药首个降糖新药上市在即