德琪下一程:塞利尼索多地上市,自研管线是未来主导| 第一现场

近日,德琪医药(以下简称德琪)在上海举办的首届研发日上介绍了公司的管线布局和未来规划。刚刚成立四年的德琪,已经登陆港交所一周年,初始被业内认知,是其通过引入合作快速建立起丰富新颖的管线,并推动入后期临床研究。
而在公司首款产品进入商业化阶段时,其自研管线也初具规模,以临床作为切入点,向商业化和早期研发的双向延伸,逐渐勾勒出公司完整的研发图景。
从塞利尼索上市看临床策略
德琪目前进展最快的产品塞利尼索已于今年8月在韩国正式获批上市。截至目前,塞利尼索在中国大陆、中国香港、中国台湾、澳大利亚、新加坡等多个亚太市场均递交了新药上市申请(NDA),并获得国家药品监督管理局(NMPA)授予的优先审评资格,预计将于2021年第四季度至2022年第一季度在多个国家和地区市场获批上市。
XPO1抑制剂塞利尼索由德琪与Karyopharm公司合作开发,德琪拥有其在中国和亚洲多地的开发和商业化权利。该药已在美国获批上市3个治疗方案,是首个也是唯一一个获FDA批准的核输出抑制剂(SINE),3个治疗方案分别为联合地塞米松治疗复发/难治多发性骨髓瘤(R/R MM),联合硼替佐米、地塞米松治疗复发/难治多发性骨髓瘤,单药治疗复发/难治弥漫性大B细胞淋巴瘤(R/R DLBCL)。
事实上,有丰富临床开发经验的德琪团队在该产品美国上市过程发挥了重要的助力作用。
2019年2月,塞利尼索最早向FDA申报上市时,递交的是II期临床研究数据,当时FDA以8票对5票的投票结果,要求看到III期临床试验数据,才考虑是否批准。在这个阶段,塞利尼索开展的III期临床试验在中期分析已经体现出阳性的结果。在德琪团队的建议下,Karyopharm很快向FDA递交中期数据以寻求批准。最后,FDA接受了中期数据,在2019年7月批准了塞利尼索上市。2020年初,III期临床试验结果全部揭盲,在积极的临床结果支持下,很快从获批的5线治疗提到了2线治疗。
而塞利尼索在中国的开发中,共开展了10项临床研究,针对不同适应症也有不同的策略。
已经获批的R/R MM和R/R DLBCL这两个适应症上,德琪启动了3项桥接性临床——MARCH、SEARCH和BENCH研究。另有3项临床研究是与Karyopharm 公司联合开展的全球性研究,保持了跟国际一致的步调,包括治疗晚期或复发性子宫内膜癌的III期临床研究(SIENDO),联合 R-GDP治疗接受过1~2种既往治疗的 R/R DLBCL的II/III期研究;治疗骨髓纤维化(MF)的II期临床试验。
尤为值得注意的是,德琪考虑到亚太区未满足的医疗需求开展了4项独特研究。其中,针对亚洲高发的复发难治性外周T细胞淋巴瘤和NK细胞淋巴瘤开展了TOUCH研究,在今年的ASH大会上,公布了这项研究的结果,联合 Gemox 方案治疗组的ORR达到 52.9% (9/17),CR达到35.3%(6/17)。另外,还有两项联合用药研究,分别为联合ATG-008治疗 R/R DLBCL的MATCH研究;联合来那度胺和利妥昔单抗治疗R/R DLBCL和惰性淋巴瘤的SWATCH研究。
德琪医药创始人、董事长、首席执行官梅建明博士在接受研发客专访时表示,由于每一个产品都有自己的特点,临床开发策略没有通用的模式,重要的是抓住临床需求、患者急需,以及药监机构基于风险和疗效比而作出什么样的审评决定。
自主研发成为未来主导
在这次研发日活动上,德琪披露了2款全新自主研发产品——ATG-041、ATG-032。
ATG-041是靶向Axl和Mer的双重小分子抑制剂,具有肿瘤特异性杀伤和免疫微环境调节双重功能;ATG-032则是一类靶向LILRB蛋白家族的单抗,LILRB是巨噬细胞表达的一类免疫检查点蛋白。
实际上,德琪的研发策略一直是“自主开发+合作引进”。目前德琪在自主开发部分,进展并不慢,并形成了一定的管线规模。
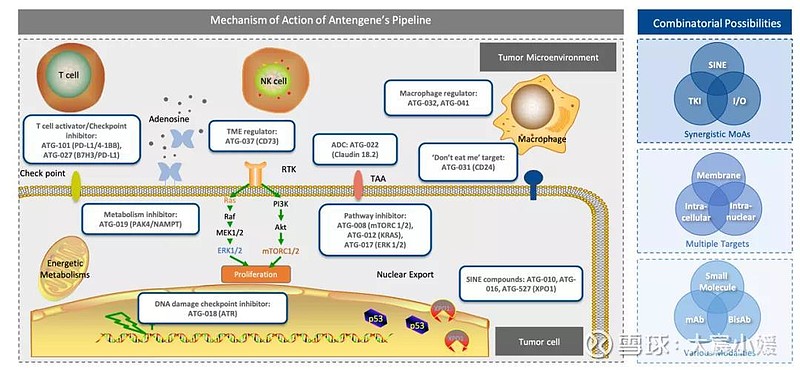
目前,德琪管线中有15款产品,其中8款为自主研发产品。除了最新披露两款,还有PD-L1/4-1BB双抗ATG-101、ATR抑制剂ATG-018、Claudin 18.2 ADC产品ATG-022、KRAS抑制剂ATG-012、CD24单抗ATG-031、B7H3/PD-L1双抗ATG-027。
梅建明告诉研发客,德琪以临床需求作为切入点,通过引进的方式做了一些商业布局,同时很早就启动了早期研发工作。实验室开发产品的周期通常是3~4年,正好在这个阶段,这些初始的研发成果开始展示出来。
“我们有自主研发的能力,并不是license in的模式。过去三年虽然以引进为主导,相信未来三到五年,更多的产品会由我们自己实验室研发出来。”
梅建明同时强调,德琪也会继续开展研发和商业合作。今年已有两项合作,包括与韩国LegoChem合作开发ADC产品。后续会特别关注血液肿瘤领域,因为已布局亚太血液肿瘤的商业团队,希望引进的临床阶段产品能够利用已有的经验和能力,让商业化的布局更丰满一些。但这只会成为德琪自主研发之外的一种辅助。
在自主管线开发上,德琪主要关注在靶点新颖度、成药性、疾病相关性、未满足的临床需求以及靶点之间协同性。这一逻辑其实代表了整个管线的构建思路。
梅建明表示,德琪的管线开发不会拘泥于某一个特定技术平台,重要的是靶点能够解决什么样的临床问题,在产品比较丰富的情况下,怎么样通过协同性进行联用的尝试。从德琪已有的管线可以看到,其开发的分子类型覆盖了小分子、单抗、双抗、ADC,也包括很多不同通路和机理,如T细胞激活的PDL1/4-1BB双抗、针对肿瘤微循环的CD73抑制剂,靶向传统通道的mTOC、RAS、ATR、PAK4/NMAPT、ERK1/2抑制剂等。这都能形成很好的协同性,提供多样的联合潜力。
其中,小分子和大分子联用是德琪关注的一大方向,因为小分子具有更好的细胞和肿瘤微循环穿透性,可能带来给药方便、抑制肿瘤不同通路的独特优势。另外一个重要的思路是激活T细胞同时解除免疫检查点的抑制作用,这体现在两个双抗产品的开发中(一款靶向B7H3/PD-L1,一款靶向PD-L1/4-1BB)。
管线产品靶点分布
重点推动具有免疫联合潜力项目
丰富管线之下,对于下一步重点推动的产品也会有所偏重。据了解,ATG-101、ATG-037、 ATG-017等几款产品会是德琪未来重要的着眼点。
ATG-101针对转移性或晚期实体瘤及B细胞非霍奇金淋巴瘤(B-NHL)的I期临床的IND今年先后在澳大利亚和美国获得批准。德琪与Calithera Biosciences合作,获得了CD73抑制剂ATG-037全球开发与商业化的独家授权。相较该靶点领域其他小分子抑制剂和抗体药物,ATG-037显示出更高的活性,计划在年底前启动产品的IND工作。ATG-017为ERK 1 / 2抑制剂,这个靶点领域还没有上市药物,目前正在澳大利亚开展I期临床研究。
据梅建明介绍,这几款产品都有自己的特点,非常重要的共同之处在于,都可以应用于现有PD-1/L1单抗疗效不好,或曾经有效但后续复发的患者中。ATG-017和ATG-037也均有联用免疫检查点抑制剂的潜力。
这样的特点带来了快速临床转化的可能。这几款产品很可能不需要开展III期临床,通过II期临床就可以递交NDA申请上市。
值得留意的是,德琪管线中有10款产品具有全球权益。公司在立足中国市场的基础上,也在追求国际上的竞争力。因此,后续推进很多项目都在澳大利亚、美国等地开展了临床研究。
目前,德琪一共获得19个临床批件。在其未来计划中,至2025年,将实现2~3款产品商业获批,每年提交2~3项全球范围IND。
开启商业化布局
随着产品逐渐推进到临床后期,尤其塞利尼索在韩国上市并在多地递交NDA,德琪也在加速其商业化方面的布局。
会上,德琪医药首席商务官John Chin先生介绍了德琪医药的商业化策略:只聚焦在拥有最高商业化潜力的市场。根据对未满足医疗需求、医保支付能力以及GDP增长速度三个维度的综合考量,德琪已经选择了6个高潜力市场,分别为中国大陆、中国台湾、中国香港、韩国、新加坡和澳大利亚。
以6个市场为核心的商业化布局中,合作是一个方向。今年8月,德琪与上药控股达成针对塞利尼索的合作。本次合作,上药控股作为德琪医药塞利尼索的国内进口总经销,双方在国内的进口授权、分销业务、供应链服务和创新增值等多个层面开展合作。自建团队是另一方向,德琪已在中国建立了完整的由市场、销售、医学、准入等团队构成的商业化团队。
梅建明表示,与实体瘤不同,很多血液瘤的诊断、治疗方案、疗效评估非常复杂,中国一万多家医院,真正有血液科的只有四、五百家。在骨髓瘤和淋巴瘤中,50%的患者集中在头部的50家医院,德琪的商业团队完全可以覆盖到这些医院。
临床证据、学术要求在产品推广中最为被看重。塞利尼索5项治疗方案已被纳入美国国家综合癌症网络(NCCN)指南,4项治疗方案被纳入中国临床肿瘤协会(CSCO)诊疗指南,2项治疗方案被纳入欧洲肿瘤内科学会(ESMO)指南,这会对未来商业化布局带来很好的推动力和助力。