

本文由医麦客原创,欢迎分享,转载须授权
2019年10月19日/医麦客 eMedClub/--阿斯利康(AstraZeneca)自1973年推出第一个抗肿瘤药物后,不断在科研领域增加投资,陆续开发了数种新型的抗肿瘤药物以及创新治疗方法。
今年4月,该公司与第一三共株式会社(Daiichi Sankyo)就候选药物 Trastuzumab deruxtecan(DS-8201)达成了全球开发和商业化合作协议,并于10月17日宣布FDA接受了双方共同研发的抗体偶联药物(ADC)DS-8201的生物制剂许可申请(BLA),该生物制剂将用于治疗HER2阳性转移性乳腺癌。同时FDA授予这一BLA优先审评资格,预计将在2020年第二季度作出回复。
推荐阅读:阿斯利康69亿美元下注第一三共候选抗体偶联药物丨医麦猛爆料

基石:完善的ADC结构及其作用机制
DS-8201能成功运用于临床,首先基于ADC特有的结构以及它的作用机制。
ADC主要由抗体、连接子和细胞毒性药物构成:其中靶点的选择和抗体的质量决定了ADC对肿瘤细胞的亲和力;连接子的类型决定了药物的稳定性;细胞毒性药物的选择决定了ADC的杀伤力和副作用。
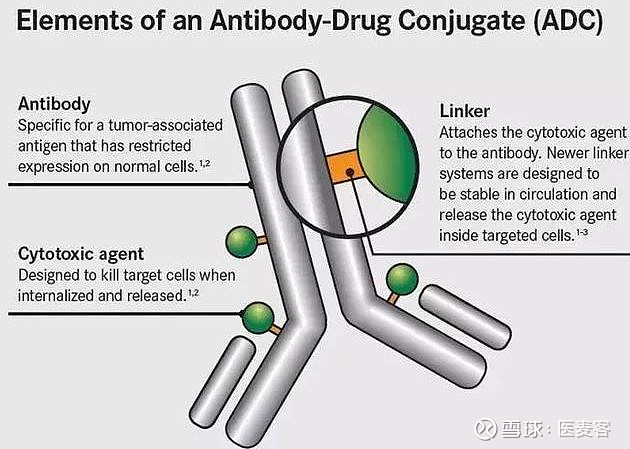
▲ ADC的结构(图片来源: Carter PJ)
这一偶联结构确保了ADC的靶向性,细胞毒性和稳定性,药物通过连接单克隆抗体的接头向癌细胞递送细胞毒性化疗(有效载荷),从而对癌细胞发挥杀伤作用。在理想状态下,药物前体在系统给药时不具有毒性,而当ADC药物中的抗体与表达肿瘤抗原的靶细胞结合、整个ADC药物被肿瘤细胞内吞后,小分子细胞毒素组分将以高效活性形式被足量释放,从而完成对肿瘤细胞的杀伤。
其作用机制如下:ADC与肿瘤细胞表面抗原结合——ADC-抗原复合物endocytosis(胞吞)——lysosomal(溶酶体)降解——细胞毒药物释放——DNA或microtubule(微管)破坏——细胞死亡
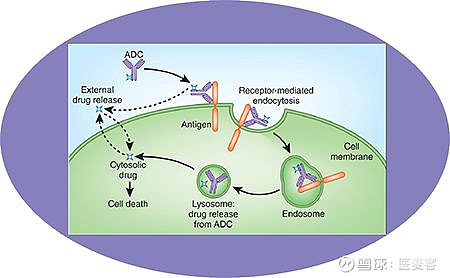
▲ADC的作用机制(图片来源:medicilon.com)

优势:DS-8201的独特设计
鉴于ADC的结构及作用机制,DS-8201使用Daiichi Sankyo专有的DXd ADC技术进行设计,由一种基于四肽的接头与新型拓扑异构酶I抑制剂(DXd)有效载荷连接的人源化HER2抗体组成。与通常进行化学疗法的方式相比,该设计旨在细胞释放时增强对癌细胞的破坏和杀伤力,并减少对细胞毒性有效载荷(或化学疗法)的全身暴露。
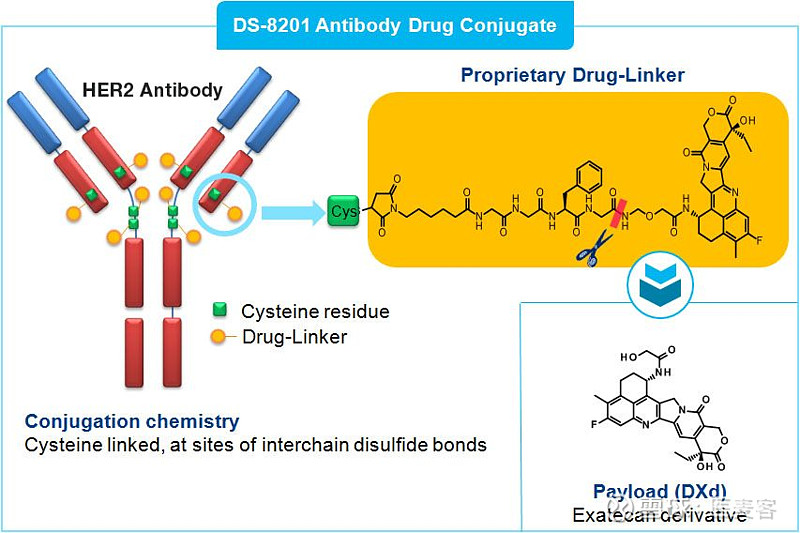
▲DS-8201结构(图片来源:dsi.com)
载药量更高:Daiichi Sankyo开发了独特的linker-payload系统,降低了ADC的疏水性,因此DS-8201的每个抗体可以携带7~8个DXd分子(药物与抗体比率(DAR)),高于T-DM1(Kadcyla)的3~4。
细胞毒药物DXd的疗效更好:当抗体结合HER2内化后,DS-8201的四肽Linker可以被肿瘤细胞中高表达的溶酶体酶降解,从而释放DXd,DXd结合并抑制Top1-DNA复合物,从而抑制DNA复制、细胞周期抑制和肿瘤细胞凋亡。此外,DXd具有较高的膜穿透性,这让它也能够杀伤那些位于表达HER2受体的癌细胞附近,但是本身不表达HER2的癌细胞。

DS-8201 临床试验结果积极
今年4月29日Daiichi Sankyo披露了一项关于DS-8201的I期临床数据结果,其中包括至少使用一剂DS-8201的115名患者,111例可评估。
这些患者此前平均接受过7种疗法,包括曲妥珠、帕妥珠和T-DM1单抗治疗,并发生转移(MBC),推荐扩展剂量为5.4或6.4mg/kg。这些患者的客观缓解率(ORR)达59.5%,疾病控制率(DCR)为93.7%,中位缓解时间(DoR)为20.7个月,中位数无进展生存期(PFS)达22.1个月,并且尚未达到中位总生存期(OS)。
而5月9日,Daiichi Sankyo宣布,DS-8201的关键性II期试验DESTINY-Breast01达到预期结果,该试验分为两部分,评估此前接受过DS-8201的Her2阳性不可切除和转移性乳腺癌患者,试验的主要临床终点为ORR,次要临床终点包括DoR、PFS、OS等,该临床于2018年9月完成入组,并在北美、欧洲、日本、亚洲等地接受了253名患者。计划于即将举行的医学会议上展示DESTINY-Breast01的数据。
此外,数据显示最常见的不良事件(AEs) (≥30%,任何等级)(包括恶心,食欲下降,呕吐,脱发,疲劳,贫血,腹泻和便秘)中,50%的患者发生AE≥3,其中19%的患者出现严重AE,包括两个先前报告的5级治疗相关性肺炎病例。
根据以上I期临床的有效治疗数据,以及积极的II期试验进展结果,证实DS-8201能够有效地治疗HER2阳性转移性乳腺癌。这一结果有利于获得FDA批准DS-8201明年的上市。

ADC研发进展分析
作为现代肿瘤治疗的一种方式,ADC的研发已经成为全球热潮。随着国内外不断地关注,它的发展也发生了一代又一代的变革。以下为ADC变革中的特点和转变:
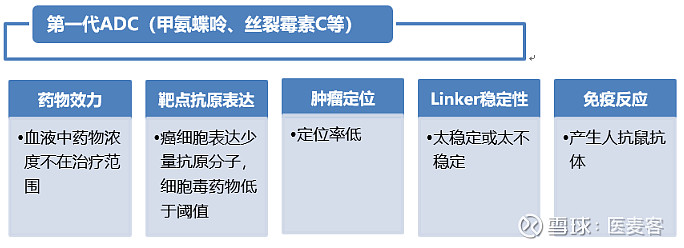
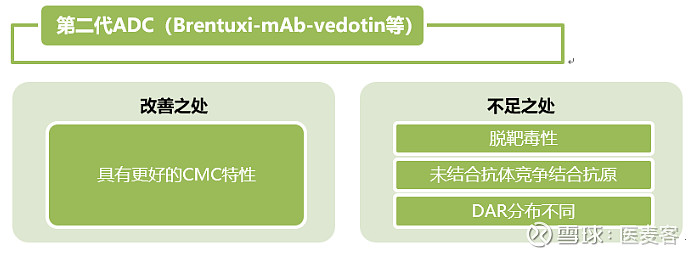

▲ADC的变革(图片来源:抗体圈)
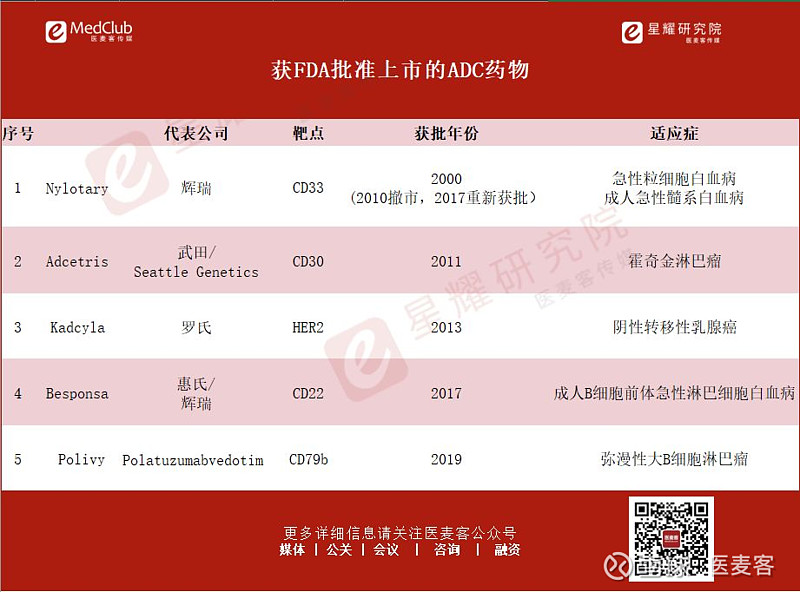
ADC的变革带动着ADC药物的出现。就目前为止,获得FDA审批上市的ADC药物仅此五种:

结语
值得关注的是,如果明年阿斯利康成功获得FDA对DS-8201的上市许可批准,这将是ADC上市的第六种药物。
显而易见,ADC药物研发在替代现有癌症和肿瘤的治疗方法上具有巨大潜力,有望在未来开发中获得更有效和更安全的ADC药物,为患者带来福音。
推荐阅读:新型抗体-药物偶联物ADC治疗胃癌获优先和鼓励政策支持,或可在6-12个月内获得批准丨医麦猛爆料
参考来源:
1.网页链接
2.网页链接
3.网页链接
4.网页链接
5.网页链接

医麦猛爆料
独家猛爆料:全球首例ips角膜移植手术丨全球首个在体CRISPR临床试验丨Zynteglo获欧盟批准丨大突破-Zolgensma获FDA批准 | ASCO | 地西他滨联合PD-1 | 中国最大License-in | 日本CAR-T获批 | 一天制造CAR-T细胞 | CRISPR美国首次人体试验 | TAC疗法横空出世 | 美国CAR-T医保 | 升级版PD-L1/TGF-β双抗 | PD-1:K药、O药、T药、B药、I药 | 中国首个异基因干细胞产品获批 |
星耀研究院
干货大礼包:iPSC文献大礼包丨基因治疗政策丨外泌体神秘礼包丨溶瘤病毒重量级干货丨ADC药物精华资料丨实体瘤CAR-T最新进展丨全球干细胞政策法规丨双特异性抗体大礼包丨2.29G!CAR-T视频大全集丨30家基因治疗公司PPT(一)丨(二)丨54份制造工艺精华资料丨44份细胞治疗政策及管理规范丨30篇CRISPR重要文献丨2019ASCO全资料下载丨19家顶级CAR-T公司PPT(上) | (下) | 20篇肿瘤免疫高引综述 | 40篇细胞/基因治疗人气文献 | 30+篇细分领域深度报告 | 70篇精选诚意大礼包 | 女王专属大礼包 | 硬核CAR-T大礼包 | 硬核肿瘤免疫大礼包 | 基因治疗“锦鲤”大礼包 |
医麦新观察
行业新观察:国内ADC进展丨国内溶瘤病毒公司(上)丨(下)丨干细胞备案丨国内通用CAR-T药企丨通用CAR-T临床进展丨国内外TCR-T公司丨CDMO融资上市 | 溶瘤病毒交易 | 基因治疗-国外 | 基因治疗-国内 | CAR-T新技术 | CAR-T治疗B-ALL | CAR-T治疗B-NHL | 基因工程技术 | BCMA免疫疗法 | CRISPR系统突破技术 | CAR-T工程化功能模块 | 十家专注RNA药企(上) | (下) | 细胞治疗监管法规 |
峰客访谈
产业先行者:尚健生物丨艺妙神州丨君实生物丨非同生物丨苏桥生物丨和元上海丨科望医药丨默克丨复宏汉霖丨恒润达生丨颐昂生物丨科济生物丨贝赛尔特丨斯微生物丨中盛溯源丨昭衍生物丨亦诺微丨澳斯康丨复星凯特丨赛诺生丨解放军总医院丨宜明细胞丨博雅控股 | 邦耀生物 | 赛默飞 | GE医疗 | 博雅辑因 | 岸迈生物 | 科医联创 | 金斯瑞 | 普瑞金 | 恒润达生 |
 点一次瘦一斤
点一次瘦一斤