
春节过后,小柴进行了一系列CXO行业及部分重点公司的深入研究,过程中形成的文章也已陆续发出。今天,就把这段时间关于行业的研究整理成文,以飨读者。全文8500+字,可以收藏起来再读,当个了解该行业的工具贴。文章根据公开信息撰写,仅供交流之用,不构成任何投资建议。(求关注^^ 小柴研究 ^^)
十八世纪末,美国西进运动,人们在萨克拉门托河发现了金砂。一时间,工人、农民、海员和传教士前仆后继。多数人直接淘金,也有少部分人独辟蹊径,贩马、撑船、卖酒、卖水,在淘金者身上淘金。这群人后来被称为“卖水人”。他们虽不像“淘金者”一夜暴富,但却也能在淘金热中稳赚不赔,活得滋润。
今天就给大家系统解码这个医药工业的“卖水人”——CXO。
一、到底啥是CXO?
简单说,CXO就是个接外包的,跟芯片行业的台积电、软件外包产业的印度三哥没啥两样。但相比芯片代工、软件开发外包,CXO又有其独特性。
CXO按照产业链条上下游逻辑,依次细分为:CRO、CDMO/CMO和CSO。
其中,CRO(Contract Research Organization)主要是承接医药产业研究开发、药品注册过程等工作;CMO/CDMO(Contract Development and Manufacturing Organization)主要负责药品生产以及生产工艺的研发升级,CDMO与CMO两者的区别在于“D”,CMO是纯生产代工,没有工艺研发的事儿,技术含量低一些;CSO(Contract Sales Organization)是为客户在销售和市场营销角度提供外包服务,这一细分行业门槛相对较低,本文不做研究。
CRO的出现时间并不长,是医药产业精细化分工的产物。从雏形至今,经历了4个阶段,快速成为医药研发不可或缺的一环。
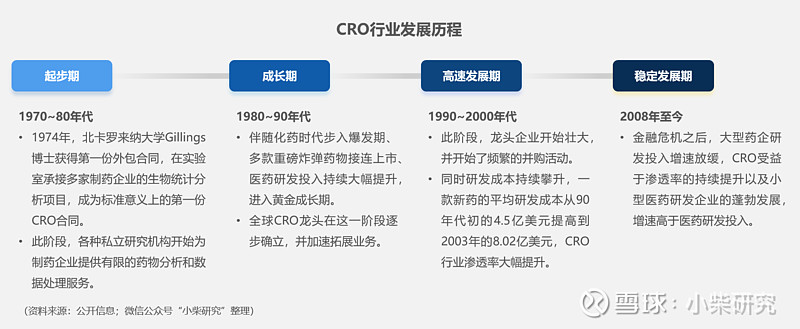
二、CXO的行业地位
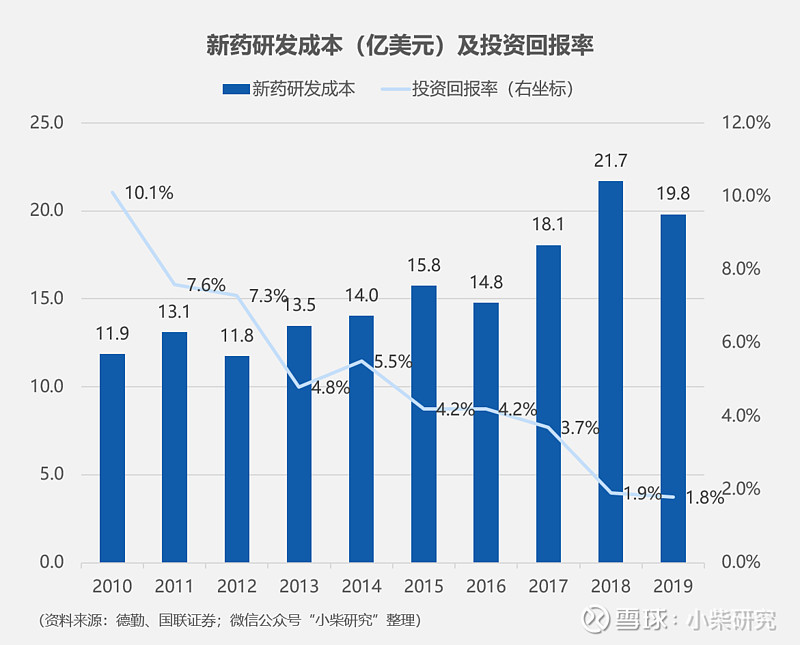
医药产业有一个颇为无奈的“双十定律”:一款新药从研发到上市,平均需要“10年+10亿”的投入,单位是美元。更为沮丧的是,伴随医药工业监管法规越来越严格、可用靶点不断被前人开发,新药研发难度正逐年推高,目前一款新药的研发时间已经快要逼近15年了、研发投入更是接近20亿美元(2019年)。
根据德勤《2019年医药创新回报评价》,2019年一款新药的平均研发成本19.81亿美元,2018年这个数更是高达21.68亿美元。再往回看10年,这个数字也不低,高达11.88亿美元(2010年)。伴随而来的是药企投资回报率的逐年走低,从2010年的10.1%下滑到2019年的1.8%。
以全球医药研发最发达的美国为例,一款新药的专利保护期一般20年,也就是说,过了这个期限,仿制药厂将大面积跟进,药品价格极速下降。而这个专利保护期是从新药专利申请开始的,也就是涵盖了整个医药研发的周期,从发现一款新药,到做出来,到动物试验、人体试验,最后到批准上市。这是一个漫长的过程,一般都需要10~15年的时间。这样算,也就剩下6~7年时间让你原研药厂独家卖,那这段时间你不得收回成本啊?你不得给金主爸爸多赚点儿啊?所以说,原研药企越来越难,也难怪现在Biotech(创业型生物制药企业)如雨后春笋般出现,这点后面展开。
此外,药企面临的第三大难题也非常痛心——研发成功率低得可怜。
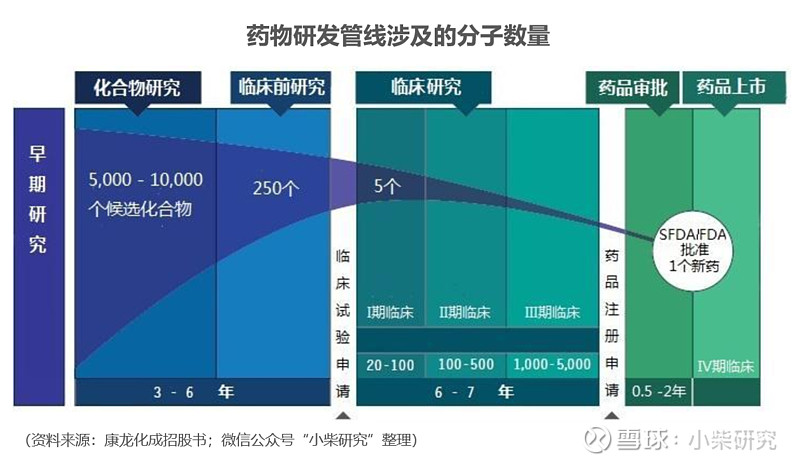
一款新药,研发人员会从5000~10000个候选化合物中筛选出250个左右进行临床前研究,这里面只有5个能够进入临床试验阶段,而最后被FDA批准上市的也就1个。
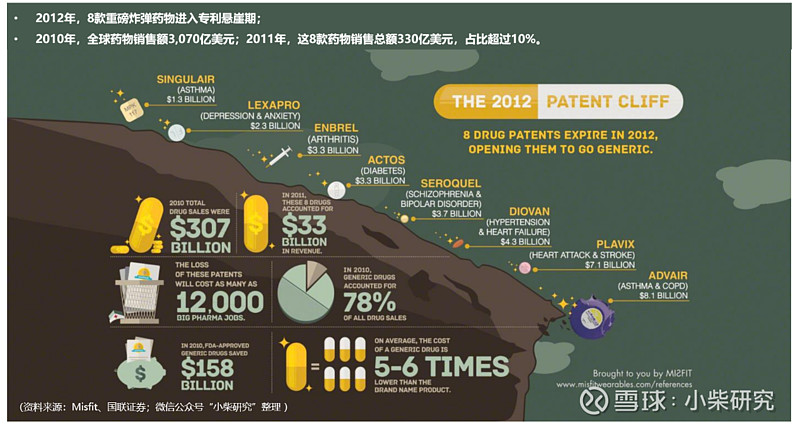
然而,事情还没有结束。研发难度已经如此之高了,药企们的头上还悬着一个达摩克斯之剑——专利悬崖。哈佛商业评论曾经采访诺华集团CEO,他表示:“专利悬崖是我们这个行业最大的难题之一。具体而言,根据艾美仕(IMS Health)预测,从2011~2016年,品牌药品因专利到期导致的销售收入损失将达到1,060亿美元,其中2012和2013年最为严重。举个最明显的例子:历史上最畅销的处方药——辉瑞制药的立普妥(降血脂药)专利于2011年到期,分析师预测到2015年,其年销售额将从2009、2010年的110亿美元下降至30亿美元。大多数制药企业最终都会面临同样的挑战。”
咨询公司Misfit盘点了2012年几大重磅药情况,这8款专利到期重磅炸弹药物年销售收入占全球所有药物销售总额的10%还多,我们透过下图来感受一下专利悬崖的酸爽。
讲到这里,CXO的“人设”也就呼之欲出了。对,它就是带着天使的翅膀来拯救制药企业的。它天生赋有三重使命:降低研发成本、缩短研发周期、分担药企风险。
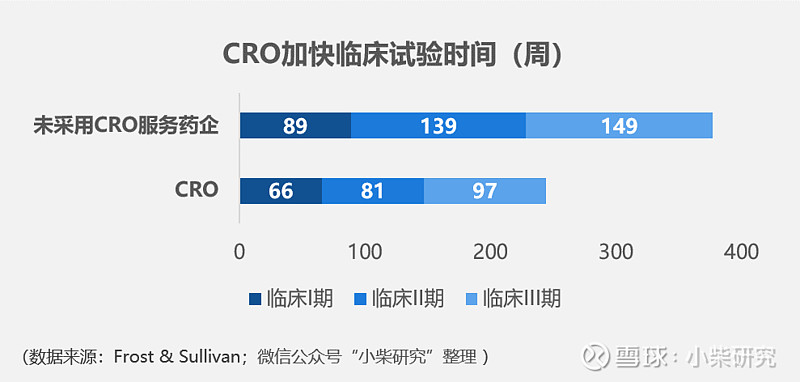
根据Frost & Sullivan数据,CRO服务介入的临床I~III期试验总计时间为244周,相比没有采用CRO服务的传统药企来说(总计368周)可以节省近34%的用时。
三、万亿市场的底气
创新研发是药企构建核心竞争力和持续发展的关键,而药物研发是一项高投入、高技术、高风险、长周期的精细化系统工程。一款新药的平均研发成本已经从2010年的11.9亿美元增长到2018年的21.7亿美元,而研发周期更是需要10~15年的时间。
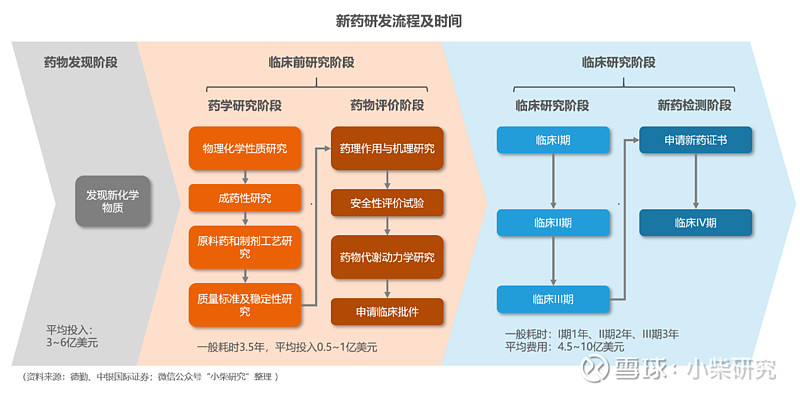
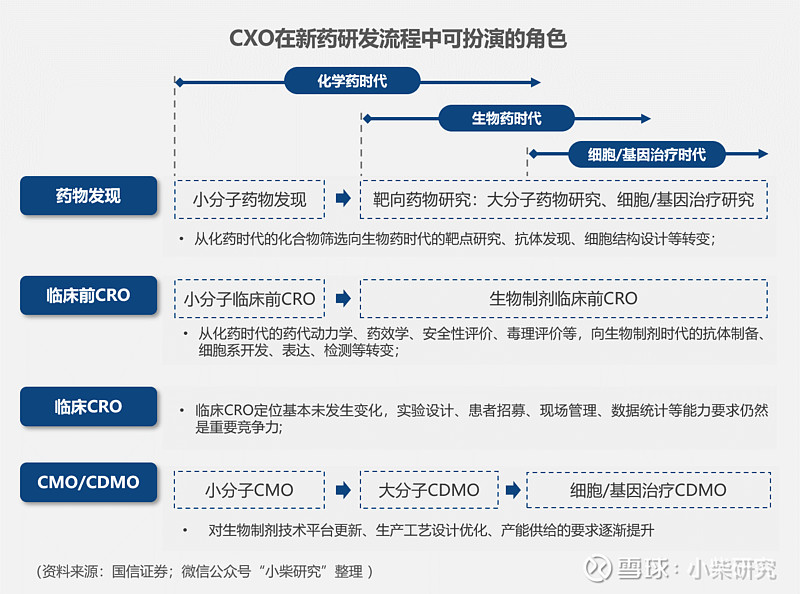
CXO企业所提供的专业研发服务能够有效降低药企的研发成本和风险,缩短研发时间,提高研发效率,形成非常有针对性的专业化优势。
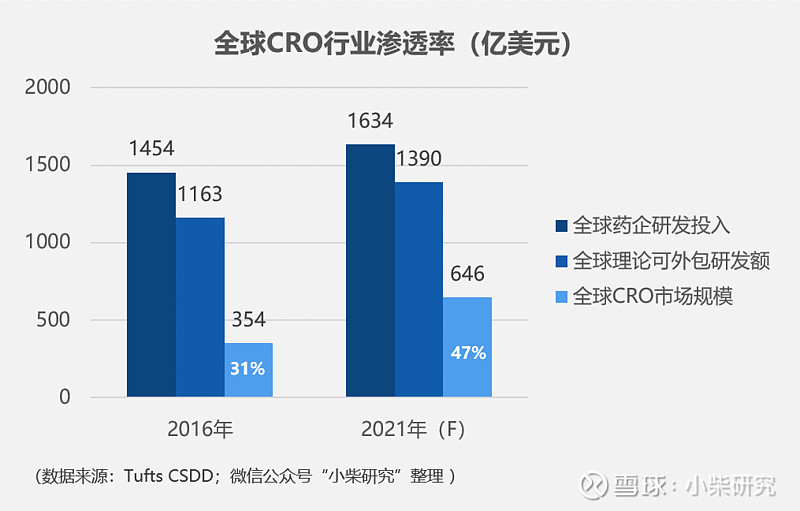
全球CRO行业从90年代开始步入快速发展期,经过30几年的积累,目前在全球医药研发领域的渗透率已经超过30%。根据Tufts CSDD数据,2016年全球药企研发支出1,454亿美元,理论可外包研发额为1,163亿美元,实际外包额为354亿美元,渗透率接近31%;预计到2021年,全球药企研发投入将达1,634亿美元,理论可外包研发额为1,390亿元,CRO渗透率有望达到47%,实现646亿美元的市场规模。
从全球市场来看,这是一个千亿美元市场,而且市场集中度还不高,特别是留给中国企业的成长空间还很大!
根据Frost & Sullivan于2019年发表的行业研究数据,预计2020年,整个CXO行业(CRO和CMO/CDMO)市场规模将突破1,000亿美元大关,其中CRO市场规模预计将达到719亿美元,CMO/CDMO将达到346亿美元。
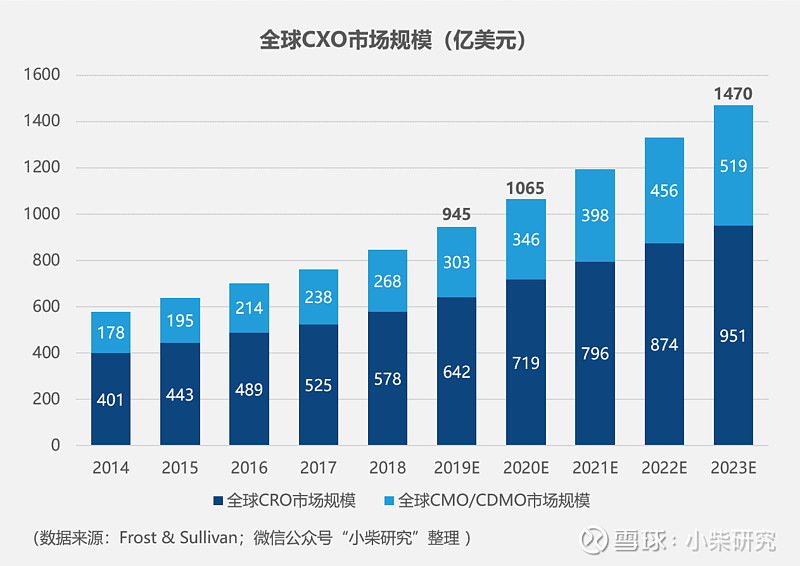
四、中国CXO市场
我国CXO行业目前所处阶段很像美国CXO爆发式增长的前夕。
从美国同行发展历程来看,这个行业于1970年代产生,90年代初美国仿制药竞争加剧叠加美国整体控制医疗费用支出,催生出了CXO在美国长达10年的超长景气周期,成就了数量众多的国际巨头。而我国药企原有的“仿制药创新药”营销模式正走向终结,我国医药产业正处于大破大立之时,其现状也很像国际药企在90年代面临的专利悬崖。
除此之外,中国的CXO企业除了本土药企天然的需求外,它还面对着全球订单这个大蛋糕。90年代末,我国CXO产业随着外资药企向低成本地区离岸研发外包而建立,到了2018年,我国CXO行业规模已经达到58亿美元。回顾处于类似阶段的美国同行,它们的股价都走出了一波“持续5年以上、年化35%以上收益”的行情。
我国CRO行业经过30多年发展,已成为国际药企外包首选。底层逻辑无外乎以下几点:
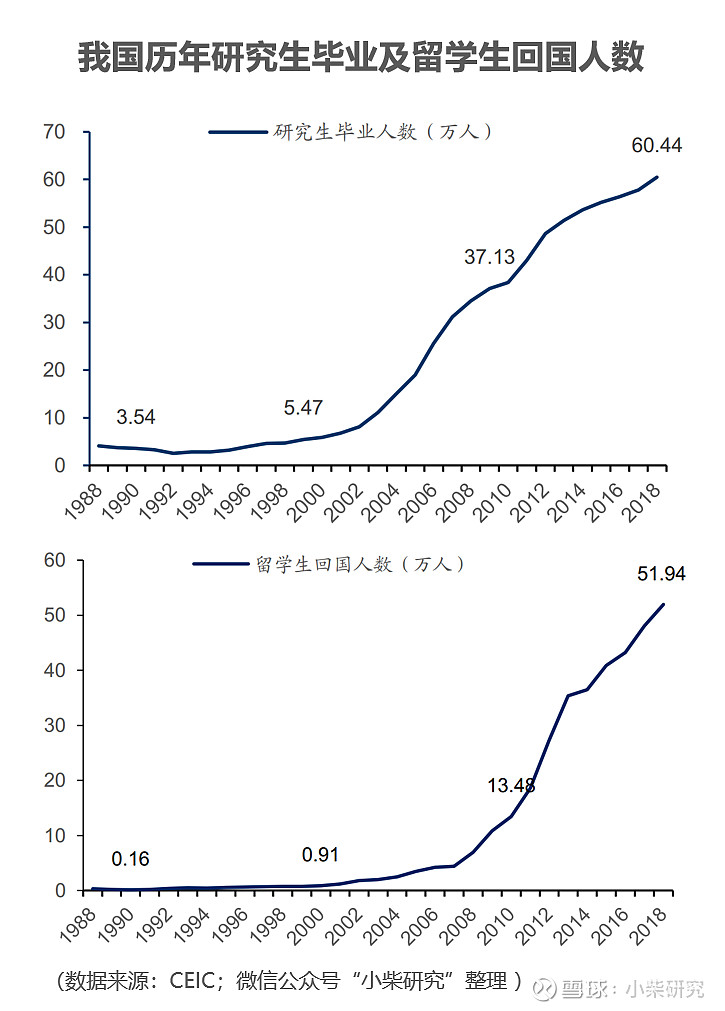
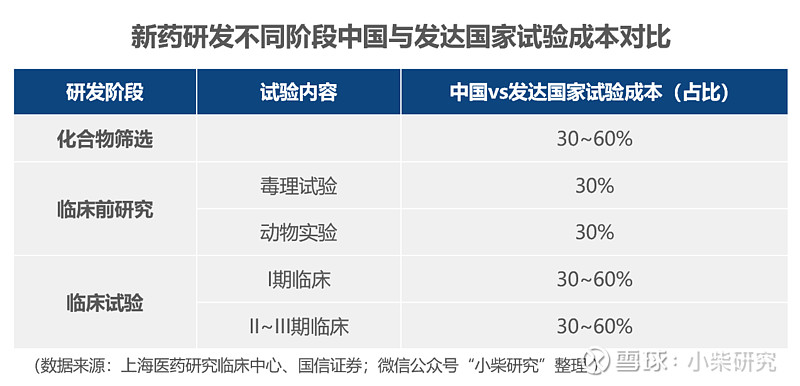
1)中国的工程师红利带来领先的成本优势。CRO行业属于人才密集型行业,需要化学、医学、药学、生物统计学等各领域的专业人员提供服务。受我国高等教育招生规模扩招、研究生毕业人数增长、海外高素质人才归国数量提升等因素影响,医药研发领域人才资源储备丰富,且人力成本相比发达国家有显著优势,使国内CRO企业的竞争力提升。在化合物筛选、临床前与临床试验各阶段,国内试验成本仅有发达国家试验成本的30%~60%,能够大幅节约研发支出。
2)包括中国在内的亚太地区,患者基数大,招募难度较低,从而大幅降低临床CRO成本。CRO产业链中,外包率最高、市场最大的无疑是临床阶段。即便是海外啥啥都有的超级大药厂,在临床阶段,也会有近一半的外包率。原因就在于患者招募太难。然而,亚太地区的中国、印度等国家人口众多,较高的人口基数导致各类药物适应症的患者基数大,为临床试验的患者招募工作提供更大的便利,有利于降低招募成本,加快临床试验进度,缩短药物研发周期。以PD-1/PD-L1为例,国内患者招募的入组速度中位数是美国的5~7倍。
目前,中国CXO龙头承接海外收入占比在60~90%之间,但伴随国内医药企业在政策引导下由仿制药向创新药过渡,本土医药研发需求爆发,尤其是创新药的研发热度持续升高。
2013~2018年A股上市公司研发支出大幅提升,五年复合增长率达31.75%。恒瑞医药、复星医药等龙头企业的研发支出也大幅提升,而随着新药进入收获期,相信中国医药产业将逐步走向提高创新药占比的正循环。
药审中心(CDE)数据显示,2018年CDE受理的1类化药创新药注册申请共有157个品种, 其中受理创新药NDA有16个品种,较2017年增长了一倍。治疗用生物制品的临床申请与上市申请受理数量也大幅提升。
总体而言,随着我国医药行业政策引导向创新方向转变,内资创新药研发将成为CXO行业需求的另一大重要来源。
五、行业动能
长期来看,CXO行业景气度有充足保障,无论是全球还是中国市场。其增长动力主要来自四个方面:大型药企不断增长的研发投入、Biotech研发活跃程度进一步提升、不断推高的行业渗透率和有利的政策支持。
1、大型药企研发投入进一步增长
CXO行业与医药产业的成长性和药企研发投入息息相关,无论全球市场还是中国市场,药企的研发投入始终保持较快的增长速度。根据Frost & Sullivan统计,2018年全球医药行业研发投入1,740亿美元,从2014年起,五年复合增长率5.3%;其中,美国药企占比最高,达到736亿美元;中国药企增速最高,达到174亿美元,五年复合增长率达16.9%。
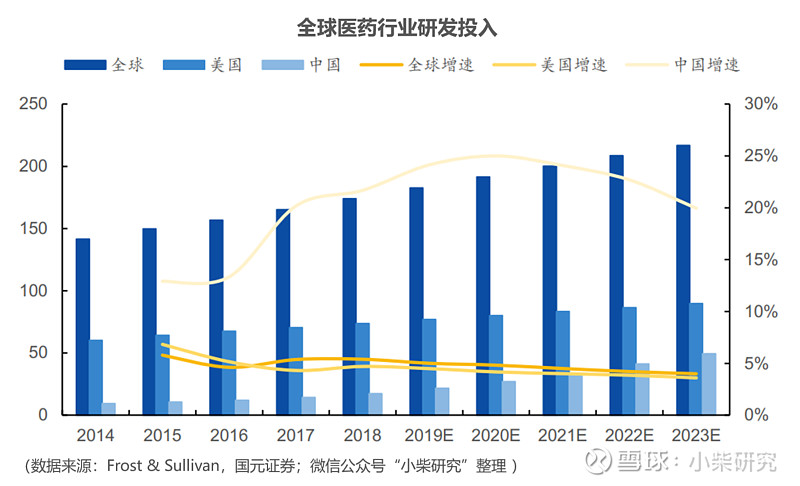
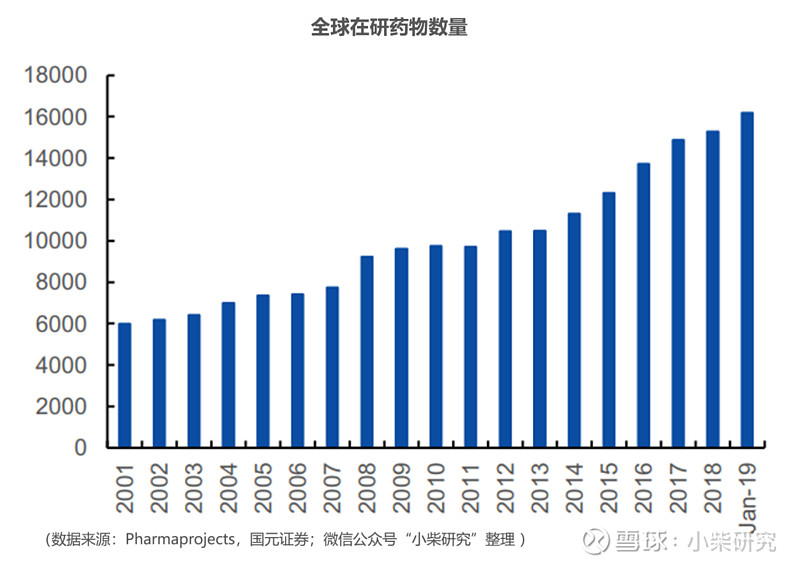
2019年全球在研药物数量再创新高。根据Pharmaprojects统计,截止2019年1月,全球在研新药数量16,181,在老药竞争加剧的行业格局之下,新药的研发仍是药企的唯一出路。
2、活跃的Biotech,为CXO提供源源不断的订单
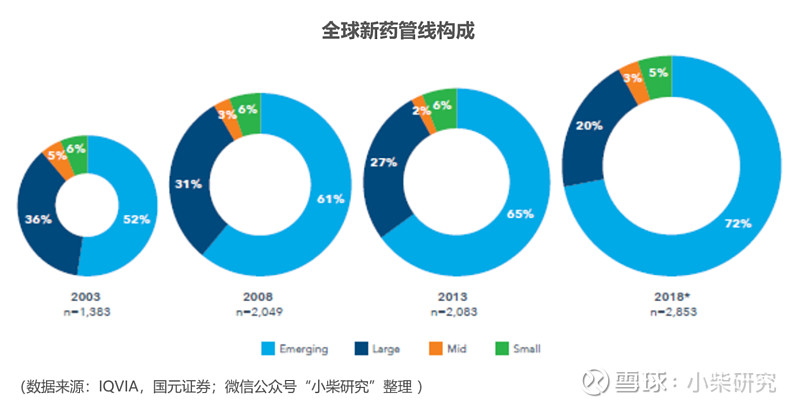
随着药物研发方向从传统的小分子化学药转向以肿瘤治疗为目的的生物药与细胞治疗,目前全球医药行业呈现较为明显的分工趋势,新药研发由于风险高、收益高,逐步由创业型生物医药企业(Biotech)担当主力,大型跨国药企再根据新药早期临床数据选择是否收购。根据IQVIA统计,全球Biotech管线占比已从2003年的52%增长至2018年的72%。然而,由于Biotech公司一般都规模较小,导致他们对CXO企业的依赖程度更高。
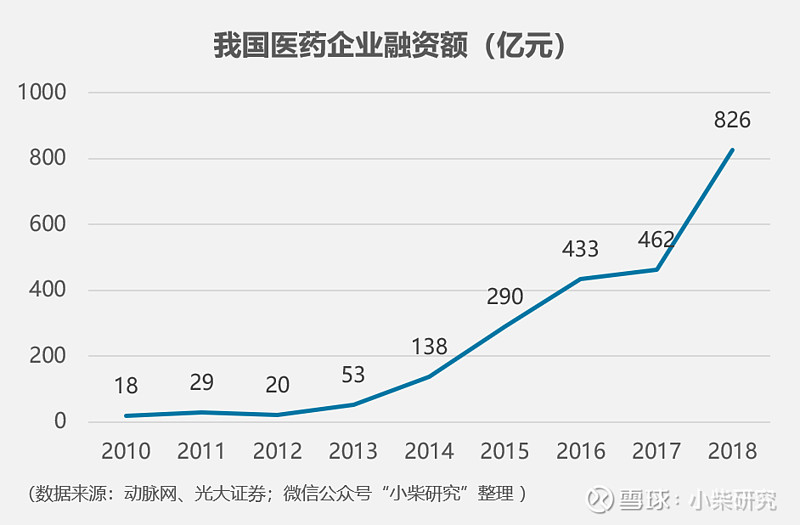
从全球视角来看,生物医药行业一级市场投资一直是一个风口,2018年全球医药健康领域融资事件达到1,410起,融资额超过338亿美元,同比增长57%,其中投资于生物医药行业金额最高,达到138亿美元;次之医药研发,达到69亿美元。国内市场,Biotech公司如雨后春笋般涌现,2018年一级市场融资额再创新高,达826亿元,同比增幅79%。2018年,内资Biotech公司在国内开展的I~III期临床试验约284例,占内资药企比例为38%,这一数字也在逐年上升。
3、不断推高的行业渗透率
无需赘言,前文已有分析。
4、有利的政策支持
近些年,我国连续出台各项政策,大力促进和支持中国医药产业由仿制药主导向创新药方向演进,这里仅举例几个对CXO行业影响更为重大、更为直接的政策。
1)2003年GCP(Good Clinical Practice,药品临床试验规范)和GLP(Good Laboratory Practice,药品非临床安全性试验规范)的确立为CXO行业制定了基本规范、奠定了发展基础。
2)2015年之后,药品审评效率提高,创新药上市进度显著提高,激发中国创新药研发热情。
3)2017年中国CFDA加入了ICH(国际人用药品注册技术协调会),这是于1990年由欧共体、美国和日本三方政府药品注册部门和制药工业协会共同发起成立,旨在药品注册技术领域协调建立关于药品质量、安全性和有效性等的共同国际技术标准和规范,从而减少药品研发和上市成本,推动创新药品及早用于治疗患者的一个组织。经过二十多年的发展,ICH发布的技术指南已经为全球主要国家药品监管机构接受和转化,成为药品注册领域的核心国际规则制订机制。
加入ICH后,中国临床试验的理念、规则、制度、技术,全面与国际接轨,国家也不断颁布相关政策和法规,加强临床试验监管,对行业运行的真实性、规范性提出更高要求。在改革临床试验管理方面,提出临床试验机构资格认定实行备案管理,同时鼓励社会力量投资设立临床试验机构,探索临床研究整体解决方案。与之前采用的认证制相比,临床试验机构备案制流程大大简化,时间周期也能很好缩短,其真正落地执行,将为很多新药临床试验机构带来更多的参与新药临床研究的机会。
4)2019年MAH制度落地,成为CXO行业高速发展的有力支撑,对CXO企业意义重大。MAH全称Marketing Authorization Holder药品上市许可人制度,指拥有药品生产技术的主体在获得药品上市许可后,对药品质量在其整个生命周期内承担主要责任,持有人可选择自行生产药物或委托其他主体生产,在这一制度框架下,药品上市许可与药品生产许可可以分离,药品产业链上的生产要素可以更加灵活地配置。也就是说,一方面小型药企可以轻资产运营,激发他们的研发活力;另一方面,如果CRO企业自研能力很强的话,也可以自行开发新药,然后依托下游的CMO/CDMO进行生产、CSO进行销售,整个过程无需自建工厂即可实现药品的上市销售。厉不厉害!这个制度2019年12月1日开始实行的,正好A股CXO板块也是从12月初开始,被“机构抱团行情”青睐。
六、中国CXO市场竞争格局
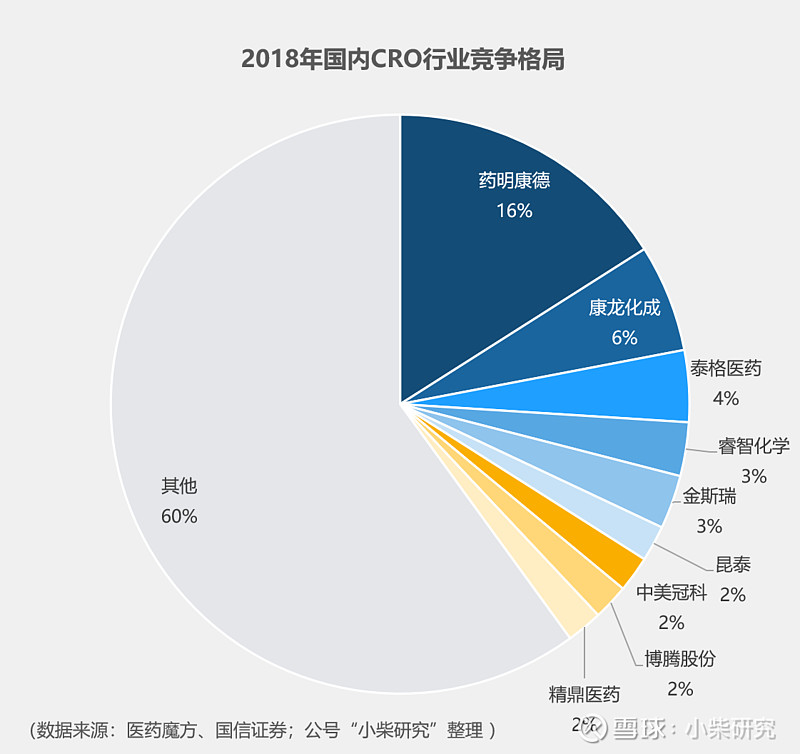
国内CXO行业竞争格局可以简单总结为“一超多强”,“一超”就是药明康德,啥啥都牛;但是“多强”的成长潜力和市场机会也不容小觑。
暂不考虑市场各主要竞争对手的独门秘籍,我们单纯从简单的商业逻辑上来讲,CXO可是当前最潮的“流量经济”。上游CRO能为下游CMO/CDMO引流;CRO赛道内部各个细分领域中,药物发现CRO、临床前CRO又能为临床CRO引流。这么看,一个龙头应具备的关键素质就是“全产业链的一站式服务”能力,这是目前国际巨头已经形成的局面,也是奠定CXO企业在行业内竞争地位的基础。而国内呢,最典型的一站式服务平台,当属药明康德。
1、CRO市场格局
据火石研究院统计,目前国内CRO和CMO/CDMO企业合计多达1500多家。500多家CRO企业中,临床阶段240多家,临床前260多家,综合服务外包15家;国内CRO企业规模基本都不大,总体业务还比较分散。
另外,新药研发环节相当多,不同阶段对CRO企业的核心能力要求也各不相同,因此我们有必要把CRO赛道拆碎,再就每个细分领域一一看其核心技术门槛、市场实际需求。
先看一下CRO全景。
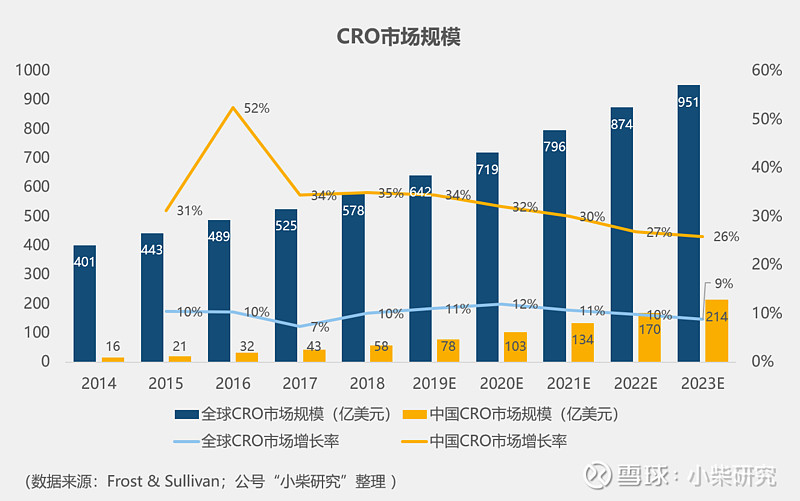
中国CRO市场自2014年起,一直保持年均30%以上的高速增长,预计2018~2023年,中国CRO市场复合增长率将达到30%,矿在生长。
1)药物发现
药物发现是一个多学科协作的系统性工程,对研发人员的技术要求较高。其核心竞争力主要体现在化合物库的大小和针对相应靶点可设计相应先导化合物的能力上,2018年全球CRO市场中药物发现阶段占比20%。
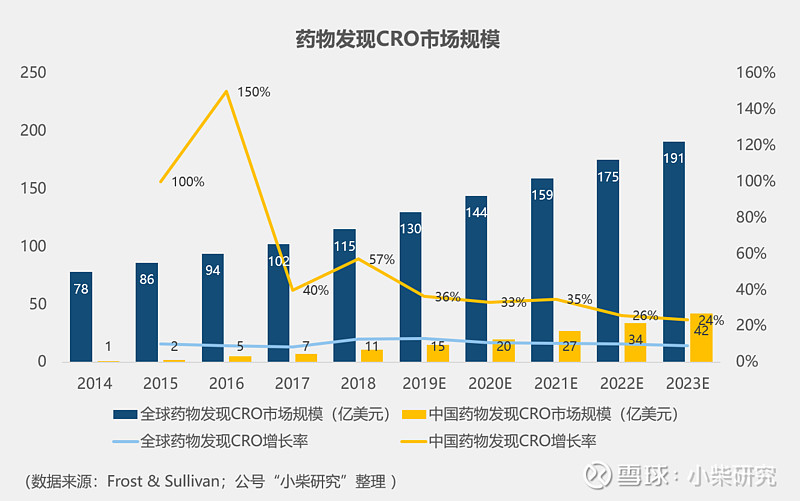
药物发现是CXO产业链的最前端,这个行业既可以成为产业链其他环节的流量入口,也可以成为“全球药企研发活跃程度的晴雨表”。
对于国内CRO企业来说,中国药企研发能力仍在起步阶段,市场上仿制药的占比较高,所以这个阶段的市场渗透率实际高于国际水平,且这个环境也有利于增强药企与CRO企业的合作粘性。而国际药企的研发能力很强,药物发现阶段多为企业核心机密,因此外包研发占比也就相对较低。
国内几个提供药物发现服务的重点公司有药明康德、药明生物、睿智医药、康龙化成、成都先导等。
从技术平台角度来看,药明康德相对服务内容最为广泛,涵盖从传统的FBDD、SBDD到HTS、DEL库等服务。第二梯队的睿智医药、维亚生物等涵盖传统新药研发相关服务,药明生物专注大分子药物开发,康龙化成、药石科技和成都先导则比较专注提供部分特色服务。
那我们应该怎么看这个细分领域呢?
以下三个指标是我们需要关注的:一是大型药企的研发费用支出,因其与药物发现CRO联系最为紧密;二是一级市场投融资情况,别忘了2018年全球72%的研发管线由中小型Biotech公司贡献;第三就相当宏观了,基础生命科学的研究成果,看看就好。
药物发现技术手段多种多样,主体思路分三类:
第一、最简单的是对已知化合物进行改造,但要想得到Me-Better药物也不容易。
第二、根据靶点特征进行有选择性的筛选和设计,总体耗时较长,需要靶点具有明显的三维结构,以FBDD(Fragment-based drug discovery,基于片段的药物发现)和SBDD(Structure-based drug design,基于结构的药物设计)为代表。
第三、大海捞针式的海量化合物筛选,以HTS(High-throughput screening,高通量药物筛选)、DEL库(DNA Encoded Library,DNA编码化合物库)为代表,HTS成本较高而DEL库的合成技术难度大。
据可考数据,从已知化合物中筛选、HTS和SBDD是药企最主要的临床候选药物来源。此外,随着AI技术发展,计算机辅助药物设计(CADD)也进入药企视野,能否发挥所长值得期待。
2)临床前CRO
药物发现后,我们就得到了候选药物,药企接下来就需要开始一系列碎片化研究,涵盖三大学科:药学(研究评估药物的结构、分子式、理化性质等等)、药理学(研究评判药物与机体之间互相作用的原理,这里又能进一步细分成一般药理研究、药效研究、药代动力研究三种)、毒理学(研究药物的长期毒性、生殖毒性、致癌性等等)。
2018年全球临床前研发费用196亿美元,其中CRO外包84亿美元,渗透率43%;中国市场临床前研发费用33亿美元,其中CRO外包15亿美元,渗透率45%,基本与全球水平相当。
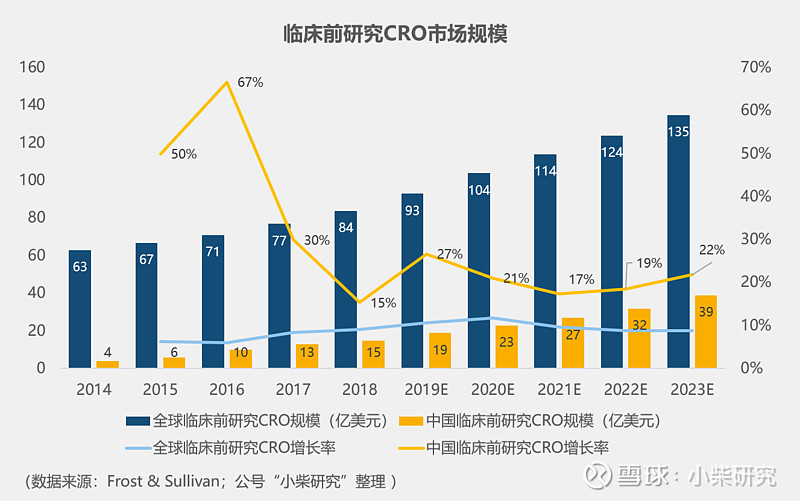
临床前CRO的主要工作是各类实验室项目,所以它的核心资源就是具备一定素质的生物化学工程师。药学研究重点在于原料药和制剂的工艺开发,属于精细化工业;药理学研究在于实验室人员的熟练程度和动物模型的丰富程度;毒理学研究重点则在于实验动物的管理以及GLP实验室的资质认证。
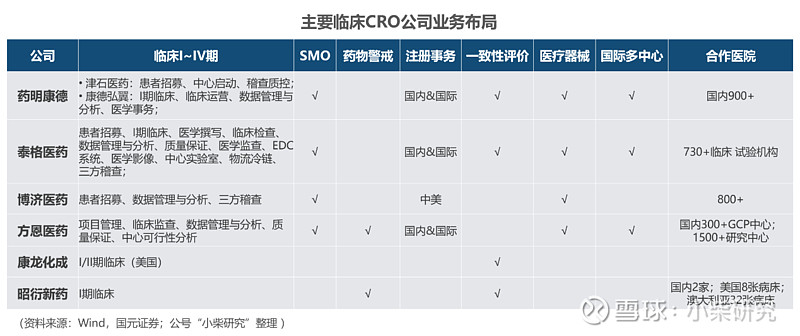
国内主要临床前CRO公司业务布局如:
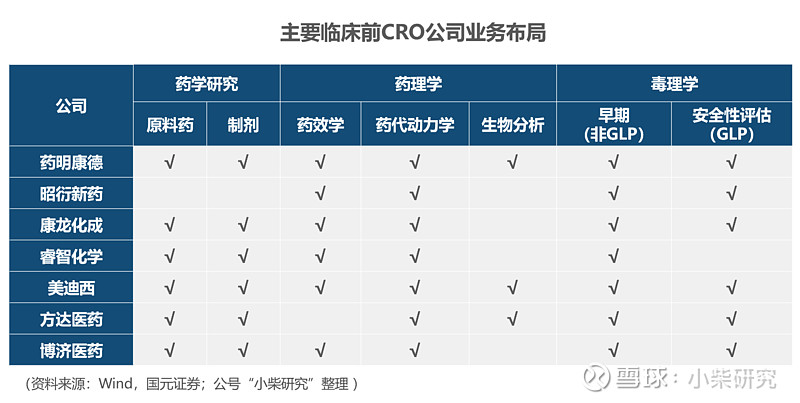
三大板块中,药理学涉及较多实验室服务,对技术要求较高,中国的工程师红利赋能中国企业具备领先优势。而药学涉及原料药和制剂工艺开发、毒理学涉及动物产能和实验室GLP资质(Good Laboratory Practice药物非临床研究质量管理规范,是国际通行的药物临床前研究必须遵循的基本准则,行业规范),对技术要求一般,更多依仗企业的资本支出。
3)临床CRO
整个CRO产业链中,外包率最高、市场规模最大莫过于临床阶段了。
中国临床CRO市场规模占比全球没有前两项(药物发现和临床前)高,这主要归咎于中国创新药研发起步较晚等原因,算是中国CRO产业链的一个短板。但是,中国临床CRO市场增速堪称无敌。
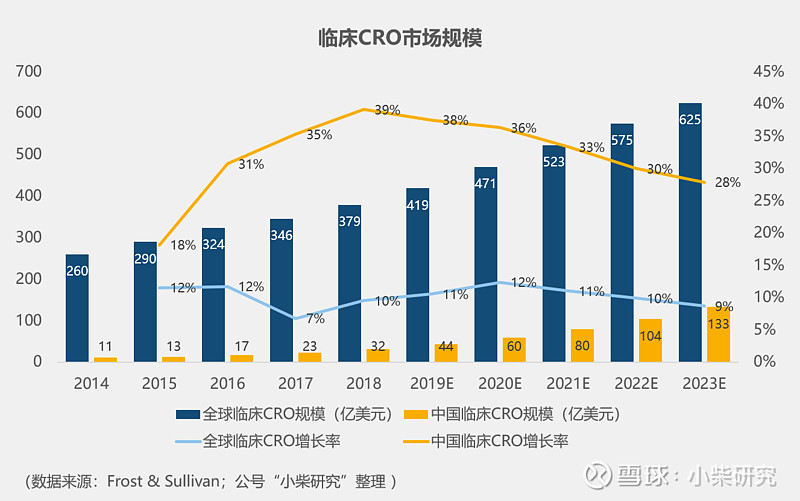
临床试验环节很多,导致临床CRO业务也较为碎片化,因而决定临床CRO壁垒的核心竞争力也众多。
从技术角度来说,临床CRO的核心竞争力体现在:一站式服务能力、数据统计和分析能力、PI(Principal Investigator,主要研究者)和研究中心资源、SOP(Standard Operating Procedure,标准作业程序)流程等方面。而这些核心竞争力的诞生和演进是伴随整个医药产业发展而来的,国内创新药发展较为落后,这导致药企和CRO企业临床干预方案设计、临床数据管理系统、数据统计和分析系统等都不够完善,造成了与海外巨头的较大差距。
从市场角度来说,临床CRO需要企业具备全球化能力。毕竟它要做的是帮助不同药企在不同国家又快、又好的招募患者入组、完成临床试验。
上述两点叠加,就导致了这个细分行业非常容易形成马太效应,规模越大,越容易招到人才,越能在信息化上进行投入,从而越能积累数据,越能较快实现全球化布局。总的来说,从业公司的人员数量、人员结构、人员质量(项目经理、临床监察员、试验协调员、主要研究者等等),以及这些人员指标的增量、增速,是较能侧面体现该业务板块竞争力的指标,毕竟,这些都是临床CRO的“供给侧”。
从这几个主要公司的业务布局来看,国内临床CRO确实需要补课了。但事有两面,中国这么大的人口基数(患者招募相对容易)、这么强势的工程师资源、这么广阔的市场空间,这个行业没理由不与国家一同成长。
4)小结
中国CRO,三大细分都处在高速增长阶段,特别是临床阶段这一最大市场的空间尤为广阔,也短板明显,值得关注。
2、CMO/CDMO市场格局
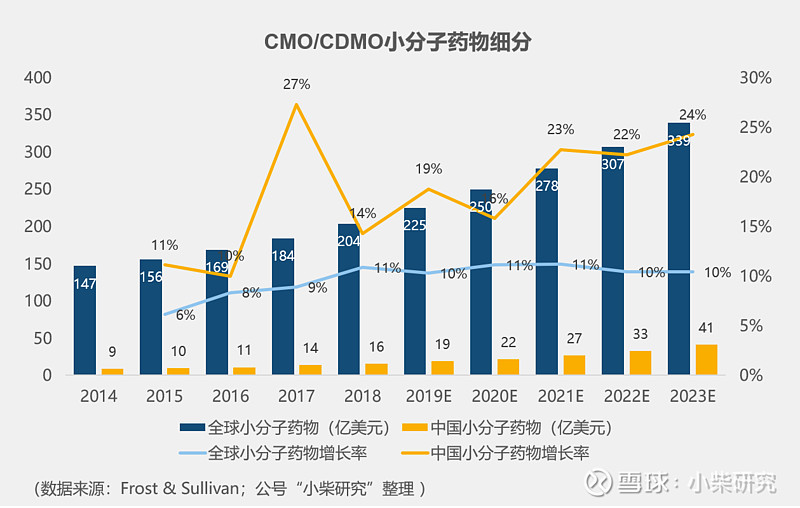
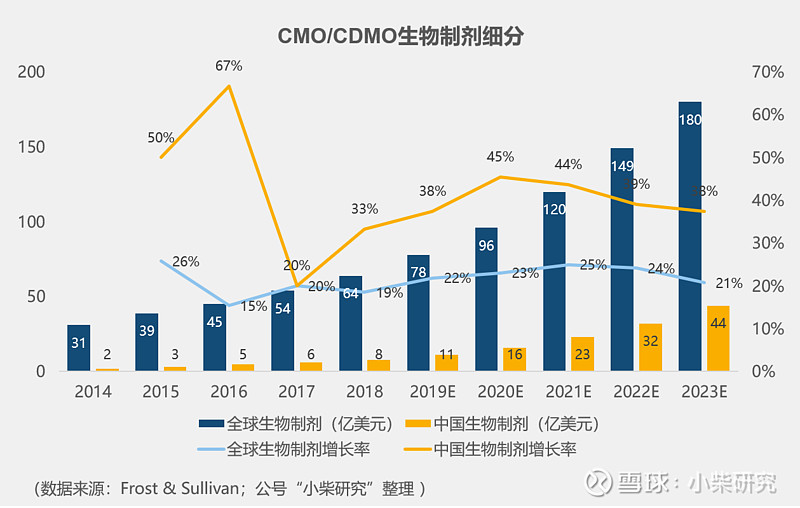
中国CMO/CDMO近年来也一直处于高速发展趋势,在每一个细分领域都保持着年均20~30%的增速。
CMO企业接受药企委托代工生产,涉及到临床用药、中间体制造、原料药生产、制剂生产和包装等服务。CDMO企业更侧重于高技术附加值的工艺开发步骤,为药企提供创新药生产时所需要的工艺流程研发及优化服务、配方开发及试生产服务等,同时进一步提供从公斤级到吨级的定制生产服务。因此,我们看CMO/CDMO企业时,其工艺研发能力和反应釜生产能力是核心要素。
国内小分子细分领域受MAH制度的带动,将进一步高速发展,在这个领域较有竞争优势的公司有药明康德(合全药业)、凯莱英、博腾股份、九洲药业、普洛药业和药石科技。
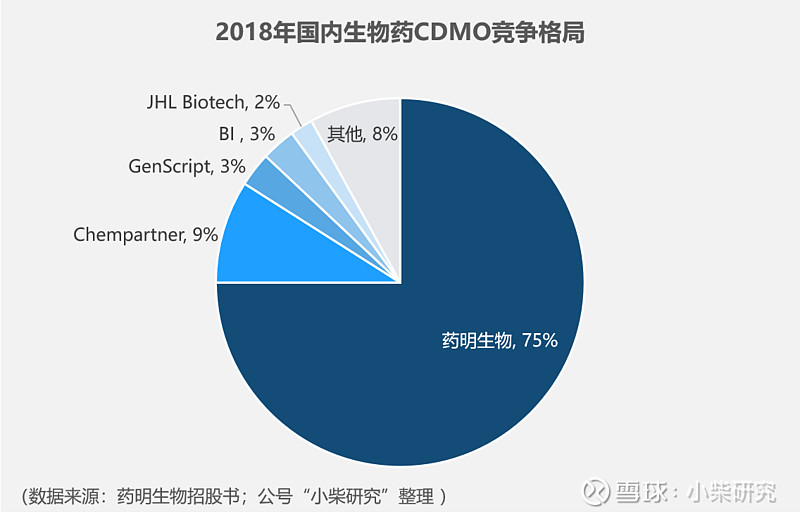
国内生物制剂领域,药明生物是绝对龙头,2018年国内市场份额占比75.6%。
@今日话题 $药明康德(SH603259)$ $泰格医药(SZ300347)$ $凯莱英(SZ002821)$ #2021雪球投资炼金季# #价值投资# #CXO#