今天,书呆老李要讲一讲Dynavax公司(纳斯达克股票代码:DVAX),一家研发乙肝疫苗和免疫类药物的公司。熟悉医药股的朋友肯定知道,Dynavax公司最核心的产品是新型乙肝疫苗Heplisav,已经数次提交FDA,每次都因为种种原因被FDA否定。7月28日,FDA咨询委员会就Heplisav安全性进行投票,投票结果11比1支持。8月10日,FDA将公布最终的审评结果。
书呆老李曾经讲过这只股票风险极大,普通投资人最好不要碰,即使有了今天这样的投票结果,Dynavax公司股票肯定会有一轮大涨,我的观点也不会改变。书呆老李就梳理一下Heplisav乙肝疫苗的审批历程,以及Dynavax公司和FDA十年间的斗争。
Heplisav乙肝疫苗的机制
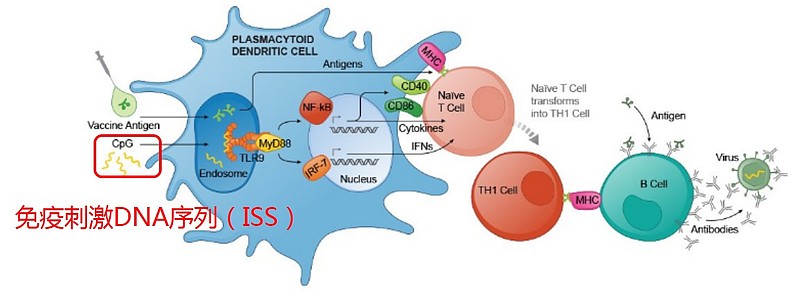
Heplisav乙肝疫苗是在普通疫苗里加入Dynavax公司发明的免疫激活序列DNA序列ISS(immunostimulatory sequence),该技术建立在2011年诺贝尔奖基础上,不仅放大免疫信号,而且让免疫反应更有针对性。Dynavax公司开发的所有产品都基于这个思路,区别在于:有的产品基于免疫激活序列DNA序列;有的产品基于免疫激活序列RNA序列。
如果Heplisav乙肝疫苗获得FDA批准,证明ISS这个研发思路是可行的。理论上讲,所以涉及免疫的药物都可以使用这种技术。这样就和如今大火的肿瘤免疫治疗沾上边,又有了大家热烈讨论的SD-101。关于SD-101,以后有机会详细说,本文主要还是关注Heplisav乙肝疫苗。
Heplisav乙肝疫苗的疗效
Heplisav乙肝疫苗的疗效毋庸置疑。Dynavax公司在过去16年里做了14个临床实验,1万多病例,所有对照实验中,Heplisav完胜普通疫苗,无一例外。
1)普通疫苗要打半年或一年,Heplisav只需1个月;
2)普通疫苗要打3针或4针,Heplisav只需2针;
3)普通疫苗对慢性肾病病人要打8针,Heplisav只需3针;
4)普通疫苗效果不佳的病人(需要透析的患者、患有二型糖尿病的患者),Heplisav依然有良好的药效。
其实,Heplisav乙肝疫苗被FDA反复否定多年,给出的理由都是安全性问题。书呆老李详细讲讲这里面波折起伏的故事。
Heplisav乙肝疫苗严重的不良反应事件
2008年,Dynavax公司对Heplisav乙肝疫苗正在进行3个三期临床试验,分别针对18到70岁的成年人、40岁以上的成年人和慢性肾病患者。
注:40岁以上的成年人和慢性肾病患者对普通疫苗效果不佳。
在美国境外进行的三期临床研究中,接受Heplisav乙肝疫苗的一个受试者发生了严重的不良反应事件,该受试者被诊断患有韦格纳肉芽肿病,一种血管发炎的罕见疾病。FDA因此中止了Heplisav乙肝疫苗所有临床试验,Dynavax公司的股价也从50多美元跌到不到3美金。
其实,Heplisav乙肝疫苗完成了1万多例的临床试验,其中包括一个8000多患者的大型安全性临床试验,严重不良反应只有这一例。
另外,这例严重不良反应的原因,到今天也没有明确的说法。
这例严重的不良反应事件成为Heplisav乙肝疫苗永远摆脱不掉的噩梦,每次FDA进行审评,都被人拿出来说事。
严重的不良反应事件的解决
2009年,经过Dynavax公司反复申诉,Heplisav乙肝疫苗针对40岁以上的成年人和慢性肾病患者三期临床试验得以继续。大家渐渐把这件事淡忘,公司股价也慢慢恢复正常。其实,这件事远没有解决,也就有了Heplisav第一次被FDA拒绝批准。
Heplisav第一次被FDA拒绝
2011年,Dynavax公司完成Heplisav乙肝疫苗针对40岁以上的成年人和慢性肾病患者三期临床试验,向FDA提出BLA申请。
正式向FDA提出BLA申请前,Dynavax公司和FDA做了一些沟通,提出Heplisav乙肝疫苗适应人群为40岁以上的成年人和慢性肾病患者。FDA认为Dynavax公司太过保守,建议以18到70岁的成年人为适应人群申请BLA,申请获得批准后,再拓展适应人群到慢性肾病患者。
Dynavax公司花费两个月时间,重新撰写了申报资料,提交BLA申请。FDA咨询委员会对Heplisav乙肝疫苗投票,疗效13比1支持,安全性8比5反对(一票弃权),理由是Dynavax公司不能证明Heplisav乙肝疫苗在18到70岁人群中的安全性,还有就是那例严重不良反应事件。
看到这里,大家是不是能明显感觉到FDA对Dynavax公司的恶意。
Heplisav第二次被FDA拒绝
Dynavax公司吸取教训,重新针对40岁以上的成年人和慢性肾病患者提出申请。FDA给出的审评意见也算奇葩:疗效强烈认可;限制使用范围可能限制受益人群,对患者不利;即使限制使用,安全性数据也不充足。
FDA给出的最终结论是:补充安全性数据,继续申请18-70岁患者。
Heplisav乙肝疫苗大规模安全性临床试验
Dynavax公司也只能认下这个结果,开启了一个8000多人的三期安全性临床试验。试验结果显示:疗效上完胜常规疫苗;没有任何安全性问题。
Heplisav第三次被FDA拒绝
2016年,完成大规模安全性临床试验后,Dynavax公司向FDA提出BLA申请。本来已经定好PDUFA日期,FDA先是推迟PDUFA三个月,之后直接取消询委员会审议Heplisav乙肝疫苗的BLA。
FDA直接给出审评意见:重新提交申请,6个月后给出审评意见。给出的理由是:FDA没有完成不良反应资料的审核;心脏不良反应数值失衡。
心脏不良反应数值失衡指的是:常规疫苗组,心脏不良反应发生率出人意料的低,也就是说,Heplisav乙肝疫苗没有什么心脏安全性问题。个人感觉,FDA纯属刁难。
重新提交申请
阅读Dynavax公司的Press Releases时,我感觉Dynavax公司对重新提交申请也有些绝望,进行了裁员,将研发重点放在SD-101,甚至停止了Heplisav的生产。绝望归绝望,申请还是要重新提交的。
Heplisav乙肝疫苗的疗效确实没话说,FDA也认为疗效无需投票,咨询委员会仅对安全性投票。也就有了文章开头11比1支持的投票结果。
看到这里,大家是不是也松口气,感觉Heplisav马上就要获得批准。
咨询委员会的投票结果和FDA最终的审评结果
一般来说,咨询委员会的投票结果和FDA最终的审评结果是一致的。最近几年,FDA越来越不重视咨询委员会的投票结果,大概有10%的情况结论不一致。FDA和咨询委员会观点发生分歧,通常是咨询委员会否定新药,FDA选择通过。Heplisav乙肝疫苗最终的命运8月10日见分晓。
写到这里,书呆老李总结一句:Heplisav乙肝疫苗确实是一个好药;Dynavax公司和FDA到底有什么恩怨,我也不清楚。不过预测它的审评结果基本上不可能,作为一个普通投资人,还是安安静静的看戏就好。